UPS抑制剂对成年大鼠脑内淀粉样蛋白沉积和神经新生的影响
高 林 田元元 薛 春 商超蔚 李林英 王慧宇 苗云飞 亢园园 贺维亚
河南大学临床学院 开封 475000
阿尔茨海默病(Alzheimer's disease,AD)的病理改变以脑组织内出现老年斑、神经原纤维缠结及神经元丢失为特征。而Aβ的沉积是其发病的中心环节[1]。另外,Dickson等人报道[2],正常老年人尸检也能见到老年斑,但却未发病,看来AD和正常老年人之间并无质的区别。为此,我们认为这可能与脑内异常蛋白的处理、降解β淀粉样蛋白的处理能力(也即泛素-蛋白酶体系统)不同有关。笔者采用腹腔注射泛素-蛋白酶体抑制剂,建立脑内淀粉样蛋白沉积大鼠模型,以观察大鼠行为学、脑内淀粉样蛋白和神经新生的影响,探讨阿尔茨海默病的发病机制和制定治疗策略提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂与药品:①试剂:尿嘧啶脱氧核苷(bromodeoxyuridine,BrdU)购于美国Sigma公司。BrdU抗体、链霉卵白素(SP)染色试剂盒和二氨基联苯胺(DAB)显色试剂盒均购自北京中山试剂公司。②水迷宫(张家港生物医学仪器厂),江湾Ⅰ型C立体定向仪(第二军医大学),微量注射器(上海华亭精密仪器厂)。
1.1.2 实验动物:成年雄性SD大鼠57只,鼠龄2个月。体质量200~300g,平均260g左右,均由郑州大学实验动物中心提供。
1.2 实验方法
1.2.1 学习记忆测试方法:大鼠适应性喂养1周后,进行水迷宫测试。5次/d,2min/次,共5d。第3d开始记录逃避潜伏期(大鼠从入水至找到并爬上平台所需时间),一般在第3d动物逃避潜伏期均在20s内。如在第5天,动物逃避潜伏期仍大于20s即作为淘汰指标。共淘汰12只动物,其中死亡6只,1只视力障碍。造模2个月后,再次行水迷宫测试,5次/d,2min/次,共5d,第3天开始记录逃避潜伏期。
1.2.2 分组与动物模型制备:57只大鼠分别分为实验组(腹腔注射泛素-蛋白酶体抑制剂)、对照组和正常空白组等3组,实验组15只,对照组15只,空白组15只动物。参照Ni等[1]的方法制备大鼠模型(腹腔注射泛素-蛋白酶体抑制剂0.03mg/kg),对照组给予同体积的生理盐水。所有大鼠手术后均置于通风的动物房饲养60d后,各组进行行为学习记忆测试。饲养和造摸期间共淘汰9只(实验组3只,对照组4只,空白组2只)。
1.2.3 免疫组化检测:①BrdU染色法[3]:腹腔注射Brdu(50 mg/kg),1次/8h,3次/d,连续注射5d。末次注射24h后经左心室常规灌注多聚甲醛冲洗,常规固定、脱水、浸蜡、包埋,石蜡切片,层厚约为5μm,免疫染色步骤严格按照试剂盒说明书进行,脑组织切片用磷酸盐缓冲液(PBS)冲洗3次,2min/次。DNA变性处理:50%formamide/2×SSC(枸橼酸盐水)于65℃下共反应2h,倾去液体后以2×SSC冲洗5min;2mol/L盐酸37℃处理30min;以pH 值为8.5的硼酸缓冲液冲洗后室温下反应10~15min,而后用含10%血清、0.1%Ttiton 100的磷酸盐缓冲液37℃封闭30min,加入鼠抗Brdu 4℃过夜,磷酸盐缓冲液冲洗3次,10min/次;加入稀释的生物素化兔抗小鼠二抗(1∶80),37℃反应2h;磷酸盐缓冲液冲洗3次,5min/次;加入辣根过氧化物酶室温下反应1h后DAB显色,室温晾干,二甲苯透明后中性树胶封片。于光学显微镜下观察海马齿状回神经前体细胞增殖情况。②改进的甲醇刚果红染色:行为学记忆测试结束后,断头取脑,用冰冻生理盐水冲去血渍,置新配4%多聚甲醛固定,常规脱水、石蜡包埋。取海马脑组织块做冠状切片,常规脱腊至水,Harris苏木精染色5~10min,温水显蓝,自来水冲洗数分钟,1%盐酸酒精分化数秒钟,温水显蓝,自来水冲洗数分钟,甲醇刚果红染色15min,自来水冲洗数分钟,0.2%酒精分化数秒钟,温水显蓝,自来水冲洗数分钟,常规脱水、透明、封片。
1.2.4 半定量分析:每只大鼠随机选取6张非连续脑组织切片,于光学显微镜下任选5个高倍视野(×200)观察计数双侧海马区BrdU标记的阳性细胞数量。采用双盲随机法计算视野中阳性细胞数。
2 结果
2.1 学习记忆测试 正常空白组和对照组大鼠的学习记忆测试结果比较差异无统计学意义(P>0.05);实验组大鼠的学习记忆能力明显低于正常空白组(P<0.05)。见表1。
2.2 免疫组化检测
2.2.1 BrdU染色:光学显微镜下观察显示,各组大鼠海马区BrdU阳性细胞呈单个或两个分布,细胞核形态规则,主要分布于齿状回颗粒细胞层亚颗粒增生带中(图1~3)。实验组大鼠海马区BrdU阳性细胞计数显著减少,与对照组相比差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠逃避潜伏期和海马区BrdU阳性细胞数比较 ()
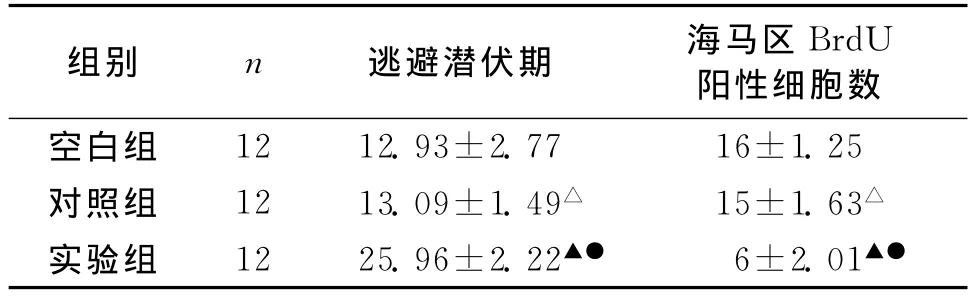
表1 各组大鼠逃避潜伏期和海马区BrdU阳性细胞数比较 ()
注:实验组与对照组比较,▲P<0.05;与空白组比较,●P<0.05;对照组与空白组相比较,△P>0.05
2.2.2 刚果红染色:对照组与空白组(图4)相比,海马区可见神经元旁有少量的染色阳性物质,其周围神经元形态基本正常,细胞排列层次稍有紊乱(图5)。实验组与空白组相比,海马区可见神经元旁有大量的染色阳性物质,其周围神经元皱缩,细胞排列层次明显紊乱,可见明显的胶质细胞浸润(图6)。
3 讨论
β-APP(β-amyloid precursor protein)是一种跨膜蛋白,广泛表达在各种类型和脑各部分的神经元,生理情况下合成后的APP仅10%成为跨膜蛋白,大部分在胞内被α-分泌酶水解生成具有明显神经营养作用的可溶性 Appα[4-5]。同时β-APP也是一种应激蛋白,在有害刺激作用下,β-APP表达上调,Aβ生成增加而可溶性Appα减少。但正常情况下机体修复机制可以及时降解应激时产生的Aβ而避免其累积[6-7]。
泛素-蛋白酶体系统(ubiquitin-proteasome sytem,UPS)是真核细胞内重要的非溶酶体蛋白降解通路。UPS能够利用其末端76位的甘氨酸与目的靶蛋白的α或ε-氨基共价结合,使目的蛋白能够带上泛素化标记,以便进一步降解。细胞内蛋白的泛素化作用参与了多种细胞生物学功能,例如细胞周期进程、细胞增生与分化、细胞凋亡等[8]。在UPP中E3连接酶是其选择性降解机制的关键因素,能够将Ub、底物蛋白还有26S蛋白酶体连接起来,起到了桥梁的作用。UPP中E3连接酶的数量众多,有研究表明,其中多种E3连接酶如parkin、HRD1、CHIP等都能够参与调控AD中两个重要效应分子tau蛋白和Aβ的降解[9-10]。本实验结果表明,腹腔注射泛素-蛋白酶体抑制剂2个月后,空白组未发病,说明空白组修复机制是正常的,可以降解或吞噬大量的Aβ而避免其沉积发挥神经毒性,保护了周边的神经元。而实验组结果说明机体的修复机制存在障碍,沉积的淀粉样蛋白使得其周边的神经元皱缩或丢失,从而表现出行为学习记忆障碍。本实验提示我们:泛素蛋白酶体系统衰退,促使了淀粉样的沉积。
在本实验中,经尿嘧啶脱氧核苷标记染色后显示实验组大鼠海马区神经前体细胞增殖能力明显下降,分析原因可能与淀粉样蛋白沉积对大鼠海马区神经前体细胞的增殖有抑制作用,这与体内[8]和体外[11-12]实验研究淀粉样蛋白对PC12细胞的增殖有抑制作用相一致。至于淀粉样蛋白对神经前体细胞的抑制作用是通过什么信号传导途径需进一步研究和探讨。

图1 空白组海马区Brdu阳性细胞数(×200)

图2 对照组海马区Brdu阳性细胞数(×200)

图3 实验组海马区Brdu阳性细胞数(×200)

图4 空白组海马区淀粉样蛋白沉积的变化(×200)

图5 对照组海马区淀粉样蛋白沉积的变化(×200)

图6 实验组海马区淀粉样蛋白沉积的变化(×200)
[1]Ni J,Ohta H,MatsumotoK,et al.Progressive cognitive impairment following chronic cerebral hypoperfusion inducedbypermanentocclusionof bilateral carotid arteriesin rats[J].Brain Res,2009,653:231-236.
[2]Nacher J,Rosell DR,Alonso Liosa,et al.NMDA receptor antagonist treatment induces a longlasting increasiin the number of prolife ating cells,PSANCAM immunoreactive granulenurons and redialgliain the adule rat dentateyrus[J].Neurosci,2010,13(3):512-520.
[3]Horner PJ,Gage FH.Regenerating the damaged dcentralnervous system[J].Natture,2011,407:963-970.
[4]Linda J,Van Eldik,Mark S,et al.The janus face of glial-derived S100B:Beneficial and detrimental functions in the brain[J].Restorative Neurology and Neuroscience,2011,21:97-108.
[5]Kato H,Kogure K,Arake,et al.Astroglial and microglial reactions in the gerbil hipp-ocampus with induced ischemic tolerance[J].Brain Res,2010,664:69-76.
[6]Liesi P,Kauppila T.Induction of typeⅣ collagen and other basement membrane associated proteins after spinal cord injury of the adult rat may participate in formation of the glial scar[J].Exp Neurol,2009,173:31-45.
[7]Kimelberg HK,Rutiedge E,Goderie S,et al.Astrocytic swelling due to hypotonic or high K+radium causes inhibition of glutamate and aspartate uptake and increases their release[J].Cereb Blood Flow Metab,2009,15:409-416.
[8]王卫东,江文,王洪典,等 .缺血性脑损伤与齿状回神经发生[J].中华老年心脑血管疾病杂志,2002,10:58-60.
[9]Nakatomi H,Kuriu T,Okabe S,et al.Regeneration of hippocampal pyramidal neuronsafter ischemic brain injury by recruitment of endogenous neuralprogenitors[J].Cell,2010,11:429-441.
[10]Jin K,Minami M,Lan JQ,et al.Neurogenesis in dentatesubgranlar zone and rostral subvent ricular zone after focal cerebralischemiain the rat[J].Proc Natl Acad Sci USA,2011,98,4710-4715.
[11]Liu S,Wang J,Zhu DY,et al.Generation of functional in hibitory neurons in the adult rat hippocampus[J].Neurosci,2010,23(3):732-736.
[12]Kitagawa K,Matsumoto M,Hori M.Protective and regerative responseen dogenously induced in the ischemic brain[J].Physiol Pharmacol,2011,79:262-265.

