人胚胎干细胞神经分化中VEGF作用的分子机制研究
焦淑洁 许慧芳 张苏明 许 杰 湛延强
华中科技大学同济医学院附属同济医院神经内科 武汉 430030 2)郑州大学第一附属医院神经内科 郑州 450052
研究表明丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号转导途径在中枢神经系统广泛表达,各种细胞外刺激信号,均可通过这一通路影响突触传递,神经元的重塑、形态分化和生存等。目前已发现哺乳动物脑组织细胞至少有4种严格调节的MAPK,其中发挥主要作用的为p38α,参与多种细胞的调控增殖。本实验前期发现在体外VEGF能够促进人胚胎干细胞神经分化[1],给予p38 MAPK信号通路抑制剂,检测细胞内p38αmRNA的变化,以观察MAPK信号转导通路是否在VEGF促神经细胞生长和分化中发挥作用,从而进一步了解VEGF在体外hESCs神经分化中的作用机制。
1 材料和方法
1.1 人胚胎干细胞及相关培养基 人胚胎干细胞系TJMU1和TJMU2,由本实验室与同济医院生殖中心前期研究人员建系[2],本实验室保存。诱导分化相关培养基:(1)hESCs培养基:KNOCKOUT DMEM(Gibco)、血清替代物(Gibco)、L-谷胺酰胺(Hyclone)、非必需氨基酸(Hyclone)、β-巯基乙醇(Sigma)、重组碱性成纤维细胞生长因子(basic-fibroblast growth factor,bFGF)(Sigma)及青链霉素(Hy-clone)。(2)拟胚体(Embryonic body,EB)培养基:hESCs培养基去除bFGF。(3)神经干细胞培养基:DMEM/F12(Hyclone)、B27(Gibco)、Noggin(R&D)、bFGF、非必需氨基酸、L-谷胺酰胺及青链霉素。(4)神经元培养基:DMEM/F12、ITS(Sigma)、N2(Gibco)、脑源性神经生长因子(R&D)、表皮生长因子(R&D)、B27、L-谷胺酰胺、非必需氨基酸及青链霉素。
1.2 其他实验试剂 VEGF(Peprotech);p38MAPK 抑制剂SB203580:Sigma;抗Nestin抗体(神经干细胞标志);抗微管相关蛋白-2(anti-microtubule-associated protein 2,MAP-2,成熟神经元标志)多克隆抗体(Chemicon);DAPI(Sigma);FITC标记的荧光二抗(北京中杉金桥);Trizol and RT-PCR试剂盒(Fermentas)。
1.3 hESCs培养、分化及实验分组 hESCs复苏后,接种于丝裂霉素灭活的胚胎鼠成纤维细胞饲养层上,加入hESCs培养基,置于37℃、5%CO2的培养箱中培养,第6~7d机械法传代。传代后细胞分为3组:A组细胞序贯加入EB培养基、神经干细胞培养基及神经元培养基常规诱导分化;B组细胞除常规诱导分化外,各阶段培养基中分别加入10ng/mL VEGF;C组在 VEGF添加之前1h分别给予5μmol/L SB203580,B、C组VEGF作用48h,撤出后诱导过程同A组。
1.4 细胞免疫荧光观察各阶段细胞标志性抗原表达 4%多聚甲醛固定爬片上生长的细胞,一抗4℃过夜,二抗37℃孵育1h,DAPI复染核。中性树胶封片,照相。各阶段各组细胞随机取3张爬片,观察10个视野,阳性细胞率=阳性细胞数/DAPI复染细胞数。
1.5 半定量RT-PCR检测 (1)提取总RNA,按trizol试剂说明操作;(2)合成cDNA,采用Fermentas RT试剂盒,按产品说明书操作。(3)聚合酶链反应,GAPDH作为参照。(4)采用Lab Works 4.0凝胶成像系统进行成像,Quantity One分析系统进行图像分析,以(目的基因-背景)/(GAPDH-背景)的积分吸光度比值作为目的基因mRNA的表达水平。
1.6 MTT检测 (1)VEGF作用48h后的神经干细胞加MTT溶液(浓度为5mg/mL),孵育4h;(2)吸弃上清液,加DMSO振荡;(3)选择490nm波长,在酶联免疫检测仪上测定各孔光吸收值;(4)以不同干预为横坐标,各组吸光值/常规组吸光值比值为纵坐标绘制存活细胞曲线。
2 结果
2.1 免疫荧光法检测γ-分泌酶抑制剂对VEGF在hESCs神经分化各阶段的影响 hESCs到EB阶段,各组细胞得到的EB数量基本相同,均为60%左右,无明显差异;经免疫荧光法计数,EB到神经干细胞阶段,3组细胞Nestin和MAP2阳性率的比较见表1。
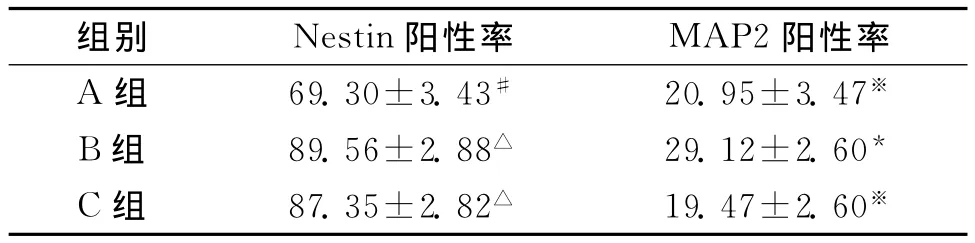
表1 3组细胞Nestin和MAP2阳性率的比较 (%)
2.2 RT-PCR法检测p38αmRNA在各组诱导得到的神经元中的表达 p38αmRNA在VEGF作用组(B组)表达较强,而在p38MAPK抑制剂预处理的VEGF组(C组)中的表达与常规诱导组接近,见图1、2。
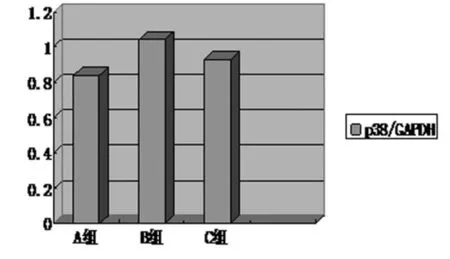
图1 3组神经元p38αmRNA半定量分析
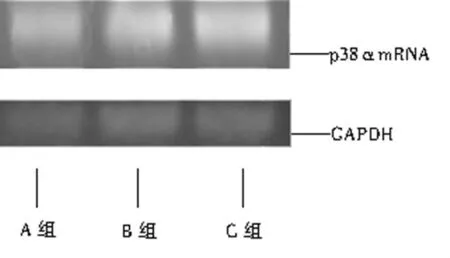
图2 RT-PCR检测3组神经元p38αmRNA表达
2.3 MTT法结果 VEGF作用组(B组)NSCs的 MTT比值明显高于常规诱导组(A组),p38MAPK抑制剂预处理的VEGF组(C组)MTT比值则与VEGF作用组(B组)相近,见图4。
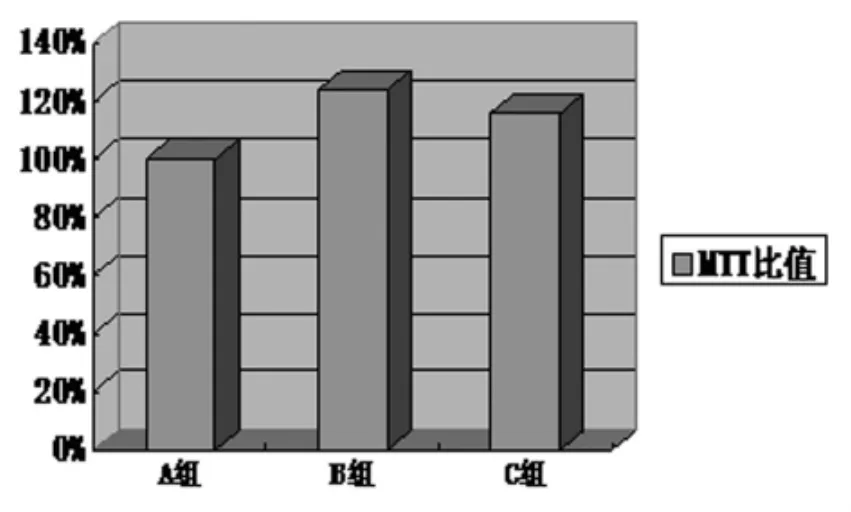
图33 组神经干细胞MTT比值比较
3 讨论
MAPK家族成员是哺乳动物细胞内一组进化保守的酶。近年来发现MAPK家族是连接细胞膜表面受体与决定性基因表达之间的重要信号调节酶,控制着细胞的适应、增殖、分化、存活和凋亡等几乎所有生理功能和过程,故又有细胞质和细胞核联系枢纽之称。p38MAPK是MAPK家族的一个重要组成部分,早期研究认为p38MAPK介导炎性因子和环境应激的细胞反应,最近研究表明p38MAPK参与葡萄糖摄取、核苷酸代谢等更广泛的细胞功能[3]。下游底物很丰富,包括多种转录因子和激酶等,因此引起的生物学效应也多种多样[4]。有学者报道[5-6]p38MAPK 通路调控某些特殊类型的神经细胞在发育过程中的迁移,并参与了神经元的分化、存活等生理过程,还可以通过影响神经突触的蛋白质合成以及谷氨酸受体的内吞过程而调控神经元的生理功能。
本实验应用p38MAPK抑制剂,以了解VEGF在人胚胎干细胞神经分化中的作用与MAPK信号通路有无相关性。研究发现,在人胚胎干细胞生成EB过程中,各组细胞EB生成量无明显差异,未观察到VEGF对这一阶段胚胎细胞发育的作用,同样也未发现该阶段中VEGF与p38MAPK信号转导通路的相互影响。在EB向神经干细胞分化过程中,应用p38MAPK抑制剂(C组)后,产生的神经干细胞数量与VEGF组(B组)相似,差异无统计学意义,说明p38 MAPK抑制剂不能拮抗VEGF的促神经干细胞增殖作用,进而表明在人胚胎干细胞经VEGF作用分化为神经干细胞过程中,p38MAPK信号转导途径未参与其中。而在NSCs进一步分化为神经细胞过程中,VEGF可以促使神经干细胞更多的向神经元分化,p38MAPK抑制剂预处理的VEGF作用组(C组)与常规诱导组(A组)分化为神经元的比例无明显差异,未能表现出更多向神经元分化的趋势,神经元的阳性率远低于VEGF作用组(B组)。RT-PCR半定量分析显示,VEGF作用组(B组)神经元的p38αmRNA含量高于p38 MAPK抑制剂预处理的VEGF作用组(C组)与常规诱导组(A组),这提示我们p38MAPK抑制剂抑制了VEGF的促神经干细胞分化为神经元作用,说明VEGF作用的神经干细胞向神经元分化中,p38MAPK信号通路的激活参与其中,但是p38MAPK具体是通过抑制凋亡间接促进神经元生长还是直接促进神经元发生或激活其他通路继而发挥作用尚需进一步探讨。
此外,一些研究发现,血管内皮生长因子对胚胎皮层神经元的神经增殖作用由多种信号途径介导,包括上调E2F转录因子,增加细胞周期G1/S若干关键组成部分的表达[7];也有实验表明VEGF的促神经生长作用可被磷脂酶C抑制剂U73122等阻断[8]。故而VEGF发挥促神经增长和分化效应的信号通路是一个复杂过程,具体通路有待于进一步阐述。
[1]焦淑洁,张苏明.VEGF在人胚胎干细胞向神经元分化中作用的研究[J].卒中与神经疾病,2009,16(3):134-137.
[2]Chen H,Qian K,Zhang SM,et al.The derivation of two additional human embryonic stem cell lines from day 3embryos with low morphological scores[J].Hum Reprod,2005,20(8):2201-2206.
[3]Trouillas M,Saucourt C,Duval D,et al.Bcl2,a transcription target of p38alpha,is critical for neuronal commitment of mouse embryonic stem cells[J].Cell Death Diff,2008,15(9):1450-1459.
[4]Sato K,Hamanoue M,Takamatsu K.Inhibitors of p38mitogenactivated protein kinase enhance proliferation of mouse neural stem cells[J].J Neurosci Res,2008,86(10):2179-2189.
[5]Takeda K,Ichijo H.Neuronal p38MAPK signalling:an emerging regulator of cell fate and function in the nervous system[J].Genes Cells,2002,7(11):1099-1111.
[6]Aouadi M,Bost F,Caron L,et al.p38mitogen-activated protein kinase activity commits embryonic stem cells to either neurogenesis or cardiomyogenesis[J].Stem Cells,2006,24(5):1399-1406.
[7]Yasuhara T,Shingo T,Muraoka K,et al.The differences between high-and low-dose administration of VEGF to dopaminergic neurons of in vitro and in vivo Parkinson’s disease model[J].Brain Res,2005,1038(1):1-10.
[8]Jung KH,Chu K,Lee ST,et al.Granulocyte colony-stimulating factor stimulates neurogenesis via vascular endothelial growth factor with STAT activation[J].Brain Res,2006,16:1073-1074.

