白花丹素致体外培养肝细胞的损伤及改构型酸性成纤维细胞生长因子对肝细胞的保护作用
徐雅玲,黄巨恩,刘华钢
(广西医科大学护理学院,广西南宁 530021)
中药是我国的传统医药,有着数千年的应用历史,许多传统中药存在抗癌有效成分,其中有相当一部分己应用于临床,成为肿瘤综合治疗方案中的重要内容。但随着中草药及其制剂在世界范围的广泛应用,中药毒副反应的问题受到广泛的关注。白花丹素是具有广西特色的、性辛、味苦、有小毒的中药,它对4种肿瘤细胞系Raji、Calu-1、HeLa和Wish都表现出了较强的细胞毒活性,能明显抑制这些肿瘤细胞的生长[1]。但由于其自身的细胞毒作用,会对正常器官产生毒副作用。韦敏等[2]研究已证实了白花丹素可抑制人胚肾细胞293的增殖,对肾脏有一定的毒性。但白花丹素体内外肝毒性的研究迄今尚未见文献报道。因此,考察这一类是否具有细胞毒作用的抗肿瘤中药活性成分一直是临床工作者研究的方向,同时,如何改善和治疗这种损伤也是人们关注的热点。
探索各种细胞因子对组织、器官损伤的防治目前已越来越受到人们的关注。aFGF作为一种抗损伤、促进创伤愈合,并具有神经营养作用的因子引起了人们重视。黄巨恩等[3]研究表明aFGF对由庆大霉素引起的体外培养的大鼠肾小管上皮细胞损伤有保护作用。但是,由于野生型aFGF的促分裂活性与细胞增殖、分化以及肿瘤发生存在一定的联系,因而在大规模应用时受到一定的限制。为此,通过基因工程技术,将野生型aFGF进行了改构,得到一种改构体aFGF,该改构体aFGF失去了促分裂效应,保留其非促分裂激素样活性[4]。但改构型酸性成纤维细胞生长因子(MaFGF)是否对白花丹素所造成肝细胞的损伤具有保护作用,以及机制如何,尚未见文献报道。
动物肝损伤模型种类很多,包括化学性肝损伤、药物性肝损伤、酒精性肝损伤、免疫性肝损伤等[5-6]。本研究建立白花丹素致原代培养的大鼠肝细胞损伤的模型:观察MaFGF对损伤肝细胞的作用,并从细胞水平上初步探讨白花丹素的毒性与MaFGF的保护作用机制,为其进一步的开发利用提供实验依据和理论基础。
1 材料与方法
1.1实验动物和试剂Wistar大鼠4只,体质量(8±2)g,由广西医科大学实验动物中心提供。DMEM-HG、胎牛血清、胰蛋白酶、胶原酶由Gibco公司提供。基因重组人酸性成纤维细胞生长因子(rhaFGF)由暨南大学生物工程研究所提供(批号20050618)。一氧化氮(NO)、乳酸脱氢酶(LDH)、谷氨酸丙酮酸转氨酶(GPT)、谷氨酸草酰乙酸转氨酶(GOT)、超氧化物歧化酶(SOD)以及丙二醛(MDA)的测定试剂盒均由南京建成生物工程研究所提供。
1.2方法
1.2.1肝组织的分离、消化断头处死大鼠,无菌条件下取肝脏,用PBS平衡盐溶液清洗几次,剥离肝被膜,将其剪成 1 mm3大小的组织块,加入0.25%胰酶消化 3 min,用含 10%胎牛血清的DMEM-HG终止消化,以800 r·min-1离心5 min,弃上清;0.1%胶原酶消化10min,加入培养基洗涤,充分吹打2 min使组织膨松絮状,静置5 min,取中下2/3的上清于另一离心管中收集细胞悬液,以1 000 r·min-1离心5 min ,弃上清液,洗涤 2 次,所得沉淀即为分离的肝细胞。
1.2.2肝细胞的培养加入5 ml含10%胎牛血清的DMEM-HG培养液,充分吹打直到其分散为细胞悬液为止。台盼蓝活细胞计数>85%,调整细胞浓度以5 ×105·L-1接种于培养瓶内 37℃、5%CO2、饱和湿度静置培养。细胞72~120 h处于对数生长期,可用于实验。
1.2.3细胞的药物处理与细胞毒检测分组实验分5组(n=5):①对照组:即在含10%FBS的DMEM-HG培养液中继续培养48 h的细胞。对照组设6个复孔。②白花丹素组:前24 h培养条件与对照组无异,24 h 后在含 10、20、30、40、50 μg·L-1白花丹素的培养基中继续培养24 h。③ MaFGF低浓度组(Ⅰ组):上述浓度的白花丹素处理24 h后,加入终浓度为3.12×10-3mg·L-1的 MaFGF继续培养24 h。④MaFGF中浓度组(Ⅱ组):上述浓度的白花丹素处理24 h后,加入终浓度为4.68×10-3mg·L-1的MaFGF继续培养24 h。⑤ MaFGF高浓度组(Ⅲ组):上述浓度的白花丹素处理24 h后,加入终浓度为7.80×10-3mg·L-1的 MaFGF继续培养24 h。以上各组均取原代培养d 3的细胞。给药48 h后加入MTT试剂检测其OD值。
1.2.4细胞因子对肝细胞保护作用的实验分组实验分3组(n=5):①对照组(未加处理因素):即在含10%胎牛血清的DMEM-HG培养液中培养48 h的细胞;② 致伤组(白花丹素组):前24 h培养条件与对照组无异,24 h后即暴露在含20 μg·L-1白花丹素的10%胎牛血清的DMEM-HG培养液中培养24 h的细胞;③细胞因子组(白花丹素+MaFGF组):即在加入含20 μg·L-1白花丹素和10%胎牛血清的DMEM-HG培养液中培养24 h后再加7.80×10-3mg·L-1MaFGF继续培养24 h的细胞。以上各组均取原代培养d 3的细胞,给药48 h后检测细胞生化和酶学指标。
1.3统计学分析本实验的数据结果以±s表示,运用SPSS13.0软件进行统计分析,多组样本间均值比较采用单因素方差分析,两组样本间均值比较采用独立样本t检验。
2 结果

Fig 1 Hepatocytes show good growth after 96h(200 × )Fig 2 Hepatocytes show distension 24 h after plumbagin(20 μg·L-1)was added(200 × )Fig 3 Hepatocytes injured by plumbagin(20 μg·L-1)24 h and protected by MaFGF(7.80 ×10-3mg·L-1)24 h(200 × )
2.1加药培养48 h后细胞形态的改变正常分离培养的肝细胞呈铺路石样,体积较大,镜下透明度及折光性强,各细胞紧密相靠,互相衔接,可融合成片或复层生长。(1)>=20 μg·L-1的白花丹素作用24 h:①细胞明显肿胀、边界消失;② 原有的铺路石样变圆皱缩;③ 多个细胞融合成团块状,细胞密度下降;④ 部分细胞胞质内黑色颗粒和空泡增多,呈老化状;⑤培养液中多见细胞碎片;(2)白花丹素+MaFGF作用24 h:①细胞轮廓较清晰,边界折光性尚好;② 细胞变圆,皱缩程度减轻;③ 细胞胞质较丰富,立体感较强,胞质内少见黑色颗粒和空泡;④培养液中细胞碎片较少。
2.2MTT法检测白花丹素对体外肝细胞生长的抑制效果不同浓度的白花丹素处理24 h,检测其对肝细胞生长的影响。经过方差分析统计学处理可以得知:5组浓度之间抑制率比较,P=0.000,P<0.05,具有统计学意义;其中 10 μg·L-1与 20 μg·L-1抑制率比较,P=0.359,P>0.05,不具有统计学意义,其他浓度与 10 μg·L-1抑制率比较,P=0.000,均小于0.05,具有统计学意义。说明白花丹素对肝细胞具有抑制作用,且不同浓度的白花丹素之间的抑制率存在差异。从MTT的结果可以得出,白花丹素对肝细胞的抑制率随着药物浓度的增加而增加。不同浓度白花丹素的抑制率见Tab 1。
Tab 1 Inhibition rate of plumbagin and plumbagin+MaFGF on hepatocytes(%,±s)
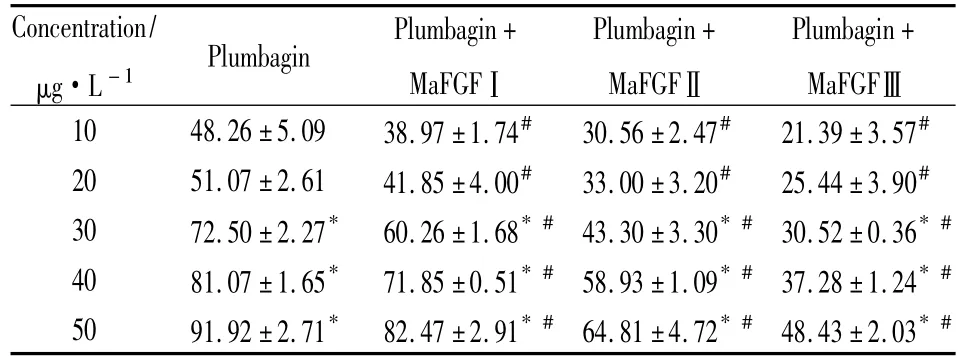
Tab 1 Inhibition rate of plumbagin and plumbagin+MaFGF on hepatocytes(%,±s)
*P <0.05 vs 10 μg·L -1plumbagin;#P <0.05 vs plumbagin group
Concentration/μg·L-1 Plumbagin Plumbagin+MaFGFⅠPlumbagin+MaFGFⅡPlumbagin+MaFGF Ⅲ10 48.26 ±5.09 38.97 ±1.74# 30.56 ±2.47# 21.39 ±3.57#20 51.07 ±2.61 41.85 ±4.00# 33.00 ±3.20# 25.44 ±3.90#30 72.50 ±2.27* 60.26 ±1.68*# 43.30 ±3.30*# 30.52 ±0.36*#40 81.07 ±1.65* 71.85 ±0.51*# 58.93 ±1.09*# 37.28 ±1.24*#50 91.92 ±2.71* 82.47 ±2.91*# 64.81 ±4.72*# 48.43 ±2.03*#
2.3MaFGF对白花丹素体外肝毒性的保护作用
4.68 ×10-3~7.80 ×10-3mg·L-1的 MaFGF 作用24 h后:采用方差分析进行统计学处理,不同浓度的MaFGF对白花丹素的肝细胞毒性的抑制率之间差异有显著性。4.68×10-3~7.80×10-3mg·L-1的 MaFGF 与白花丹素组比较,P=0.005,P<0.05,具有统计学意义;4.68 ×10-3mg·L-1的MaFGF组与 6.24 ×10-3mg·L-1的 MaFGF 组比较,P=0.001,P<0.05,具有统计学意义;6.24×10-3mg·L-1的 MaFGF 组与 7.80 ×10-3mg·L-1的MaFGF组比较,P=0.000,P<0.05,具有统计学意义;白花丹素作用肝细胞24 h回归方程为^Y=1.173X+33.768(r=0.959),利用SPSS软件计算其IC50=13.603 μg·L-1(IC50即半数抑制浓度,是指一种毒物能将某种细胞活力抑制50%所需的浓度);4.68×10-3mg·L-1的 MaFGF 作用24 h 的回归方程为^Y=1.17X+23.980(r=0.969),IC50=18.441 μg·L-1;6.24 ×10-3mg·L-1的 MaFGF 作用24 h的回归方程为^Y=0.9443X+17.791(r=0.953),IC50=31.175 μg·L-1;7.80 × 10-3mg·L-1的MaFGF作用24 h的回归方程为^Y=0.659X+12.836(r=0.958),IC50=75.373 μg·L-1。
通过“相关分析”和“回归分析”并结合以上生长抑制直条图,可得出MaFGF对白花丹素的肝毒性的抑制作用具有比较明显的剂量-效应特点。(见Fig 4)且随着MaFGF作用浓度的增大,药物的IC50值明显增高,以7.80 ×10-3mg·L-1的 MaFGF 作用24h的增幅最为明显。见Fig 5。

Fig 4 Inhibitory effects of plumbagin and plumbagin+MaFGF on hepatocytes at 24 h

Fig 5 Median inhibitory concentration of plumbagin and plumbagin+MaFGF on hepatocytes
2.4给药48 h后,肝细胞的酶学和生化指标的检测结果表明:白花丹素的毒性作用可使培养的肝细胞 SOD 下降,NO、MDA、GPT、LDH、GOT 水平升高,而MaFGF则表现出明显的保护作用,但SOD酶活性、NO、MDA、LDH、GPT、GOT 水平指标尚未能恢复到对照组水平。见Tab 2。
3 讨论
中药抗肿瘤是目前医学界研究的一个热点,很多中药成分被证实具有较好的抗肿瘤效果而得以逐步走向临床。一般来说,抗肿瘤作用强的药物细胞毒性也大,而肝脏是外源性药物代谢、排泄的主要器官,在药物众多靶器官中无疑是最重要的。
Tab 2 MDA,SOD,NO,LDH,GPT and GOT changes after 48h culture(±s)

Tab 2 MDA,SOD,NO,LDH,GPT and GOT changes after 48h culture(±s)
**P <0.01 vs plumbagin,##P <0.01 vs control
Control 5.30 ±0.15 71.78 ±3.12 13.73 ±0.76 12.52 ±0.56 3.87 ±0.39 12.63 ±0.73 Plumbagin 10.31 ±0.36## 57.76 ±3.18## 20.52 ±1.10## 187.27 ±5.67## 321.87 ±14.33## 563.13 ±19.79##Plumbagin+MaFGF 6.68 ±0.32**## 66.09 ±2.77**## 16.09 ±0.90**## 18.39 ±0.56**## 5.13 ±0.58**## 19.49 ±0.76**##
本实验采用形态学观察法、MTT法和酶学生化指标检测白花丹素对肝细胞生长的影响和MaFGF对白花丹素肝毒性的保护作用。
作用 24 h 时,10、20、30、40、50 μg·L-1的白花丹素对肝细胞的抑制率分别为48.26%、51.07%、72.50%、81.07%和91.92%。可以看出,不同浓度的白花丹素对肝细胞的抑制率随药物浓度的增大而增加。酶学生化指标也可以有效地反映药物对细胞的毒性作用。SOD值与药物毒性大小成负相关;MDA、NO、LDH、GPT和GOT值与药物毒性成正相关。白花丹素作用后:MDA、NO、LDH、GPT、GOT 的含量升高,而SOD的活性下降,其进一步证实了白花丹素具有一定的肝毒性。究其毒性机制可能有如下原因:肝细胞质膜的脂质过氧化[7]、细胞膜和细胞器破坏、肝酶逸出细胞等。肝脏和肾脏一样,其氧供应十分丰富,氧自由基产生的机会相对较多,是机体内最容易产生氧自由基损伤的器官之一。而具有细胞毒作用的药物亦可能对肝、肾细胞的生物膜产生脂质过氧化作用,进而损伤膜功能,改变细胞酶活性,甚至攻击DNA,触发凋亡。结合我们的前期工作,庆大霉素肾、耳毒性的产生均与自由基增多有关[8-9]。因此,我们考虑白花丹素致肝毒性也可能与自由基增多相关。
在20 μg·L-1的白花丹素作用 24h 后,分别用4.68、6.24 和 7.80 ×10-3mg·L-1的 MaFGF 处理24 h,肝细胞的抑制率分别为41.85%、33.00%和25.44%;IC50分别是 18.441、31.175、75.373 μg·L-1。从MTT的结果可以看出,白花丹素+不同浓度的MaFGF对肝细胞的抑制率随MaFGF浓度的增大而减小;IC50随着MaFGF浓度的增大而明显增高。通过“相关分析”和“回归分析”可知,MaFGF对白花丹素的肝毒性的抑制作用具有比较明显的剂量-效应特点。随着MaFGF作用浓度的增大,药物的半数抑制浓度明显增高,以 7.80×10-3mg·L-1的MaFGF作用24 h的增幅最为明显。同时,当MaFGF作用后:MDA、NO、LDH、GPT、GOT 明显下降,而SOD的活性明显回升,表明MaFGF的保护作用是有效的。而白花丹素+MaFGF组与对照组比较,各生化和酶学指标均未恢复至对照组水平,两组间差异仍有统计学意义(P<0.01),说明MaFGF部分拮抗了白花丹素的毒性作用,使 MDA、NO、LDH、GPT、GOT的含量部分下降,SOD的活性有所升高,但均未能恢复到相对正常水平。
文献报道MaFGF对由活性氧H2O2引起的心肌细胞损伤具有拮抗作用,能提高SOD活性和降低MDA含量,减少心肌细胞的凋亡,能够抑制地塞米松诱导的小鼠胸腺细胞凋亡,以剂量依赖方式发挥作用。我们前期研究中发现MaFGF对顺铂、庆大霉素等造成肾小管上皮细胞的损伤具有保护作用,对大鼠肾缺血/再灌注损伤,可明显减轻肾组织水肿、间质浸润以及肾小管扩张与破坏,电镜下见肾小管上皮细胞内细胞器(微绒毛、线粒体、溶酶体等)损伤较轻或基本正常。其发挥作用机制与其直接或间接拮抗自由基的产生,加强其清除和保护抗氧化酶活性有关[10]。
结合我们的前期工作,亟待加强对中药的毒理学研究,早期发现和掌握该活性成分的有关毒理学资料对于后续研究有着重要的指导意义;进一步开展MaFGF对细胞的理化基础和分子生物学机制研究:观察MaFGF的保护作用及其与受体结合机制,探讨MaFGF发挥作用的信息传递途径等等。有望在MaFGF对器官损伤的防治作用研究方面实现新的突破。
[1]刘丽敏,刘华钢,黄慧学,等.白花丹的研究进展[J].现代生物医学进展,2008,8(3):597 -600.
[1]Liu L M,Liu H G,Huang H X,et al.Study advances on plumbagin zeylanica[J].Prog Mod Biomed,2008,8(3):597 -600.
[2]韦 敏,刘丽敏,刘华钢,李丹妮.白花丹素的体外肾毒性及酸性成纤维细胞生长因子对白花丹素所致肾损伤的保护作用[J].药学服务与研究,2009,9(4):272-4.
[2]Wei M,Liu L M,Liu H G,Li D N.In vitronephrotoxicity of plumbagin and protective effect of acid fibroblast growth factor[J].Pharm Care Res,2009,9(4):272 -4.
[3]黄巨恩,王慧杰,刘华钢,等.酸性成纤维细胞生长因子对庆大霉素诱导的肾小管上皮细胞损伤的保护作用[J].中国药理学通报,2007,23(11):2455 -8.
[3]Huang J E,Wang H J,Liu H G,et al.Protective effects of aFGF on Gentamicin-induced injuries of rats’renal tubular epithelial cellsin vitro[J].Chin Pharmacol Bull,2007,23(11):2455 -8.
[4]曹定国,李校坤,付小兵,等.改构酸性成纤维细胞生长因子对小鼠胸腺细胞凋亡的影响[J].中国生物工程杂志,2003,23(9):80-3.
[4]Cao D G,Li X K,Fu X B,et al.Effect of modified acidic fibroblast growth factor on thymocyte apoptosis induced by dexamethasone in mouse[J].China Biotechnol,2003,23(9):80 - 3.
[5]王喜军,刘 莲,孙 晖,等.乙醇诱导大鼠肝损伤的代谢组学和茵陈蒿汤的干预研究[J].中国药理学通报,2008,24(4):452-7.
[5]Wang X J,Liu L,Sun H,et al.Studies on the metabonomics of rat liver injury induced by ethanol and interfering effects of Yinchen-HaoTang[J].Chin Pharmacol Bull,2008,24(4):452 -7.
[6]郭菁菁,杨秀芬.黄酮类化合物对动物实验性肝损伤保护作用的研究进展[J].中国药理学通报,2008,24(1):5 -10.
[6]Guo J J,Yang X F.Research progress of the protective effect of flavanoids on experimental liver injury of animals[J].Chin Pharmacol Bull,2008,24(1):5 -10.
[7]Yagik.Lipid peroxidesand human dieases[J].Chem Phys Lipids,1987,45:337 -51.
[8]Baliga R,Ueda N,Walker P D,et al.Oxidant mechanisms in toxic acute renal failure[J].Drug Metab Rev,1999,31(4):971 - 97.
[9]Todt I,Ngezahazo A,Ernst A,et al.Inhibition of gap junctional coupling in cochlear supporting cells by gentamicin.Pflugers[J].Arch,1999,438(6):865-7.
[10]胡文娟,黄巨恩,李校堃,等.改构型酸性成纤维细胞生长因子对大鼠肾缺血/再灌注损伤的保护作用[J].中国药理学通报,2007,23(2):166 -9.
[10]Hu W J,Huang J E,Li X K,et al.Protective effect ofmodified acidic fibroblast growthfactor on renal ischem ia/reperfusion injury of rats[J]Chin Pharmacol Bull,2007,23(2):166 -9.

