匹诺塞林对体外共培养海兔SN/L7神经元电生理活动的作用
应 剑,胡江原,陈 阳,Samuel Schacher,杜冠华
(1.中国医学科学院药物研究所国家药物筛选中心,北京 100050;2.美国哥伦比亚大学医学中心神经科学系,纽约 10032)
海洋软体动物海兔(aplysia californica)神经系统简单,神经细胞胞体大且数量少、便于实验操作,是研究学习记忆和神经功能的重要模式生物。20世纪60年代,Kandel等[1]对海兔缩鳃反射的神经通路进行研究,发现来自喷水管的感觉信息经胸膜神经节的感觉神经元SN传至腹部神经节的L7运动神经元,L7支配鳃肌,控制缩鳃运动。80年代,Glanzman等[2]建立了SN和L7的共培养模型(SN/L7),即分别分离L7和单个SN后,转移至玻璃底培养皿中共同培养,用玻璃微电极将SN和L7的轴突轻轻搭在一起,在适当的培养条件下,SN和L7之间可形成特异的突触连接。
介导SN/L7突触瞬时兴奋传递的递质是谷氨酸[3]。谷氨酸作用于突触后膜的兴奋性氨基酸受体,使突触后膜对Na+、K+的通透性增加,Na+内流大于K+外流,突触后膜局部去极化,从而产生兴奋性突触后电位(EPSP)。在适当条件下,SN/L7可表现出短时程或者长时程的突触可塑性,模拟自然条件下海兔缩鳃反射的习惯化和敏感化。短时程突触可塑性主要依赖于离子通道的修饰和递质释放的变化,通过一系列下游信号通路的转导,还可能对长时程突触可塑性产生影响。
匹诺塞林(PNCB)是蜂胶中含量最高的黄酮类化合物[4],具有抗炎[5]、杀菌[6-7]、抗氧化[8]、舒张血管[9]、神经保护[10-12]等广泛的药理作用。在药物筛选以及对PNCB抗脑缺血损伤机制的研究中,发现PNCB作用于K+通道、Ca2+通道、NMDA受体、GABA受体等多种离子通道。本实验通过考察PNCB对海兔SN/L7的电生理活动的作用,探讨PNCB对海兔神经细胞短时程突触可塑性和长时程突触可塑性的影响,为PNCB对神经系统作用机制的研究提供参考依据。
1 材料与方法
1.1材料不同年龄段的加州海兔,分别用于分离L7细胞(幼年海兔,体质量2 g)、SN细胞(成年海兔,体质量60~80 g),抽取淋巴血液(成年海兔,体质量约1 kg),均购于美国迈阿密大学海兔国家资源库。实验中所用试剂均购于美国Sigma公司。PNCB(纯度大于98%)由中国医学科学院药物研究所吴松教授提供。
1.2SN/L7细胞培养根据SN/L7共培养的实验方法[2],从成年海兔的胸膜神经节分离SN,从幼年海兔的腹部神经节分离L7。将两个神经细胞移至同一个玻璃底培养皿中,用微电极轻轻拨动轴突,使两个神经细胞的轴突相互接触,并于18℃静置培养。细胞培养基为含50%海兔淋巴血液和100 mmol·L-1L-谷氨酸的L15培养基。共培养体系隔天换液,d 5开始实验。
1.3电生理技术应用全细胞电生理技术记录SN/L7的兴奋性突触后电位(EPSP)[13]。将刺激电极靠近SN的细胞体,设定工作电位为-85 mV,对SN胞体施加电刺激,每个刺激持续0.3~0.5 ms;将记录电极插入L7的细胞体引出EPSP。
1.4匹诺塞林对SN/L7的电生理活动的影响将50%的L15培养基与50%的人工海水(ASW)混合均匀,即 L15/ASW 工作液。精密称取 PNCB,用DMSO 梯度稀释至 10、20、30、40、100、200、300、400 mmol·L-1,使用前再用 L15/ASW 稀释1 000倍待用。细胞培养至d 5时,用L15/ASW轻轻洗去培养基,记录SN/L7的初始EPSP;然后用10ml含不同浓度PNCB的L15/ASW溶液替换L15/ASW,室温静置5 min后,再记录EPSP。对于PNCB给药浓度为0.1~0.4 mmol·L-1的实验组,用L15/ASW充分洗去药物,换成细胞培养基,放回培养箱培养,并分别于 1、24 h 记录 EPSP。另取 0.01 mmol·L-1PNCB孵育过的SN/L7,洗去或不洗去药物,加入0.005 mmol·L-15-HT 溶液孵育5 min,记录 EPSP。
另取一批细胞,于d 5用L15/ASW洗去细胞培养基后,记录 SN/L7的初始 EPSP。再用含0.01 mmol·L-1PNCB 的 L15/ASW 孵育 SN/L7,每 20 min换液1次,共5次。然后用L15/ASW洗去药物,换回细胞培养基于18℃继续培养。d 6重复以上孵育步骤。d 7用L15/ASW洗去细胞培养基后,记录EPSP。
2 结果
2.1匹诺塞林降低SN/L7的兴奋性突触后电位(EPSP)的作用SN和L7转移至玻璃底培养皿后,开始贴壁生长,搭在一起的轴突之间逐渐形成突触。伴随着突触成熟,可以记录到幅值越来越高的EPSP。d 4~5,细胞成熟(Fig 1),EPSP的幅值也基本稳定[14]。
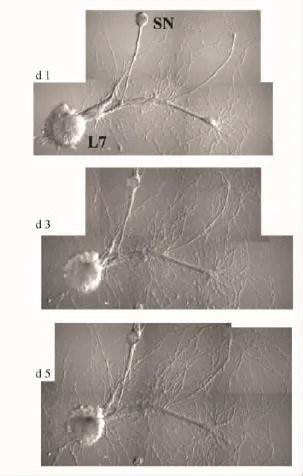
Fig 1 Typical SN/L7 co-culture at day 1,3 and 5
使用培养至d 5的细胞,考察不同浓度的PNCB对SN/L7的EPSP的影响。以PNCB作用前细胞的初始EPSP幅值为基准值,计算药物作用后的EPSP幅值相对于初始值的百分比。对照组细胞用含0.1%的DMSO的L15/ASW孵育5 min后,用同样的指标计算EPSP幅值的变化。在检测时间内,对照组的EPSP幅值略有增高,但无显著性变化;而PNCB(0.01 ~0.4 mmol·L-1)作用5 min,使 SN/L7的峰电位消失、突触电位降低(Fig 2)。

Fig 2 Normalized EPSP amplitude(%pretreatment baseline)in Aplysia SN/L7 co-cultures after 5 min incubation of 0.01 ~ 0.4 mmol·L-1pinocembrin
当 PNCB浓度低于0.1 mmol·L-1时,其降低EPSP的作用强度与给药剂量呈负相关的线性关系(r>0.995)。而在 0.1 ~0.4 mmol·L-1的浓度范围内,PNCB降低EPSP的作用强度与给药剂量呈正相关的线性关系(r>0.998)。当PNCB浓度为0.4 mmol·L-1时,EPSP的幅值仅为初始幅值的(30.7±5.1)%(P<0.01)。此外,当药物浓度 >0.1 mmol·L-1时,细胞静息电位也受到影响,观察到一定程度的去极化。
2.2匹诺塞林可逆性降低EPSP幅值的作用PNCB与海兔神经细胞作用后,洗去含 PNCB的L15/ASW,置换成细胞培养基,于18℃继续培养1 h,EPSP的幅值即回升为初始幅值的71% ~89%;继续培养24 h,则大多数细胞的EPSP幅值恢复至初始值。结果表明,PNCB对海兔神经细胞EPSP幅值的抑制作用是可逆的,将PNCB洗去后EPSP可以得到恢复。而动作电位幅度的恢复与PNCB的浓度无直接关系(Tab 1)。
2.3匹诺塞林抑制SN/L7对5-HT的反应性的作用海兔神经系统通过一个中间神经元释放5-HT至SN和L7的突触连接,易化突触传递。在体外培养体系中,用0.005 mmol·L-1的5-HT刺激细胞,可以使细胞的EPSP升高,甚至出现尖锐的峰电位(Fig 3A)。用 0.02 mmol·L-1PNCB 孵育细胞5min使SN/L7的EPSP幅值下降,再加入5-HT(终浓度为0.005 mmol·L-1)孵育5 min后,未见EPSP幅值升高或峰电位出现(Fig 3B)。撤除PNCB后静置5 min再给予5-HT刺激,则可以记录到EPSP幅值增加或者峰电位(Fig 3C)。
Tab 1 Normalized EPSP amplitude in Aplysia SN/L7 co-cultures after removal of pinocembrin(±s,n=3)

Tab 1 Normalized EPSP amplitude in Aplysia SN/L7 co-cultures after removal of pinocembrin(±s,n=3)
The initial EPSP level of each culture is marked as 100%
Pinocembrin concentration/mmol·L -1 Normalized EPSP amplitude/%0 1 h 24 h 0.1 81.4 ±8.6 77.7 ±23.6 96.7 ±4.7 0.2 62.8 ±12.8 71.5 ±18.2 87.3 ±5.1 0.3 45.4 ±2.6 71.6 ±3.8 106.3 ±0.1 0.4 30.7 ±5.1 88.8 ±9.8 105.8 ±3.0

Fig 3 Pinocembrin inhibited the spike evoked by 5-HT in Aplysia SN/L7 co-cultures.
2.4匹诺塞林对SN/L7长时程突触可塑性的作用
为考察PNCB是否影响SN/L7的长时程突触可塑性,在d 5和d 6分别在细胞培养基中加入0.01 mmol·L-1PNCB,并在 d 6 给药24 h 后记录 EPSP。结果表明,对照组的EPSP幅值为给药前的(104.1±10.5)%;PNCB给药组的EPSP幅值为给药前的(96.6±4.7)%。两个实验组EPSP的变化差异没有显著性。
3 讨论
负责海兔SN/L7突触兴奋性传递的主要递质是谷氨酸。海兔神经细胞的突触后膜上存在NMDA、AMPA型等谷氨酸受体[15]。本实验证明,给予5 min 0.01~0.4 mmol·L-1PNCB 的刺激,可抑制海兔SN/L7的电生理效应,使EPSP幅值降低。这一现象表明,PNCB对SN/L7的兴奋性突触传递有一定程度的抑制作用,其抑制SN/L7突触的兴奋性的作用可能与NMDA型谷氨酸受体有关。
以0.1 mmol·L-1为转折点,抑制作用呈现两相性,即PNCB 的浓度在0.01~0.1 mmol·L-1的范围内,抑制作用随着药物浓度增加而减弱;而当PNCB的浓度在0.1~0.4 mmol·L-1的范围内时,抑制效应随着药物浓度增加而增强。且这两相均呈现良好的线性相关性。因此,PNCB抑制SN/L7兴奋性突触传递的作用在不同浓度下可能有不同的机制,需要进一步研究。近几年的研究发现,神经细胞NMDA受体可分为突触型(NMDARs)与非突触型(NMDARn)两类。NMDA抑制剂,如美金刚等,在低浓度时优先抑制NMDARn,对NMDARs的抑制较弱,使得NMDARs相对活化;随着抑制剂的浓度增加,NMDARs才被明显抑制[16]。这一现象有助于解释本实验中观察到的PNCB抑制海兔SN/L7 EPSP的两相性。
神经细胞SN/L7与PNCB作用后,撤除PNCB可以使神经细胞的EPSP幅值恢复至初始值。这一结果提示,PNCB对其作用靶点的抑制作用是可逆的。
5-HT有易化SN/L7神经突触的作用。生理状态下,用0.005 mmol·L-15-HT孵育SN/L7共培养体系5min,即可记录到EPSP增强。PNCB的作用使SN/L7对5-HT的反应性消失;而撤除PNCB后,这一反应性迅速得以恢复,提示PNCB对5-HT易化神经突触的通路也有可逆的抑制作用。用5-HT刺激体外SN/L7共培养细胞,模拟的是海兔缩鳃反射的敏感化。5-HT作用于SN/L7的突触前膜,激活腺苷酸环化酶,继而使蛋白激酶磷酸化,磷酸化的蛋白激酶作用于突触前膜的钾离子通道使之关闭,钾离子外流减少,使动作电位到来之前的去极化时间延长,从突触前膜释放的谷氨酸增加,EPSP的幅值随之增加,突触效能增强[17-18]。因此,PNCB 可逆地抑制SN/L7共培养体系对5-HT的反应性,可能与PNCB对突触后膜谷氨酸受体的可逆性抑制有关;此外,由于PNCB具有开放钾离子通道的作用[9],PNCB也可能通过开放突触前膜的钾离子通道,减少谷氨酸释放,实现其抑制作用。
模拟5-HT诱导长时程易化的实验方法,连续两天用0.01 mmol·L-1PNCB孵育SN/L7细胞,24 h后 SN/L7的 EPSP幅值没有明显变化。表明PNCB对NMDA受体的抑制作用未在基因和蛋白水平产生更深远的影响。
此外,实验中还观察到高浓度PNCB影响L7静息电位,表现为部分去极化,表明高浓度PNCB可能在突触后膜影响钾离子外流或钠离子内流。由于有研究证明PNCB可开放钾离子通道,因此,PNCB可能通过部分开放L7细胞膜上的钠离子通道,影响其静息电位。
综上所述,PNCB作用于其SN/L7模型,总体表现为对突触兴奋性传导的可逆性抑制。但是,在实验剂量下,PNCB不影响SN/L7的长时程突触可塑性。PNCB是一种药理作用广泛的化合物。本实验室在研究PNCB作用机制的工作中,发现PNCB与一系列病理通路关联。其中,PNCB抗脑缺血损伤的作用与NMDA受体相关。但是,PNCB药理作用的靶点究竟何在,仍然未有定论。本研究提示,PNCB可能通过作用于突触前膜和突触后膜的多种离子通道,产生复杂的瞬时效应以及下游效应。下一步工作将深入探讨PNCB对离子通道的作用,相信不日将寻得PNCB的作用靶点。
[1]Kupfermann I,Pinsker H,Castellucci V,Kandel E R.Central and peripheral control of gill movements in aplysia[J].Science,1971,174(15):1252-6.
[2]Glanzman D L,Kandel E R,Schacher S.Identified target motor neuron regulates neurite outgrowth and synapse formation of aplysia sensory neuronsin vitro[J].Neuron,1989,3(4):441 -50.
[3]Dale N,Kandel E R.L-glutamate may be the fast excitatory transmitter of Aplysia sensory neurons[J].Proc Natl Acad Sci USA,1993,90(15):7163-7.
[4]Bankova V S,Popov S S,Marekov N L.High-performance liquid chromatographic analysis of flavonoids from propolis[J].J Chromatogra A,1982,242(1):135-43.
[5]Sala A,Recio M C,Schinella G R,et al.Assessment of the antiinflammatory activity and free radical scavenger activity of tiliroside[J].Eur J Pharmacol,2003,461(1):53 -61.
[6]Pepeljnjak S,Jalsenjak I,Maysinger D.Flavonoid content in propolis extracts and growth inhibition of bacillus subtilis[J].Pharmazie,1985,40(2):122 -3.
[7]Del Rayo C M,Sanchez B,Quiroz H,et al.Pinocembrine:a bioactive flavanone from teloxys graveolens[J].J Ethnopharmacol,1991,31(3):383-9.
[8]Santos A C,Uyemura S A,Lopes J L,et al.Effect of naturally occurring flavonoids on lipid peroxidation and membrane permeability transition in mitochondria[J].Free Radic Biol Med,1998,24(9):1455-61.
[9]Zhu X M,Fang L H,Li Y J,Du G H.Endothelium-dependent and-independent relaxation induced by pinocembrin in rat aortic rings[J].Vascul Pharmacol,2007,46(3):160 -5.
[10]Liu R,Gao M,Yang Z H,Du G H.Pinocembrin protects rat brain against oxidation and apoptosis induced by ischemia-reperfusion bothin vivoandin vitro[J].Brain Res,2008,1216:104 -15.
[11]Gao M,Zhang W C,Liu Q S,et al.Pinocembrin prevents glutamate-induced apoptosis in SH-SY5Y neuronal cells via decrease of bax/bcl-2 ratio[J].Eur J Pharmacol,2008,591(1-3):73 -9.
[12]Gao M,Liu R,Zhu S Y,Du G H.Acute neurovascular unit protective action of pinocembrin against permanent cerebral ischemia in rats[J].J Asian Nat Prod Res,2008,10(6):551 -8.
[13]Schacher S,Kandel E R,Montarolo P.cAMP and arachidonic acid simulate long-term structural and functional changes produced by neurotransmitters in Aplysia sensory neurons[J].Neuron,1993,10(6):1079-88.
[14]Glanzman D L,Kandel E R,Schacher S.Target-dependent structural changes accompanying long-term synaptic facilitation in Aplysia neurons[J].Science,1990,249(4970):799 - 802.
[15]Conrad P,Wu F,Schacher S.Changes in functional glutamate receptors on a postsynaptic neuron accompany formation and maturation of an identified synapse[J].J Neurobiol,1999,39(2):237-48.
[16]Hardingham G E,Bading H.Synaptic versus extrasynaptic NMDA receptor signalling:implications for neurodegenerative disorders[J].Nat Rev Neurosci,2010,11(10):682 - 96.
[17]Siegelbaum S A,Belardetti F,Camardo J S,Shuster M J.Modulation of the serotonin-sensitive potassium channel in aplysia sensory neuron[J].J Exp Biol,1986,124:287 - 306.
[18]Lodish H,Berk A,Zipursky S L,et al.Neurotransmitter receptors[M/OL].Molecular cell biology.4th edition.New York:W.H.Freeman,2000:Section 21.5.http://www.ncbi.nlm.nih.gov/books/NBK21586/.

