吲哚-3-原醇对复合因素所致肝纤维化大鼠的治疗作用及部分机制研究
高爱梅,平 洁,2,汪 晖,2
(武汉大学1.基础医学院药理学系、2.食品与药品评价研究中心,湖北 武汉 430071)
肝纤维化是各种致病因素引起肝脏慢性炎症、坏死、纤维组织持续增生的病理过程,其发病与细胞外基质(extracellular matrix,ECM)的合成和降解失衡,在肝脏内过度沉积有关。肝纤维化是肝硬化的早期病理改变和必经阶段,其发生、发展是影响诸多肝病预后和转归的关键。吲哚-3-原醇(indol-3-carbinol,I3C)是葡萄糖蔓芹苷的前体,大量存在于十字花科类食用蔬菜如西兰花等。研究发现,I3C有抑制肿瘤细胞增殖和诱导癌细胞凋亡、清除氧自由基和抗脂质过氧化等作用[1-2],常用来治疗胸部、消化道、肝脏和前列腺等处的肿瘤[3-4]。有研究报道[5-6],I3C对二甲基亚硝胺、四氯化碳诱导的急性肝损伤有保护作用。本室前期分别在肝切片和细胞水平,证实I3C对肝细胞有保护作用,且能抑制ECM的主要来源细胞—肝星状细胞(hepatic stellate cells,HSC)的增殖[7-8]。然而,其对整体动物肝纤维化是否有保护作用,目前国内外尚未见报道。本研究在整体水平观察I3C对复合因素所致大鼠肝纤维化的治疗作用,并初步探讨其机制。
1 材料与方法
1.1试剂与药品I3C,美国Sigma公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、羟脯氨酸(hydroxyproline,Hyp)检测试剂盒,南京建成生物工程研究所;α-平滑肌肌动蛋白多克隆抗体(αsmooth muscle actin,α-SMA)免疫组化 SP法试剂盒,北京中杉金桥生物技术有限公司;碱性磷酸酶、Western blot显色剂购自Hyclone公司。基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)多克隆抗体购自Santa Cruz公司。GAPDH单克隆抗体购自上海康成生物技术有限公司。
1.2实验动物♂Wistar大鼠,体质量200~220 g,由湖北省疾病预防中心提供,SPF级,许可证号:SCXK(鄂)2006-2008。
1.3实验方法48只♂Wistar大鼠,随机分成6组,每组8只:正常对照组、I3C对照组、模型对照组、I3C小剂量组、I3C中剂量组、I3C大剂量组。适应性饲养1周后,除正常对照组和I3C对照组外,所有动物给予高脂低蛋白饲料(89.5%玉米粉,0.5%胆固醇,10%猪油),并饮用5% ~10%乙醇溶液(前3天5%乙醇,以后10%乙醇)。1周后首次皮下注射 40%CCl4橄榄油 5 ml·kg-1,以后每周两次(周一、周四)注射3 ml·kg-1,连续3周。造模结束后,I3C小、中、大剂量组及I3C对照组分别腹腔注射I3C 3、6、12 和12 mg·kg-1,正常及模型对照组皮下注射等容量橄榄油(1 ml·kg-1)。连续给药10 d后,断头处死动物,取血 3 ~5 ml,3 500 r·min-1离心10 min,制备血清,-20℃冻存;于肝右叶取肝组织,一部分用4%多聚甲醛固定24 h,石蜡包埋,4~7 μm厚连续切片做病检,余下的肝组织-80℃冻存。
1.4检测指标
1.4.1大鼠一般情况及生化指标的检测包括大鼠的精神状态、活动、皮毛光泽、食量及粪便等以及肝脏的外观、颜色和质地。按试剂盒说明比色法,测定肝组织Hyp、SOD和MDA的水平。
1.4.2病理学检测部分肝组织以4%多聚甲醛固定后,石蜡包埋,切片,作HE染色及Masson三色染色,观察肝脏病理学改变及胶原含量。免疫组化SP法检测肝脏α-SMA的表达。切片常规脱蜡至水,0.01 mol·L-1柠檬酸盐缓冲液微波修复5 min,加入3%H2O2室温下孵育15 min,正常兔血清37℃封闭15 min;加一抗α-SMA多克隆抗体(1∶200),37℃孵育2 h;滴加生物素化二抗,37℃孵育20 min;滴加三抗,37℃孵育20 min;DAB显色,苏木精复染核,逐级脱水,透明,封片。胞质染成棕黄色为阳性细胞。在显微镜下每张玻片选取5个10×40倍视野,输入HMIAS-2000高清晰彩色图文分析仪(武汉千屏影像技术公司),检测阳性细胞区域面积。
1.4.3Western blot分析肝匀浆中MMP-2的表达
肝脏用组织裂解液匀浆后,BCA法测蛋白,取适量的蛋白样本进行SDS聚丙稀酰胺凝胶电泳,将凝胶中的蛋白转移到硝酸纤维素(NC)膜上,用封闭液封闭1 h;加入1∶100稀释的MMP-2一抗,室温孵育2 h;取出NC膜洗涤后,再与辣根过氧化物酶标记的相应二抗孵育1 h;洗涤后加底物,显色,终止吸干。
1.5统计学处理实验数据均以±s表示,组间比较采用单因素方差分析(One-way ANOVA)。数据采用SPSS 11.0软件进行分析。图表制作以Prism 5.0软件操作。
2 结果
2.1大鼠一般情况整个实验过程中,无大鼠死亡。正常对照组及I3C对照组大鼠毛顺有光泽,活泼好动,食量及大便正常;模型对照组大鼠皮毛疏松无光泽,精神萎靡,懒动,饮食减少,大便干燥松散不成形;I3C治疗组一般状态较模型对照组有所减轻。
2.2肝脏组织病理学
2.2.1肝脏外观正常对照组和I3C对照组大鼠肝脏被膜光滑,呈红褐色,质地中等;模型对照组大鼠肝脏偏黄白色,油腻,无光泽,质地偏硬,部分表面轻度桔皮样变。经I3C治疗后,大鼠肝脏桔皮样变减轻,肝脏色泽、质地有不同程度改善。
2.2.2肝切片HE染色正常对照组(Fig 1A)及I3C对照组(Fig 1D)大鼠肝小叶结构完整,肝索整齐,肝窦正常,无炎性细胞浸润及纤维组织增生;模型对照组(Fig 1B)大鼠肝索紊乱,炎细胞浸润和组织坏死明显,弥漫的脂肪变性,纤维组织大量增生,形成粗细不一的纤维间隔并向小叶内延伸;各给药组(Fig 1C)炎细胞浸润,组织坏死减轻,部分肝小叶结构恢复,肝索排列较规则,纤维间隔缩短变窄,纤维化分期下降。
2.3肝脏胶原改变
2.3.1肝切片Masson染色正常对照组(Fig 2A)和I3C对照组(Fig 2D)仅有少量胶原表达于中央静脉壁及汇管区;模型对照组(Fig 2B)可见胶原纤维大量沉积于汇管区,并沿汇管区向外延伸,形成厚薄不一的纤维间隔,分割包绕肝小叶,局部有假小叶形成;与模型对照组相比,I3C给药组(Fig 2C)肝小叶结构基本恢复正常,肝索排列较整齐,胶原沉积明显减少,纤维间隔变薄。Masson图像分析(Fig 3)也证实,I3C能明显降低大鼠肝组织胶原纤维的含量(P<0.05)。
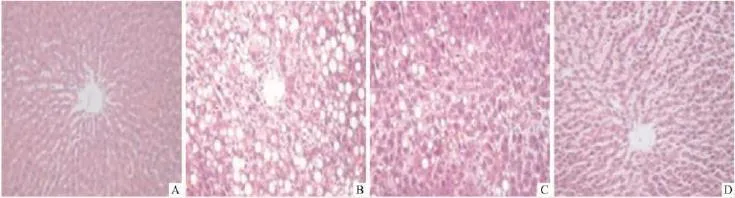
Fig 1 Effects of indole-3-carbinol(I3C)on liver histopathology(HE staining)in multiple hepatotoxic factors-induced liver fibrosis of rats(200×)

Fig 2 Effects of indole-3-carbinol(I3C)on liver collagen secretion(Masson’s trichrome staining)in multiple hepatotoxic factors-induced liver fibrosis of rats(200×)

Fig 3 Effects of 3,6 and 12 mg·kg-1indole-3-carbinol(I3C)on liver collagen percentage in multiple hepatotoxic factors-induced rat liver fibrosis by semiquantitative analysis using Medical Color Image Analysis System(±s,n=4)
2.3.2肝脏Hyp含量的变化与正常对照组相比,模型对照组Hyp含量明显升高(P<0.01);I3C各治疗组可改善肝纤维化程度,降低肝组织Hyp含量(Tab 1)。
Tab 1 Effects of indole-3-carbinol(I3C)on hydroxyproline(Hyp)in multiple hepatotoxic factors-induced liver fibrosis of rats(±s,n=8)

Tab 1 Effects of indole-3-carbinol(I3C)on hydroxyproline(Hyp)in multiple hepatotoxic factors-induced liver fibrosis of rats(±s,n=8)
**P <0.01 vs normal control.
Group Dose/mg·kg-1 Hyp/mg·g -1 Normal control - 125±16 Fibrotic control - 352±96**Fibrotic+I3C 3 303±95 Fibrotic+I3C 6 259±131 Fibrotic+I3C 12 316±75 I3C control 12 166±23
2.4肝切片α-SMA免疫组化正常对照组(Fig 4A)和I3C对照组(Fig 4D)仅见α-SMA在血管壁及肝血窦Disse间隙内少量表达,模型对照组(Fig 4B)α-SMA表达明显,主要分布于窦周、胶原沉积处、纤维间隔处,I3C治疗组(Fig 4C)α-SMA在表达范围、强度上都减轻,且表现为一定的量效关系(Fig 5)。
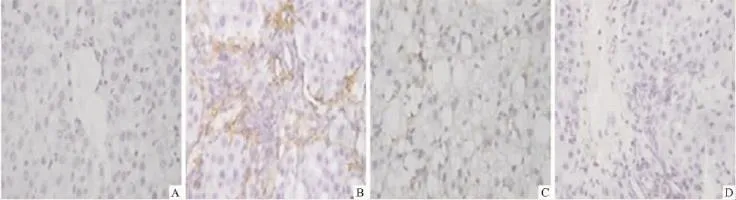
Fig 4 Effects of indole-3-carbinol(I3C)on expressions of α-smooth muscle actin(α-SMA)in multiple hepatotoxic factors-induced liver fibrosis of rats(200×)

Fig 5 Effects of 3,6 and 12 mg·kg-1indole-3-carbinol(I3C)on expressions of α-smooth muscle actin(a-SMA)in multiple hepatotoxic factors-induced liver fibrosis of rats by semiquantitative analysis using Medical Color Image Analysis System(±s,n=3)
2.5肝匀浆MMP-2的Western blot分析Western blot检测发现,72 ku处显示清晰的条带为MMP-2(Fig 6),与正常组比较,模型对照组MMP-2降低,与模型对照组比较,给药组MMP-2升高,尤以I3C大剂量组明显。

Fig 6 Western blot analysis of matrix metalloproteinases-2(MMP-2)of indole-3-carbinol(I3C)in multiple hepatotoxic factors-induced liver fibrosis of rats
2.6肝组织抗氧化指标与正常对照组比,模型对照组MDA含量明显升高,SOD活性明显降低(P<0.01);与模型对照组比,I3C治疗组可升高SOD活性,尤以大剂量组明显(P<0.01)。见Tab 2。
3 讨论
慢性肝损伤模型主要有CCl4、白蛋白、乙醇和复合因素慢性肝损伤模型。复合因素中的3种因素(CCl4、乙醇、高脂低蛋白饲料)均能损伤肝细胞,长期给予CCl4、乙醇、高脂低蛋白饲料后,损伤的肝脏可进一步发生纤维化,较单因素模型具普遍性和现实意义,能更准确模拟自然生活环境,适用于抗肝纤维化的药物作用研究。本实验中,复合因素处理大鼠4周后即可见肝细胞脂肪变性明显,肝脏门管区纤维组织增生,部分伸入肝小叶,同时肝指数和肝脏Hyp含量明显升高,说明本实验中肝纤维化模型的复制是成功的。
Tab 2 Effect of indole-3-carbinol(I3C)on liver homogenate SOD and MDA in rats(±s,n=8)
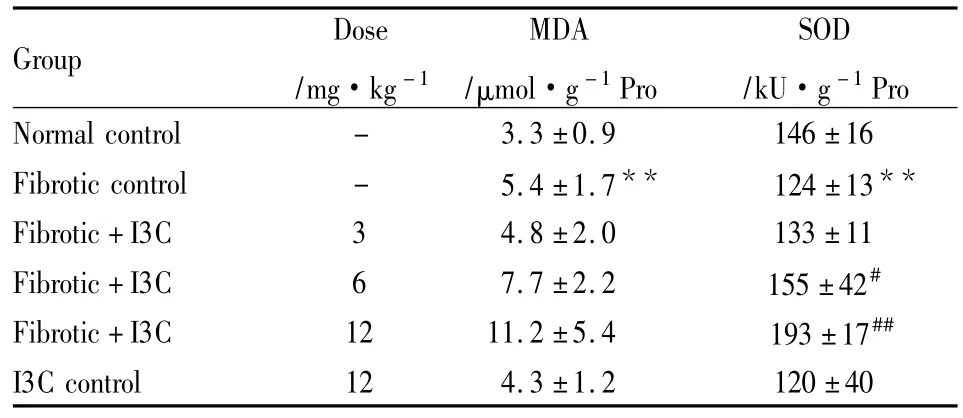
Tab 2 Effect of indole-3-carbinol(I3C)on liver homogenate SOD and MDA in rats(±s,n=8)
**P <0.01 vs normal control;#P <0.05,##P <0.01 vs fibrotic control.
Group Dose/mg·kg-1 MDA/μmol·g-1Pro SOD/kU·g-1Pro Normal control - 3.3 ±0.9 146±16 Fibrotic control - 5.4 ±1.7** 124±13**Fibrotic+I3C 3 4.8 ±2.0 133 ±11 Fibrotic+I3C 6 7.7 ±2.2 155 ±42#Fibrotic+I3C 12 11.2 ±5.4 193 ±17##I3C control 12 4.3 ±1.2 120 ±40
有报道,I3C对二甲亚硝胺、CCl4所致的急性肝损伤有保护作用[5-6],那么 I3C对慢性肝损伤是否同样具有保护作用呢?本研究利用复合因素所致大鼠肝纤维化模型,观察了I3C对肝纤维化的治疗作用。HE染色结果显示,I3C能够部分改善肝细胞的变性和坏死程度,促进肝纤维化的逆转。
已知自由基的大量生成和脂质过氧化反应加重是CCl4致肝细胞毒性的主要细胞机制,而且在CCl4致大鼠肝纤维化模型中发现,脂质过氧化反应与纤维生成呈明显正相关[9]。此外,乙醇的代谢产物,如乙醛,能够直接诱导HSC活化和胶原纤维的生成[10]。在本研究中,我们通过检测肝组织中 MDA含量和SOD活性,证实了复合因素所致肝纤维化形成过程中脂质过氧化反应加重。肝纤维化大鼠经I3C治疗后,小剂量组MDA含量有所降低,SOD活性则明显增加,且呈一定的量效关系,提示I3C对肝细胞具有一定的保护作用,使其抗氧化能力增强。
HSC的激活是肝纤维化形成的关键,本研究观察了 HSC 活化的特异性标志物——α-SMA[11]。首先,利用免疫组织化学技术观察了α-SMA在肝组织中的定位表达情况,研究结果显示,I3C给药组α-SMA的阳性表达比模型对照组明显减少,半定量分析结果亦显示出显著性差异,且呈现良好的剂量依赖性,说明I3C可减少活化HSC的数量,阻断肝纤维化形成的始动阶段。
此外,胶原作为一种ECM,是纤维化肝脏的主要成分之一[11]。活化的HSC合成大量胶原,使肝脏的胶原合成与降解失衡,而Hyp被认为是胶原的主要成分,因此本研究通过测定肝组织Hyp的含量来间接反映HSC激活和肝内胶原情况。结果显示,模型对照组大鼠肝组织Hyp含量较正常对照组明显增加,而各给药组Hyp含量则有不同程度的下降,这与Masson三色染色所观察到的肝脏胶原含量的半定量分析结果一致。肝纤维化是ECM合成大于降解,在肝脏内过度沉积所致。ECM的合成和降解过程主要由基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)/MMPs这对平衡剂来调节。MMPs可降解ECM,亦可以被内源性抑制因子 TIMPs 所抑制[12-13]。文献报道[14],肝纤维化恢复期,由于HSC的凋亡,TIMPs表达减少,其对MMPs的抑制作用也减弱,MMPs活性增强,胶原降解增加,肝纤维化逆转。本研究检测肝匀浆MMP-2蛋白的表达,发现I3C能促进MMP-2表达。以上结果说明I3C能够增强MMPs活性,促进ECM降解,降低肝脏胶原沉积,促进肝纤维化的逆转。
目前I3C在临床上主要用于肿瘤的辅助治疗。临床和动物实验均已证实,I3C毒副作用小,安全范围较宽。本研究发现,I3C对照组与正常对照组在病理检查和生化指标上几无差别,说明I3C在本研究受试浓度下较为安全。
综上所述,本研究发现I3C能有效的治疗复合因素所致的大鼠肝纤维化,其机制与其增强MMPs活性,促进ECM降解,并抗氧化有关。
[1]Aggarwal B B,Ichikawa H.Molecular targets and anticancer potential of indole-3-carbinol and its derivatives[J].Cell Cycle,2005,4(9):1201-15.
[2]Lee S H,Kim J S,Yamaguchi K,et al.Indole-3-carbinol and 3,3'-diindolylmethane induce expression of NAG-1 in a p53-independent manner[J].Biochem Biophysr Res Commun,2005,328(1):63-9.
[3]Nachshon-Kedmi M,Yannai S,Haj A,et al.Indole-3-carbinol and 3,3'-diindolylmethane induce apoptosis in human prostate cancer cells[J].Food Chem Toxicol,2003,41(6):745 -52.
[4]Plate A Y,Gallaher D D.Effects of indole-3-carbinol and phenethyl isothiocyanate on colon carcinogenesis induced by azoxymethane in rats[J].Carcinogenesis,2006,27(2):287 - 92.
[5]Shertzer H G,Tabor M W,Berger M L.Protection from N-nitrosodimethylamine-mediated liver damage by indole-3-carbinol[J].Exp Mol Pathol,1987,47(2):211 -8.
[6]Shertzer H G,Niemi M P,Reitman F A,et al.Protection against carbon tetrachloride hepatotoxicity by pretreatment with indole-3-carbinol[J].Exp Mol Pathol,1987,46(2):180 - 9.
[7]Guo Y,Wu X Q,Zhang C,et al.Effect of indole-3-carbinol on ethanol-induced liver injury and acetaldehyde-stimulated hepatic stellate cells activation using precision-cut rat liver slices[J].Clin Exp Pharmacol Physiol,2010,37(12):1107 -13.
[8]Ping J,Li J T,Liao Z X,et al.Indole-3-carbinol inhibits hepatic stellate cells proliferation by blocking NADPH oxidase/reactive oxygen species/p38 MAPK pathway[J].Euro J Pharmacol,2011,650(2-3):656-62.
[9]Comporti M,Arezzini B,Signorini C.F2-isoprostanes stimulates collagen synthesis in activated hepatic stellate cells:a link with liver fibrosis[J]?Lab Invest,2005,85(11):1381 -91.
[10]Siegmund S V,Dooley S,Brenner.Molecular mechanisms of alcohol-induced hepatic fibrosis[J].Dig Dis,2005,23(1):264 -74.
[11]Shi G F,Li Q.Effects of oxymatrine on experimental hepatic fibrosis and its mechanismin vivo[J].World J Gastroenterol,2005,11(2):268-71.
[12]Terumi T,Zhang L P,Yata Y,et al.Modulation of matrix metalloproteinase-9 in hepatic stellate cells by three-dimensional type I collagen:its activation and signaling pathway[J].Hepatol Res,2003,26(3):318 -26.
[13]Koks C A,Groothuis P G,Slaats P,et al.Matrix metalloproteinases and their tissue inhibitors in antegradely shed menstruum and peritoneal fluid[J].Fertil Steril,2000,73(3):604 -12.
[14]张 怡,平 洁,汪 晖.肝星状细胞凋亡信号途径及其药物治疗的研究进展[J].中国药理学通报,2009,25(1):16 -8.
[14]Zhang Y,Ping J,Wang H.The research progress of hepatic stellate cells apoptosis signaling pathway and the relative drugs[J].Chin Pharmacol Bull,2009,25(1):16 -8.

