猪胸膜肺炎放线杆菌ApxⅠA蛋白的原核表达及单克隆抗体的制备*
王海丽,葛长城,徐公义,赵德明
(1.聊城职业技术学院 聊城市畜禽疫病诊疗工程技术研究中心,山东聊城 252000;2.中国农业大学,北京 100193)
猪传染性胸膜肺炎(Porcine contagious pleuropneumonia)是由猪胸膜肺炎放线杆菌 (Actinobacillus pleuropneumoniae,APP)引起的一种急性或慢性以肺炎和胸膜炎为特征的传染病。该病可以通过空气或猪之间相互接触而传播,近年来发病率日益增高,给养猪业造成了重大的经济损失,已成为危害养猪业最严重的疾病之一[1]。APP对患猪肺部防御系统的破坏,使此病往往与伪狂犬病、猪蓝耳病等病毒性疾病混合或继发感染,加大疾病的危害,造成更大的损失[2]。APP共有15种血清型,且各个国家流行的优势血清型各不相同[3]。不同血清型间及同一血清型不同菌株的毒力由多种因素决定,包括荚膜多糖、脂多糖、转铁结合蛋白、脲酶和RTX毒素等[4]。
RTX(repeat in toxin,RTX)是多种革兰阴性菌产生的一种外毒素,具有可使脂质双层膜形成通道的特性。不同血清型的APP分别表达不同的溶血素(hemolysins)和细胞毒素(cytotoxins),即 ApxⅠ、ApxⅡ、ApxⅢ和ApxⅣ,都属于细胞孔形成毒素。前3种Apx毒素既是APP致病的主要毒力因子,又是APP主要的保护性抗原[5]。ApxⅠ具有典型的RTX毒素单元结构特征,具有很强的溶血活性和细胞毒性,分子质量为105ku,它对猪的肺泡巨噬细胞和中性粒细胞也具有很强的细胞毒性作用,由毒力较强的血清1、5、9、10和11型表达并分泌[6]。ApxⅡ存在于除血清10型外的所有血清型。ApxⅢ被血清2、3、4、6、8、15型分泌;所有的血清型均能分泌ApxⅣ,据称其只在体内表达,在体外培养基中不能诱导其表达,故血清10型在体外培养只表达ApxⅠ[7]。ApxⅠ操纵子包括4个基因,分别为激活基因ApxⅠC、结构毒素基因ApxⅠA和两个分泌必需基因ApxⅠB和ApxⅠD。有证据显示ApxⅠA基因是位于ApxⅠN端的疏水结构,是ApxⅠ的主要抗原位点,能刺激机体产生中和保护性抗体[8]。
根据山 东 省 APP 血 清 型 特 点[9-10],本 试 验 以APP血清10型标准菌株天然分泌的外毒素ApxⅠ为免疫原,以血清5型ApxⅠN端1 149bp基因克隆、表达的融合蛋白为筛选抗原,研制了抗ApxⅠA单克隆抗体mAb,并对其生物学活性进行了分析。
1 材料与方法
1.1 材料
1.1.1 实验动物、细胞系及菌株 6周龄Balb/c纯系小鼠,由上海中科院实验动物中心提供(清洁级);小鼠骨髓瘤细胞系(SP2/0)由中国农业大学动物医学院病理实验室保存并传代;APP 3、5、7、10型标准菌株购自中国兽医药品监察所;猪链球菌2型、猪多杀性巴氏杆菌、副猪嗜血杆菌、猪胸膜肺炎放线杆菌等菌株为聊城市畜禽疫病诊疗工程技术研究中心保存。APP血清10型猪阳性血清由聊城市畜禽疫病诊疗工程技术研究中心制备。
1.1.2 主要试剂 RPMI 1640为Gibco公司产品;HAT、HT为Invitrogen公司产品;PEG 1500为Roche公司产品;羊抗小鼠IgG-HRP为Promega公司产品;弗氏完全佐剂、弗氏不完全佐剂为Gibco BRL公司产品;HAT、HT、Mab亚类鉴定试剂盒为Sigma公司产品。
1.2 方法
1.2.1 免疫原的提取及纯化 将血清10型APP接种于含0.2mL/L NAD、50mL/L 犊牛血清、1 mmol/L CaCl2的LB液体培养基中,37℃振荡培养12h(180r/min),培养物于4℃5 000r/min离心30 min,收集上清液。将上清缓慢加入饱和硫酸铵至60%饱和度,4℃过夜,经4℃以5 000r/min离心30 min,收集沉淀,并用10mmol/L Tris-HCl缓冲液(pH 7.4)溶解;通过4℃透析、超滤管浓缩、Sephadex G-200凝胶层析纯化Apx I。层析液用紫外分光光度法及SDS-PAGE进行浓度、纯度的鉴定。
1.2.2 基因的克隆与测序 根据GenBank登录的ApxⅠA基因序列(AF363361),设计一对特异性引物:上游引物:5′-CCGGAATTCGAAAATGGTTTGGGAC(划线部分为引入的EcoRⅠ的酶切位点);下 游 引 物:5′-CCGGGATCCGAAGATTGCCTGTTTAG(划线部分为引入的BamHⅠ酶切位点)。将PCR产物回收后克隆至载体pMD18-T中,转化至感受态E.coli BL21。通过限制性内切酶筛选和鉴定阳性质粒,并由上海博亚生物技术有限公司进行序列测定,测定结果使用http://www.ncbi.nlm.nih.gov/BLAST 进行同源性分 析,并应用DNA Star软件验证其阅读框。
1.2.3 ApxⅠA原核表达载体的构建 采用常规方法将ApxⅠA基因片段克隆至pET-32a载体中,并转化BL21感受态细胞。对酶切鉴定的阳性质粒进行测序分析。
1.2.4 蛋白的表达、纯化 选取高表达的pET-32a-apxⅠA重组体扩大培养[11],IPTG 诱导目的蛋白的表达。培养液离心后的沉淀用PBS(pH 7.4)洗两遍。用1/10培养液的PBS重悬菌体,冰浴下超声碎菌30min(工作30s,间隔30s),于4℃12 000r/min离心15min,收集沉淀,用等体积含20 g/L十二烷基肌氨酸钠(SKL)的 PBS(pH 7.4)重悬,震振溶解,4℃下至包涵体充分溶解后10 000 r/min离心10min,将上清转入透析袋并加入终浓度为2g/L的PEG 4 000和终浓度为50mmol/L的氧化型谷胱甘肽与100mmol/L的还原性谷胱甘肽,用PBS(pH 8.0)4℃透析3d,每天换3次,不断搅拌。SDS-PAGE分析重组蛋白表达情况。
1.2.5 抗原性鉴定 将纯化的血清10型外毒素ApxⅠ蛋白及融合蛋白rApxⅠA进行SDS-PAGE电泳,转化至硝酸纤维素膜上,以APP血清10型猪阳性血清为一抗,Western blot分析。
1.2.6 动物免疫 用制备的天然毒素加等量弗氏完全佐剂乳化,分多点皮下注射3只Balb/c小鼠(30μg/只~50μg/只),14d后将适量抗原加等量弗氏不完全佐剂乳化,进行第2次免疫,14d后第3次免疫。三免10d后,断尾取血液1滴,测抗体效价。选滴度高的1只小鼠,用50μg天然毒素不加佐剂,腹腔注射加强免疫。3d~4d后,无菌取小鼠脾脏,制备免疫脾细胞悬液。
1.2.7 检测方法的建立 采用方阵滴定法确定间接ELISA所用包被抗原和抗体的最适工作浓度。将Balb/c小鼠阳性血清和阴性血清均做倍比稀释,确定最适工作浓度。
1.2.8 细胞融合和单克隆抗体的筛选 按文献[12]方法制备免疫小鼠脾细胞与SP2/0细胞,融合剂采用PEG 1 500。融合过程参考文献[13]方法进行。待融合细胞生长到培养孔底面积的1/3~1/2时采用间接ELISA方法筛选。选择分泌抗体效价高、呈单个克隆生长、形态良好的杂交瘤细胞继续克隆3次以上,直至抗体分泌阳性率达100%为止,及时液氮冻存并制备单抗腹水。
1.2.9 单克隆抗体的特异性及稳定性鉴定
(1)间接ELISA鉴定单抗的特异性 用猪链球菌2型、猪多杀性巴氏杆菌、副猪嗜血杆菌37℃震荡培养后,离心收取上清中蛋白,方法同APP外毒素的制备方法,包被ELISA板。腹水的工作浓度为1∶1 000,以间接ELISA测定4H3和11B5mAb特异性。
(2)Western blot鉴定 猪链球菌2型、猪多杀性巴氏杆菌、副猪嗜血杆菌培养物,加入IPTG诱导培养后,分别离心收集菌体裂解后进行SDS-PAGE电泳,然后用湿法将蛋白转印到硝酸纤维素膜上,80 V 转印1.5h,PBST洗膜3次,5min/次,腹水按一定浓度稀释后作用于膜4℃过夜,洗膜同上。加入1∶10 000稀释的羊抗鼠IgG-HRP,室温摇床上作用2h,洗膜3次,DAB显色。
(3)杂交瘤分泌抗体的稳定性 对鉴定的2株阳性ApxⅠ杂交瘤细胞,分别液氮中保存细胞株。另外部分细胞传30代以上,以间接ELISA检测培养上清。细胞冻存6个月后复苏细胞,显微镜下检测细胞活性。
(4)单克隆抗体亚型鉴定 按鼠类单克隆抗体亚类鉴定试剂盒说明书鉴定Ig亚类,以OD490nm值明显高于其他孔者,所加亚类血清判断为单抗亚类。
2 结果
2.1 Apx IA基因序列同源性分析
从GenBank数据库中下载APP血清1型(AF240779、X52899、X68595、U05042)、血清5型(U04954、CP000569、AF363361)、血 清 9 型(X73ll7)、血清10型 (D16582)ApxI A 基因序列,与去除酶切位点和保护性碱基的测序基因序列,进行核核酸序列同源性比较发现,同猪传染性胸膜肺炎l、5、9、10型的 ApxI A基因同源性高达98.8%~100%。
2.2 ApxⅠA重组表达质粒的构建及蛋白的表达、纯化
质粒用EcoRⅠ和BamHⅠ进行双酶切,凝胶电泳显示,观察到约1 049bp的目的片段,表明成功地构建了含ApxⅠA基因片段的重组表达质粒(图1)。SDS-PAGE显示,诱导后的重组菌在分子质量约41ku处有一清晰的新生条带,纯化后获得了较为纯的单一蛋白条带(图2)。
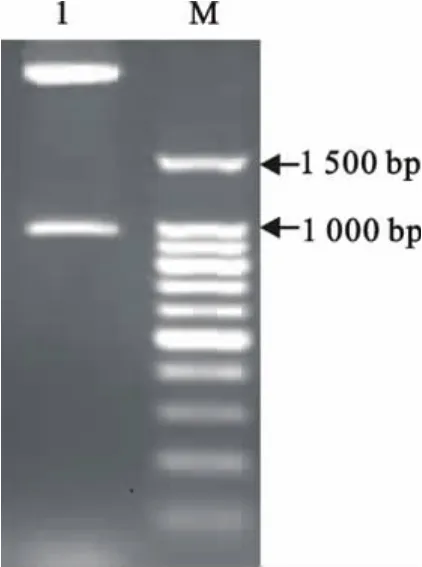
图1 重组质粒pET-32a-apxⅠA的酶切鉴定Fig.1 Identification of recombinant plasmid pET-32a-apxⅠA by enzyme digestion
2.3 ApxⅠ天然外毒素的提取
获得的天然外毒素,经硫酸铵纯化、浓缩后,经紫外分光光度计测定蛋白浓度为1.9mg/mL。Western blot检测蛋白大小约105ku(图3)。
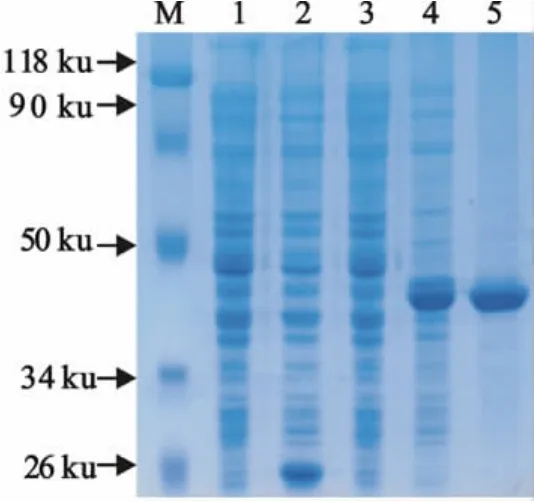
图2 表达产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of fusion protein rApxⅠA
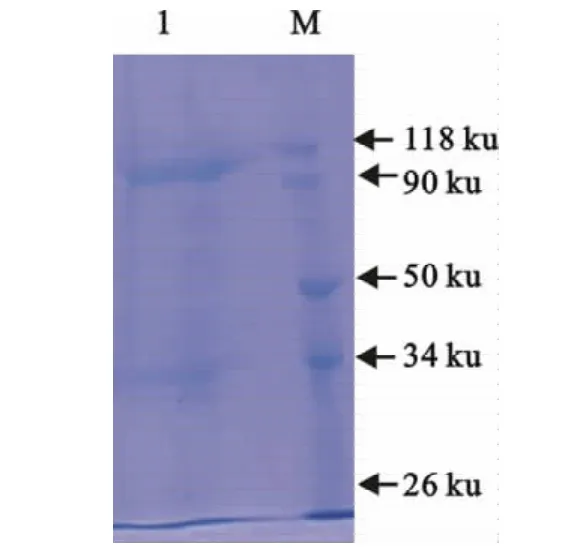
图3 天然外毒素SDS-PAGE分析结果Fig.3 SDS-PAGE analysis of natural outer toxin
2.4 Western blot分析
Western blot的结果显示,提取的APP天然外毒素ApxⅠ在相对分子质量在105ku处与APP猪阳性血清发生特异性反应条带;原核表达的融合蛋白约在41ku处与APP猪阳性血清发生特异性反应条带,表明制备的融合蛋白具有特异性(图4)。
2.5 杂交瘤细胞系的建立
细胞融合后5d观察,细胞的融合率为100%,抗体检测阳性率为51%。选择其中4个抗体阳性的融合细胞孔细胞株进行了3~5次克隆化,最终获得细胞阳性率为100%,分泌稳定、形态良好的细胞株共2株。
2.6 间接ELISA检测单克隆抗体特异性
在490nm波长下,腹水与rApxⅠA蛋白、APP 10型作用数值,明显高于APP 3型、APP 7型、猪链球菌2型、猪多杀性巴氏杆菌、副猪嗜血杆菌的数值(图5),说明4H3、11B5两株抗ApxⅠ单克隆抗体有良好的特异性。

图4 蛋白的Western blot分析Fig.4 Western blot analysis of proteins
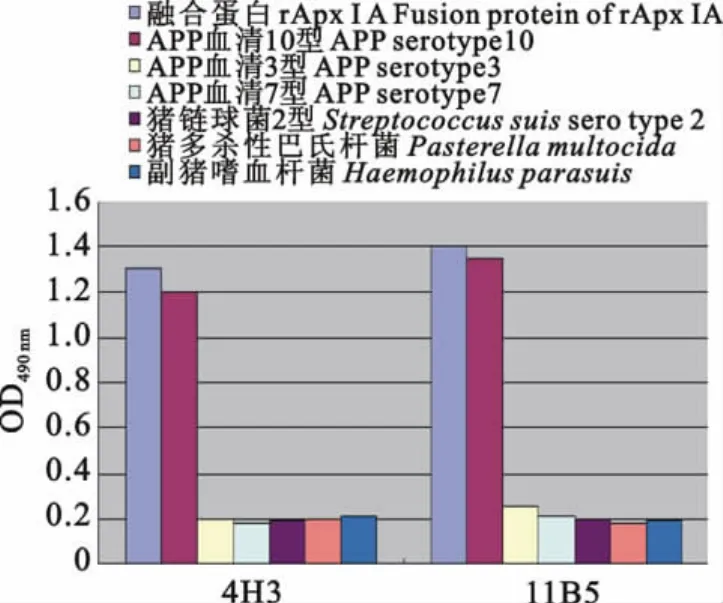
图5 ApxⅠA mAb特异性检测Fig.5 Specific detection of ApxⅠA mAb
2.7 Western blot鉴定单克隆抗体特异性
2株ApxⅠA单克隆抗体腹水与APP 3型、APP 7型、猪链球菌2型、猪多杀性巴氏杆菌、副猪嗜血杆菌的裂解液没有反应条带,而与rApxⅠA、APP 10型分别在相对分子质量约41ku和100ku处有棕色反应条带(图6),表明2株单克隆抗体具有良好的反应原性。
2.8 单克隆抗体效价的测定
上述2株杂交瘤细胞分泌的单克隆抗体腹水效价在1∶104~1∶105;单克隆细胞株在培养24h且有很强的活力下,吸取培养上清进行测定。上清中单抗效价为1∶256~1∶512之间(表1)。表明连续传代的杂交瘤细胞培养液上清中抗体效价没有降低。
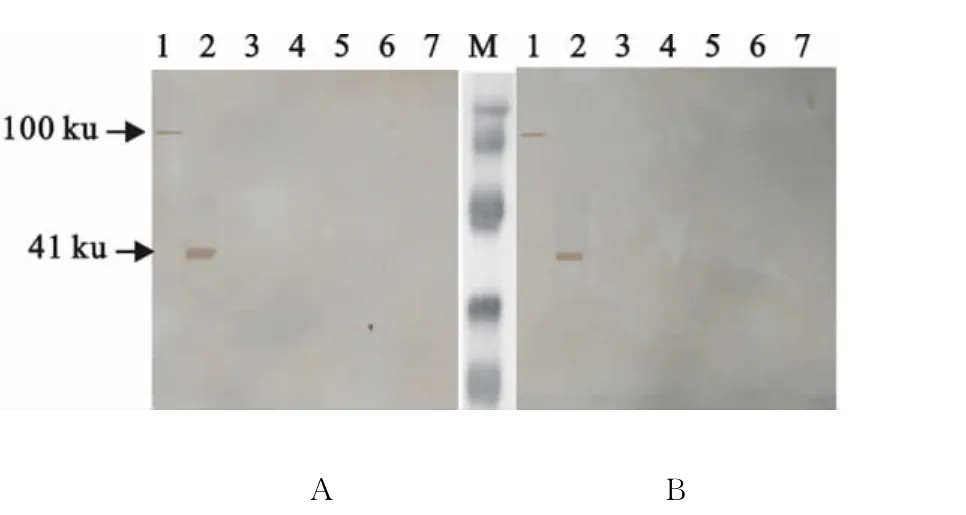
图6 Western blot鉴定mAb特异性Fig.6 Specific detection mAb by Western blot
2.9 杂交瘤细胞系的稳定性
上述2株杂交瘤细胞体外传30代后,间接ELISA检测培养上清中的mAb,其效价基本不变。保存于液氮中的杂交瘤细胞冻存6个月后其效价基本不变(表1),说明获得的2株杂交瘤细胞系稳定性好。
2.10 单克隆抗体的亚型鉴定
4H3mAb分子的亚类为IgG3;11B5mAb的分子亚类为IgG2a。

表1 单克隆抗体效价检测Table 1 Detection titers of monoclonal antibodies
3 讨论
APP溶血毒素Apx I分子质量为105ku,是分泌到APP菌体外的一类外毒素,对猪的肺泡巨噬细胞和中性粒细胞也具有很强的细胞毒性作用,由毒力较强的血清1、5、9、10和11型表达并分泌,其中APP血清10型包括ApxⅠ和ApxⅣ两种Apx毒素,而体外培养中不会产生ApxⅣ毒素[14]。本研究的制备采用APP 10型标准株体外培养法获取天然ApxⅠ蛋白。Apx I分泌量相对较少,受多种因素的影响。由于APP 10型是依赖NAD的Ⅰ型,低浓度NAD的培养条件能够使APP分泌更多的毒素[15],另外,培养液中游离的Ca2+可影响ApxⅠ的分泌[16],笔者在LB培养液中加入0.2g/L NAD和终浓度为1mmol/L的CaCl2,在此条件下培养12h时Apx I的分泌量达到最大。在Apx I纯化时,将Sephadex G-200凝胶过滤层析、超滤管超滤同时进行,由于超滤管具有浓缩作用,这样较使用聚乙二醇浓缩既可以保证Apx I活性不会降低,而且也提高了样品的纯度及产量,满足了研究的需要。
据报道,ApxⅠ的N-端蛋白免疫原性良好,可以抵抗特异性菌致死剂量的攻击,对鼠可诱发保护性免疫,基本可以达到ApxⅠ的免疫效果。ApxⅠA位于ApxⅠ的N端,本研究构建了APP pET-32aapxⅠA表达质粒,可表达ApxⅠA融合蛋白以用于单克隆抗体的筛选,为研究ApxⅠA的生物学活性及其在疾病和疫苗免疫中的作用奠定了基础。
在单克隆抗体制备过程中,阳性克隆的筛选选择表达纯化的融合蛋白rApxⅠA为包被抗原,采用间接ELISA检测,避免了融合蛋白中His Tag标签蛋白的干扰,确保了单克隆抗体的特异性。通过方阵滴定法确定了间接ELISA抗原的包被浓度与腹水的最佳稀释度分别为1∶160(此时蛋白浓度约为50μg/mL)和1∶1 000。研制出的2株分泌抗ApxⅠA的杂交瘤细胞系经ELISA和Western blot鉴定,具有良好的特异性和稳定性,为进一步建立猪胸膜肺炎放线杆菌检测方法奠定了基础。
[1]Tascon R I,Vazquez Boland J A,Gutierrez Martin C B,et al.Virulence factors of the swine pathogenActinobacilluspleuropneumoniae[J].Microbiol SEM ,1996,12:171-184.
[2]Enriquez-Verdugo I,Guerrero A L,Serrano J,et al.Adherence ofActinobacilluspleuropneumoniaeto swine-lung collagen[J].Mirobiology,2004,150:2391-2400.
[3]Blackall P J,Klaasen H L,Van Den Bosch P,et al.Proposal of a new serovar ofActinobacilluspleuropneumoniae:serovar 15[J].Vet Microbiol,2002,84(1-2):47-52.
[4]Haesebrouck F,Chiers K.Actinobacilluspleuropneumoniaeinfection in pigs:the role of virulence factors in pathogenesis and protection[J].Vet Microbiol,1997,58:239-249.
[5]Maier E,Reihhard N,Benz R,et a1.Channel-forming activity and channel size of the RTX toxins ApxⅠ,ApxⅡand ApxⅢofActinobacilluspleuropneumoniae[J].Infect Immun,1996,64:4415-4423.
[6]Boekema B K,Kamp E M,Smits M A,et al.Both ApxⅠand ApxⅡofActinobacilluspleuropneumoniaeserotype 1are necessary for full virulence[J].Vet Microbiol,2004,100(1-2):17-23.
[7]Beck M,Ven Den Bosen J F,Jongendlen M C A,et al.RTX toxin genotyoes and phenotypes inActinobacilluspleuropneumoniaefield strins[J].J Clin Microbiol,1994,32:2749-2753.
[8]Sea J N,Frey J,Kwang J.The N-terminal domain of RTX toxin ApxⅠofActinobacilluspleuropneumoniaeelicits protective immunity in mice[J].Infec Immun,2002,70(11):6464-6467.
[9]徐公义,王海丽,刁有祥,等.猪胸膜肺炎放线杆菌血清型与溶血毒素型的调查[J].中国兽医杂志,2008,44(6):37-38.
[10]王海丽,徐公义,葛长城,等.猪胸膜肺炎放线杆菌种及血清1,5,7型多重PCR检测方法的建立[J].中国兽医科学,2009,39(8):728-732.
[11]徐公义,王海丽,葛长城,等.猪胸膜肺炎放线杆菌APXⅠ A蛋白的截断表达与鉴定[J].畜牧与兽医,2008,40(10):67-69.
[12]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000:23-74.
[13]孙 炜,王铁成,杨松涛,等.犬瘟热病毒单克隆抗体的制备及鉴定[J].动物医学进展,2011,32(3):73-77.
[14]胡成名,文心田,曹三杰,等.猪胸膜肺炎放线杆菌Apx毒素的分子生物学与致病机理[J].动物医学进展,2007,28(7):94-98.
[15]王 辉,刁有样,孟凡磊.不同NAD含量条件下培养的猪胸膜肺炎放线杆菌对小白鼠致病性和免疫保护性的影响[J].福建农林大学学报,2007,36(4):400-404.
[16]王春来,杨旭夫,刘 杰.胸膜肺炎放线杆菌溶血毒素特性鉴定及免疫原性研究[J].中国预防兽医学报,2001,23(3):209-213.