IFN-γ在胚泡植入期大鼠卵巢的分布*
司丽芳,陈树林,范光丽,高春生,赵 瑾
(1.河南科技大学动物科技学院,河南洛阳471003;2.西北农林科技大学动物医学院,陕西杨凌712100;3.河南农业大学牧医工程学院,河南郑州450002;4.上海朝翔生物技术有限公司,上海201609)
胚胎在母体子宫的生长发育是动物个体发育的重要阶段,期间多种生长因子和激素均起着调控作用[1],IFN-γ属于免疫 调控型 细胞因子[2-3],在免疫性疾病的治疗中用途广泛[4-6],也是妊娠调控中必需的细胞因子之一[7]。研究表明,IFN-γ在卵泡发育、胚胎植入、妊娠维持等方面均发挥一定功能,主要通过参与妊娠子宫内膜基质细胞的蜕膜化及影响有机体性器官激素水平而在妊娠维持中发挥其调控[8-9]。有研究证明,给孕鼠注射低剂量的IFN-γ不仅对妊娠维持起着一定的作用,而且还有利于增强孕鼠抗寄生虫感染的能力[10]。卵巢属于重要的生殖器官,其功能活动受到垂体和下丘脑的调控。腺垂体内促性腺激素细胞分泌的FSH 和LH,随着血流到达卵巢时,与分布在卵泡颗粒细胞上特异性FSH和LH 受体结合,从而可以促进卵泡的生长及卵泡类固醇的生成[11-12]。近年来对于卵巢中细胞因子表达变化的研究较多,但有关IFN-γ在卵巢中的分布和表达情况的报道较少,对其在胚泡植入期卵巢中的定位和表达尚未见报道。为此,本研究采用免疫组织化学和图像分析方法,对大鼠胚泡植入期卵巢中IFN-γ的表达进行了研究,以探讨IFN-γ在早期胚胎发育和胚泡植入过程中的调控机制,为进一步阐明IFN-γ及其相关因子对妊娠的调控提供形态学依据。
1 材料与方法
1.1 材料
健康性成熟SD 大鼠,体重200g~220g,购自河南省实验动物中心,饲养管理1 周后用于试验。用阴道涂片法检测发情周期,取发情期的雄鼠与雌鼠1∶1 合笼过夜。次日清晨逐个检查雌鼠,发现精子或阴道栓者定为妊娠D1。取妊娠D6大鼠10只进行试验。
1.2 方法
1.2.1 取材及切片 实验动物均在上午9 时处死取卵巢,随后迅速置于4℃40mL/L 的多聚甲醛磷酸缓冲液中固定12h~24h,梯度乙醇脱水,二甲苯透明,石蜡包埋,做连续切片,片厚5μm,隔3取3,共制备3套切片,一套行HE染色以作阳性细胞定位,一套用于阴性对照,一套用于IFN-γ免疫组化染色。
1.2.2 免疫组化操作程序 一抗为兔抗鼠的IFN-γ多克隆抗体(工作浓度1∶100,武汉博士德公司生产),阴性对照采用0.01mol/L PBS 缓冲液代替一抗,按如下程序进行①切片脱蜡复水,经pH 6.0的0.01mol/L 的柠檬酸抗原修复液热抗原修复。②每张切片加1 滴(约50μL)过氧化酶阻断溶液(A液),室温下孵育10 min,PBS 冲洗3 次,每次3min。③除去PBS液,每张切片加1 滴(约50μL)正常非免疫动物血清(B 液),室温下孵育10min。④除去血清,每张切片加1滴(约50μL)兔抗大鼠IFN-γ抗体,室温下孵育60 min 或4℃过夜。⑤PBS冲洗3次,每次5min。除去PBS 液,每张切片加1 滴(约50μL)生物素标记的第二抗体(C液),室温下孵育10 min。PBS 冲洗3 次,每次3 min。⑥除去PBS液,每张切片加1 滴(约50μL)链霉菌抗生物素-过氧化物酶溶液(D 液),室温下孵育10min。PBS冲洗3 次,每次3min。⑦除去PBS 液,每张切片加2 滴(约100μL)新鲜配置的DAB 溶液,显微镜下观察3min~10min。⑧自来水冲洗,苏木素复染,自来水冲洗返蓝。⑨梯度乙醇脱水,二甲苯透明,中性树胶封片。阴性对照组切片染色按免疫组织化学超敏SP法染色步骤进行,只是把步骤④中加的兔抗大鼠IFN-γ 抗体用PBS液代替,其余步骤完全相同。
1.2.3 结果判断 染好的切片均在显微镜下观察并照相。光镜视野下,有棕色颗粒的细胞判为阳性,根据着色强弱可分以下几级:淡棕色判断为弱阳性;棕色判断为中等阳性;深棕色判断为强阳性。阴性对照切片无色或淡黄色。
2 结果
免疫反应产物在不同发育阶段的卵泡及卵泡液和粒性黄体细胞均广泛分布。在原始卵泡的卵母细胞及其周围一层扁平的卵泡细胞的胞浆内均充满棕色颗粒,呈现强阳性反应。在初级卵泡的颗粒细胞、卵母细胞及其卵泡膜细胞的细胞浆内也充满棕色阳性颗粒,呈现强阳性反应。次级卵泡的颗粒细胞及其卵泡内膜细胞的胞浆中IFN-γ蛋白也呈现强阳性反应,而卵母细胞则呈现弱阳性反应(图1A)。在近成熟卵泡的卵泡液与卵母细胞呈现中等阳性反应,颗粒细胞呈现强阳性反应,阳性产物定位于细胞浆中卵泡内膜细胞则呈弱阳性反应,阳性产物定位于胞浆中。基质血管的内皮细胞呈现强阳性反应,卵巢表面被覆的单层立方形的生殖上皮细胞也呈强阳性反应,黄体中的粒性黄体细胞的胞浆呈现强阳性反应(图1B)。
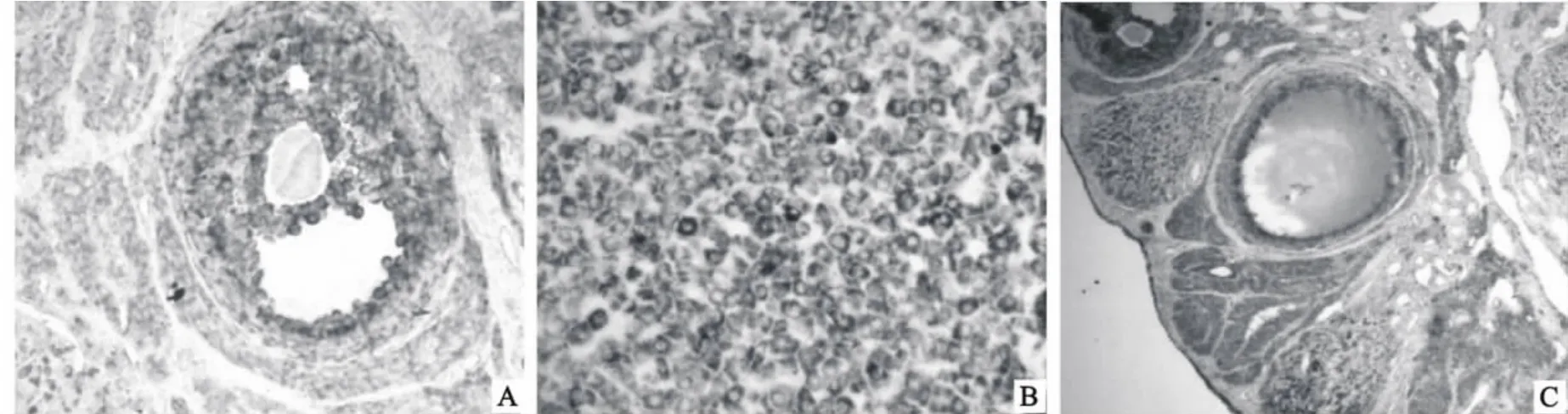
图1 胚泡植入期SD 大鼠卵巢组织中IFN-γ 蛋白分布图(400×)Fig.1 Photographs o f IFN-γstaining location during implantation of embryo in SD rat ovary
3 讨论
胚胎的植入是一个复杂的生理过程,需要诸多激素、细胞因子、生长因子及其与基质降解相关的酶分子和血管形成因子等的共同参与。近年的研究表明,IFN-γ对妊娠有重要影响[13-14],是妊娠必须的细胞因子之一。在正常妊娠状态下,适量IFN-γ可以防止胎盘组织过度生长而侵入子宫。IFN-γ在保持蜕膜细胞的完整性、蜕膜血管的重建以及"着床窗口"的打开方面也起着重要作用[15],有研究报道在胚胎植入点的许多细胞均表达IFN-γ受体。Hirota Y 等[16]研究报道,在胚胎植入期间,滋养层细胞和胚胎分泌的IFN-γ均可以促进胚胎的附植及正常妊娠的维持,这种有益作用是通过IFN-γ刺激子宫内膜上皮细胞表达CXCL11(一种化学趋化因子)而实现的,CXCL11能够诱导T 细胞以及滋养层细胞的迁移,还可以诱导子宫内膜基质细胞增殖及子宫内膜上皮细胞的凋亡,而关于IFN-γ在胚胎植入期卵巢组织中表达的研究尚未见报道。
宿滨等[17]研究报道,离体培养的兔卵巢颗粒细胞中能观察到IFN-γ对颗粒细胞产生的孕酮具有促进作用。Grasso G 等[18]也研究证实,人卵泡液中IFN-γ的浓度明显高于外周血中的浓度而对妊娠起着重要作用。易小芳[19]通过ELISA 法检测正常妊娠人类卵泡液中IFN-γ对妊娠卵巢的分泌功能有影响。本研究结果表明,IFN-γ在植入期大鼠卵巢的各级卵泡、卵泡液及黄体的粒性黄体细胞均有分布,表明IFN-γ在大鼠妊娠植入期发挥着一定调节作用,有关其作用机理尚待深入研究。
[1]Zhang J,Dong H,Wang B,et al.Dynamic changes occur in patterns of endometrial EFNB2/EPHB4expression during the period of spiral arterial modification in mice[J].Biol Reprod,2008,79(3):450-458.
[2]李成山,苏运芳,屈延延,等.蜂胶对小鼠T 细胞亚群及主要相关因子分泌的影响[J].动物医学进展,2011,32(3):17-20.
[3]Lausman A Y,Yaseen E,Sam D,et al.Intrahepatic cholestasis of pregnancy in woman with a multiple pregnancy:an analysis of risks and pregnancy outcomes[J].J Obstet Gynaecol Can,2008,30(11):1008-1013.
[4]Somani A K,Swick A R,Cooper K D,et al.Severe dermatomyositis triggred by interferon Beta-1αtherapy and associated with enhanced type 1interferon signaling[J].Arch Dermatol,2008,144(10):1341-1349.
[5]Liao A P,Salajegheh M,Morehouse C,et al.Human plasmacytoid dendtritic cell accumulation amplifies their type 1interferon production[J].Clin Immunol,2010,136(1):130-138.
[6]祖 宁,王国春.多发性肌炎/皮肌炎患者干扰素表达及与临床的相关性[J].中华医学杂志,2011,91(17):1157-1160.
[7]吴晓妍,王秋伟,黄瑞萍,等.IFN-γ在妊娠免疫调节中的作用[J].安徽医学,2010,31(5):436-438.
[8]Bulla R,Fischetti F,Bossi F,at al.Feto-matemal immune interaction at the placental level[J].Lupus,2004,13(9):625-629.
[9]张晓思,钟秀会.黄芩白术对着床期小鼠IFN-γ、IL-10及NO含量的影响[J].动物医学进展,2010,31(6):80-84.
[10]Cao Y Q,Sun D M,Chen Y Z,et al.Studies on the antifertility effect and the mechanism of action of human recombinant interferon-gamma in rabbits[J].Reprod Med,1999,8(2):98-102.
[11]Wu X Y,Wei H M,Zhang J H,et al.Increased uterine NK-derived IFN-γand TNF-αin C57BL/6Jmice during early gestation[J].Cell Mol Immunol,2006,2(3):131-137.
[12]李云庆.神经解剖学[M].陕西西安:第四军医大学出版社,2006:148-156.
[13]曹 霞,王莲莲,罗 希.妊娠肝胆汁淤积症外周血Th1/Th2细胞因子表达分析[J].蚌埠医学院学报,2011,36(3):276-277.
[14]王菲菲,吴求吉,谢 哲,等.大鼠生殖道沙眼衣原体感染后C3a、γ干扰素和白血病抑制因子在子宫蜕膜的表达及其意义[J].解剖学报,2010,41(8):587-591.
[15]Ashkar A A,Croy B A.Interferon-γcontributes to the normalcy of murine pregnancy biology of reproduction[J].Bio Reprod,1999,61(2):493-502.
[16]Hirota Y,Osuga Y,Koga K,et al.The expression and possible roles of chemokine CXCL11and its receptor CXCR3in the human endometrium[J].J Immunol,2006,177(12):8813-8821.
[17]宿 滨,王启发,姜 良,等.干扰素-γ对兔离体的卵巢颗粒细胞孕酮生成的影响[J].基础医学与临床,1994,14(3):30-32.
[18]Grasso G,Asano A.Immunohistochemical localization of interferon-gamma in normal human ovary[J].Gynecol Endocrinol,1994,8(3):161-168.
[19]易晓芳.TNF-α及IFN-γ在人卵泡液中的检测及其与颗粒细胞凋亡的关系[D].北京:中国医科大学妇产科,2009.