山羊痘和绵羊痘研究进展*
吴海燕,孙秀峰
(1.青岛市动物卫生监督所,山东青岛 266071;2.青岛市畜牧兽医研究所,山东青岛 266100)
山羊痘(Goat pox,GP)和绵羊痘(Sheep pox,SP)俗称“羊天花”,统称羊痘(Capripox),是分别由山羊痘病毒(Goat pox virus,GPV)和绵羊痘病毒(Sheep pox virus,SPV)感染引起的山羊与绵羊的病毒性传染病,皆为世界动物卫生组织(OIE)法定报告的动物疫病。发病动物典型特征为体温升高,全身性或局部呈现约1cm丘疹或水疱,持续3周~4周后留下永久性凹陷状疤痕,病死率较高,羔羊病死率接近100%[1]。羊痘呈现地域流行性特征,可导致奶羊产奶量下降、母羊孕期流产、肉羊体重减轻、绵羊羊毛质量受损等。空气传播、蚊虫叮咬和体液接触是该病的主要传播途径,无母源抗体保护的羔羊和未经羊痘疫苗免疫的成年羊最易感染羊痘,有时呈全身性皮肤病变。
1 病原
GPV和SPV分别为GP和SP的病原体,二者同属于痘病毒科(Poxviridae)、脊椎动物痘病毒亚科(Chordopoxvirinae)、羊痘病毒属(Capripoxvirus)成员,同属另有皮肤疙瘩病病毒(Lumpy skin disease virus,LSDV)[2-3]。成熟的羊痘病毒(Capripoxvirus,CPV)颗粒呈砖形,由外膜、芯髓、侧体组成,某些病毒颗粒含有囊膜。病毒大小约为300nm×270nm×200nm,表面呈现管状结构,内部芯髓两侧为两个凸透镜状侧体。CPV在胞浆中复制,通过胞吞方式出芽,而非细胞裂解释放病毒粒子,并可在发育的鸡胚绒毛尿囊膜、羊肾和睾丸的单层细胞上良好地生长[4-5]。GPV耐干燥,对乙醚敏感,冻融对其没有明显灭活作用;SPV同样可以适应干燥环境,但对热抵抗力较低,易被200mL/L乙醚或氯仿,或者20mL/L福尔马林灭活[6]。CPV基因组由单分子线状双股DNA组成,Tulman E R等[7]比较了3个SPV野毒株和2个GPV疫苗株全基因组序列。结果表明,SPV和GPV基因组由中央编码区和两侧相同的反向末端重复序列组成,长度约为150kb,A+T含量约为75%;在全基因水平上,两者具有96%同源性;在氨基酸水平上,两者具有4%差异性;3个SPV野毒株全基因组含有147个开放阅读框(ORF),编码蛋白的氨基酸含量从53至2 027个不 等[7]。基 于 Tulman E R 等[7]的 研 究,Gubser C等[8]比较了这5株CPV与痘病毒科其他21株痘病毒的进化关系,结果表明,猪痘病毒(Suipoxvirus)与CPV进化关系最为密切,可能来自同一祖先。
2 羊痘流行病学
2.1 羊痘的全球性地理分布
GPV与SPV虽然具有宿主特异性,但二者可在山羊和绵羊之间传播。某些毒株对绵羊和山羊具有相同致病性,羊痘易传入毗邻疫病区的国家并在其范围内流行[9]。GPV与SPV在全球具有不同的地理分布,疫区集中于亚洲和非洲,主要包括赤道以北非洲、北亚、中东、南亚、中亚等地区,近10年报道的疫病区主要包括越南、印度、蒙古国等,详细信息见表1。非法动物贸易和跨国往来是羊痘传入非疫区的主要原因,另外,气候的改变、昆虫的繁殖,同样加速了病原体的跨国界传播。

表1 2001年-2011年全球山羊痘和绵羊痘暴发情况Table 1 The global status of GP and SP outbreaks from 2001to 2011
2.2 羊痘在我国的地理分布
羊痘在我国青海、甘肃、湖南、内蒙等地区广泛流行,给养羊业带来较大经济损失。根据2010年《中华人民共和国农业部兽医公报》发布的疫情信息,我国14个省、自治区在该年度出现了羊痘疫情,其中包括:内蒙、辽宁、吉林、江苏、浙江、安徽、福建、湖南、贵州、云南、甘肃、青海、宁夏、新疆。笔者根据2010年《中华人民共和国农业部兽医公报》每月发布的疫情信息,总结了我国该年度羊痘的地域分布与各省、自治区发病数,详细信息见图1。2010年,羊痘在我国西北、华中和华南等地区广泛流行;而华东、华北、东北地区病例较为少见。对疫区动物的隔离、健康动物的免疫和血清学监测将是我国防控羊痘的主要措施。
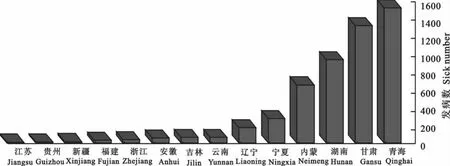
图1 2010年中国不同地区羊痘发病数Fig.1 The sick number of capripox in different regions of China
3 诊断技术
临床利用透射电镜检测CPV的典型形态,结合全身性痘病毒感染史,可以对羊痘做出快速诊断。然而,此方法对仪器要求较高,所以难以广泛应用。利用患病动物活体淋巴结与特异性免疫血清进行琼脂扩散试验(AGID)可检测其沉淀抗原,但特异性免疫血清在该方法中与副痘病毒有交叉反应,所以限制了AGID的使用,另外,此方法的敏感性与特异性都不甚理想。病毒中和试验(VNT)特异性较强,然而羊痘感染后主要引起细胞免疫,患病动物体内中和抗体水平相对较低,故VNT敏感性较差[9]。ELISA和PCR检测方法的敏感性、特异性和稳定性都较为理想,且操作方便,目前被广泛利用进行各种动物疫病的临床诊断,较多检测试剂盒现已商品化。目前,基于这两种诊断技术已建立了多种检测方法。
3.1 ELISA
相对于其他血清学检测方法,ELISA的敏感性特和异性较强,Rao等通过对健康和实验感染GPV羊的样品进行抗原检测,比较了抗原捕获ELISA(IC-ELISA)和对流免疫电泳(CIE)的敏感性和特异性,结果显示,IC-ELISA的相对特异性和敏感性分别为80%~100%和70%~86%,其敏感性优于CIE[10]。p32蛋白是CPV的囊膜蛋白,分子质量约为32ku,具有较强的免疫原性,可以诱导机体产生中和抗体。利用p32蛋白作为包被抗原建立的ELISA方法,其敏感性和特异性都较其他蛋白更为理想。Bhanot V等[11]利用毕赤酵母真核表达系统成功地表达了GPV p32蛋白,并利用其作为包被抗原建立了间接ELISA(i-ELISA)检测方法;结果显示,此方法与血清中和试验和全病毒i-ELISA相比,其相对特异性和敏感性分别为84.2%和94.2%~100%。另外,相对于原核表达系统,毕赤酵母真核表达系统所表达的p32蛋白与天然蛋白的空间构象更为相似,将其应用于i-ELISA将更有助于GPV血清流行病学调查。除了利用真核或原核表达系统表达p32结构蛋白,也可以通过人工合成一段具有免疫原性的肽段作为包被抗原构建i-ELISA检测方法。Tian H等[12]利用DNA Star软件设计并人工合成了两段特别的多肽段,两者分别为p32蛋白92~118和156~175残基片段,利用其作为包被抗原建立了i-ELISA诊断方法。通过20份阳性血清和10份阴性血清的临床检测试验,此方法敏感性和特异性都较为理想,且可大批量检测临床样品。
3.2 PCR
PCR可用来检测组织样品和细胞培养基中的CPV。传统血清学检测方法往往伴有交叉反应,由于PCR检测法仅仅基于病毒核酸扩增而不涉及血清学反应,所以相对于血清学检测方法有一定优势。Markoulatos P等[13]利用3对引物建立了一步法多重PCR检测方法,并利用其检测了绵羊皮肤组织中的SPV。结果表明,相对于单重PCR,此多重PCR敏感性和特异性相对更高,且方便快捷,从接受样品至报告检测结果不超过24h。口疮病毒(Orf virus,OV)属副痘病毒属成员,羊感染OV后临床表现与羊痘类似,Zheng M等[14]分别设计了2对针对CPV A29L基因和OV P55基因的特异性引物,建立了区分这两种病毒的双重PCR检测方法。试验证明,此方法敏感性与特异性都较为理想,对CPV和OV的最低检测限都为1pfu/反应。GPV与SPV进化关系相近,所以传统血清学检测方法难以区分二者,通过分析CPV中与痘苗病毒30ku RNA聚合酶亚单位基因同源的基因发现,在所有CPV分离株中,唯独SPV分离株的此同源基因缺失了21个核苷酸。基于此,Lamien C E等[15]设计了针对此同源基因的PCR检测方法,通过每个PCR扩增产物电泳条带的比较可以区分GPV与SPV。
荧光定量PCR(Fluorescent quantitative PCR,FQ-PCR)是近年来发展起来的一项新技术,较传统PCR敏感性更高,且能够定量检测核酸模板。Balinsky C A等[16]建立了基于TaqMan探针的FQPCR CPV检测方法。该方法可以检测血沉棕黄层、口鼻拭子、疮痂、皮肤病灶、肺部及淋巴结中的羊痘病原体;操作简便,单次样品检测时间不超过2 h。Balamurugan V 等[17]比较了 FQ-PCR 与 传统PCR的CPV检测效率,结果证明,两者对于病原体的检测都是特异性的,然而,与后者相比,前者更为快速与特异,且敏感性是后者的100倍,对于DNA的最低检测限为0.042pg/反应。FQ-PCR不仅可以实时定量检测病原体,而且还可以用来评估弱毒苗中的含毒量。Kallesh D J等[18]针对CPV保守的DNA pol基因建立了基于Taqman探针FQ-PCR,以此评估单价GPV弱毒苗或GPV与小反刍兽疫病毒(PPRV)二联弱毒苗中GPV含量。通过与疫苗产业中TCID50检测病毒的传统方法比较,该FQPCR可以作为一种补充方法应用于弱毒苗病毒量的测定。
4 疫苗
目前尚无羊痘特效治疗药物,疫苗免疫是最好的防控措施。某些CPV可作为疫苗株使用,例如0240肯尼亚绵羊和山羊痘株、绵羊用罗马尼亚株和RM-65株、山羊用Mysore株和Gorgan株等。采用0240株弱毒苗免疫羊后保护力可达1年以上,甚至终身保护。然而,由于CPV的免疫反应主要依赖于细胞免疫,而灭活苗诱导机体细胞免疫的能力较弱,所以灭活苗只能对羊群提供短暂保护[9]。所以,大多数国家采用弱毒苗防控羊痘,目前全球经批准上市的主要CPV疫苗的详细信息见表2。另外,除了传统疫苗,基因工程疫苗也正处在研发当中。例如,利用CPV作为痘病毒载体,基于基因工程技术将外源目的基因克隆至此载体而制备的新型疫苗可以产生针对两种疾病的双重保护。CPV毒力相关基因和决定宿主范围基因的鉴定及其特性的研究,将为全面理解宿主与病原之间的相互作用和基因工程疫苗的研发奠定基础[19]。
4.1 灭活苗
以组织培养细胞制备的灭活苗几乎为裸露的病毒颗粒,作为疫苗接种后不能诱导机体产生针对由膜包被的病毒颗粒的特异性免疫;另外,灭活苗诱导细胞免疫应答能力较弱,而CPV的免疫应答主要依赖细胞免疫[9]。所以,针对羊痘的灭活苗难以广泛应用,尽管如此,由于灭活苗不存在毒力返强现象,研究者也正致力于羊痘灭活苗的研发。Awad M等[20]采用SPV埃及株作为灭活疫苗株,经二乙烯亚胺(BEI)灭活,动物免疫试验,制备了羊痘灭活苗。结果表明,经20mL/L BEI灭活7h,病毒完全丧失毒力,将其制备疫苗免疫动物,采用VNT和ELISA检测到动物免疫1周后体内出现特异性抗体,且抗体水平可以维持至第4周。羔羊攻毒试验结果表明,该疫苗对羔羊的免疫保护可持续6个月。赵利平等将GPV GT4-STV42-56种毒在犊牛睾丸细胞上繁殖后收获毒液,用1mL/L甲醛使其灭活,加适量206佐剂制备了油佐剂灭活苗。将疫苗以不同剂量皮下免疫接种不同种群山羊;免疫接种21d后,用AV40强毒进行攻毒保护试验。结果表明,免疫剂量达0.5mL时,疫苗对内蒙绒山羊保护率为100%,广西黑山羊为80%[21]。尽管不同试验都证明了羊痘灭活苗可以诱导免疫保护,但保护期较弱毒苗短,所以在临床使用中受到限制。
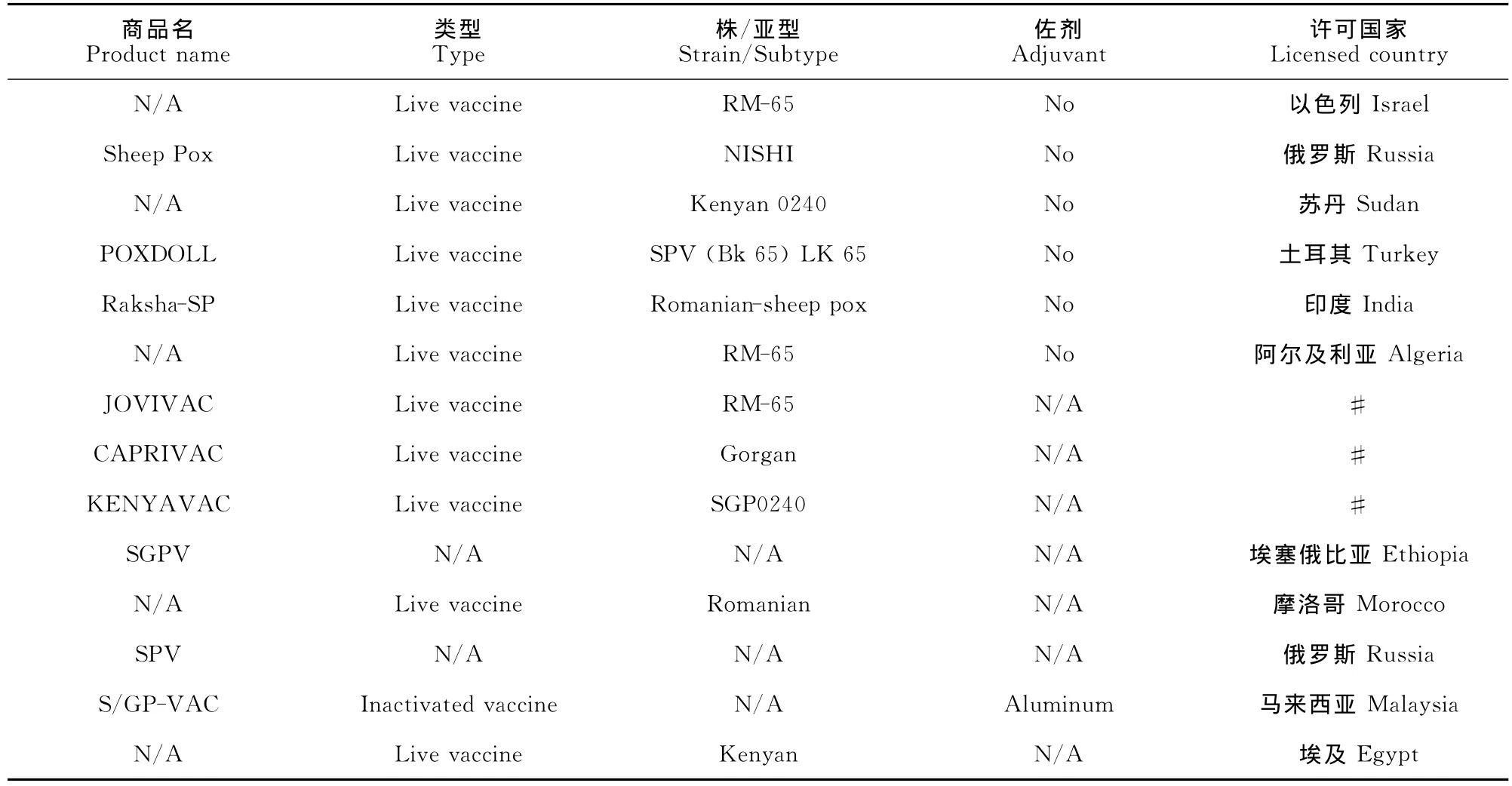
表2 全球经批准上市的CPV疫苗(参考爱荷华州立大学数据库)Table 2 Licensed CPV vaccines in the world(Referring to Iowa State University database)
4.2 弱毒苗
由表2可知,目前针对羊痘的防控,全球范围内应用最广泛的是弱毒苗。相对于灭活苗,弱毒苗带来的免疫保护期更长,而且不仅可以诱导体液免疫,更能诱导细胞免疫;因为CPV的免疫反应主要为细胞免疫,所以弱毒苗对羊痘的免疫更为重要。Bhanuprakash V等[22]采用在次级羔羊睾丸细胞经50次传代的SPV Ranipet株制备了SP弱毒苗,TCID50和RD50值分别为109.63/mL和109.51/mL;以102TCID50/只的剂量免疫接种660只绵羊,免疫接种后6个月期间随机挑选试验个体进行葡萄糖利用试验和血清中和试验。结果表明,该疫苗对免疫动物无毒副作用,并能较理想地诱导细胞免疫和体液免疫。除了羊痘,小反刍兽疫(PPR)同样对羊具有较大威胁,CPV与PPRV二联弱毒苗可以起到对二者的防控作用。为了评估此种疫苗的安全性与免疫原性,Hosamani M 等[23]以1mL/只的剂量(CPV和PPRV含量皆为103TCID50)免疫试验山羊,并采用ELISA在免疫后4周内检测动物机体中抗体水平;免疫28d后攻毒,经免疫的山羊可以抵抗CPV与PPRV,而对照组出现明显临床症状。试验表明,此二联苗的效力与安全性较高,且没有CPV与PPRV互相免疫干扰的现象。
4.3 基因工程苗
CPV基因组相对较大,可以作为载体表达多个外源基因,且处于CPV基因组非编码区的外源基因既不影响其复制也不会破坏CPV抗原蛋白的表达,所以其可作为其他病源基因的表达载体生产基因工程疫苗。OIE于2011年在其官方网站上宣布牛瘟(Rinderpest)已在全球范围内根除,这一结果得益于众疫病区多年来对牛瘟的有效防控。Romero C H等[24]将含有牛瘟病毒(RPV)RBOK疫苗株完整H基因的cDNA克隆,在痘苗晚期启动子P11的控制下,通过同源重组插入到CPV KS-1株的胸苷激酶基因中,从而构建了可以表达RPV H蛋白的重组痘病毒。这种重组病毒可在经免疫的牛体内诱导产生高水平的RPV中和抗体,经此CPV异源强毒株的人工感染试验证明,其可对实验动物产生免疫保护。Berhe等构建了一个含有PPRV F蛋白cDNA的重组CPV,并且快速有效地筛选了高纯度的重组病毒克隆。动物试验证明,其对山羊抗PPRV的最低免疫保护剂量为0.1pfu。除了痘病毒载体的应用,CPV还可以作为用以区分免疫动物和自然感染动物标记疫苗的载体。Chen W等[25]构建了两个分别表达PPRV H和F蛋白的重组CPV,即CPV-H和CPV-F。不同剂量的重组体免疫试验证明,前者诱导机体产生中和抗体的能力强于后者;重组病毒经皮下免疫便可产生高水平的PPRV中和抗体,经免疫的绵羊和山羊,80%以上体内的中和抗体可持续6个月;而且,CPV-H可以给山羊带来抗PPRV和CPV的双重保护。另外,由于重组疫苗只含有PPRV的一种糖蛋白,所以,如果伴有特异性血清学诊断方法,此重组疫苗可以作为标记疫苗应用于PPR流行病学调查。
5 结语
随着各国贸易的频繁往来,CPV现已不仅仅只流行于亚非各地,欧洲等地偶尔也有羊痘的暴发。各国建立规范的对外动物贸易制度并加强对羊痘的防控将对避免疫病大规模暴发起到关键作用。对CPV不同分离株抗原性和基因组特性的研究,尤其针对P32蛋白,将为研制新的血清学诊断试剂奠定良好的基础,快捷敏感的FQ-PCR将更多地应用于临床大批量的样品检测。目前至将来一段时间,预计弱毒苗还将是防控羊痘的首选疫苗制品。然而,安全有效的基因工程苗研制越来越引起人们的重视,尤其CPV作为载体,在重组痘病毒疫苗,特别是标记疫苗等领域具有广阔的应用前景。
[1]MacLachlan J N,Dubovi E J.Fenner's Veterinary Virology[M].4th ed.London:Elsevier,2011:157-160.
[2]Balinsky C A,Delhon G,Afonso C L,et al.Sheeppoxvirus kelch-like gene SPPV-019affects virus virulence[J].J Virol,2007,81(20):11392-11401.
[3]Bowden T R,Coupar B E,Babiuk S L,et al.Detection of antibodies specific for Sheep pox and goat pox viruses using recombinant capripoxvirus antigens in an indirect enzyme-linked immunosorbent assay[J].J Virol Meth,2009,161(1):19-29.
[4]陆承平.兽医微生物学 [M].北京:中国农业出版社,2001:464-465.
[5]Ramyar H.Studies on the immunogenic properties of tissueculture sheep pox virus[J].Zentralbl Veterinarmed B,1965,12(6):536-540.
[6]殷 震,刘景华.动物病毒学 [M].北京:科学出版社,1997:960-963.
[7]Tulman E R,Afonso C L,Lu Z,et al.The genomes ofSheep poxandGoatpoxviruses[J].J Virol,2002,76(12):6054-6061.
[8]Gubser C,Hue S,Kellam P,et al.Poxvirus genomes:aphylogenetic analysis[J].J Gen Virol,2004,85(Pt 1):105-117.
[9]OIE.哺乳动物、禽、蜜蜂A和B类疾病诊断试验和疫苗标准手册 [M].北京:中国农业科学技术出版社,2002:157.
[10]Rao T V,Malik P,Nandi S,et al.Evaluation of immunocapture ELISA for diagnosis of Goat pox[J].Acta Virol,1997,41(6):345-348.
[11]Bhanot V,Balamurugan V,Bhanuprakash V,et al.Expression of P32protein of Goat pox virus in Pichia pastoris and its potential use as a diagnostic antigen in ELISA [J].J Virol Meth,2009,162(1-2):251-257.
[12]Tian H,Chen Y,Wu J,et al.Serodiagnosis of Sheep pox and Goat pox using an indirect ELISA based on synthetic peptide targeting for the major antigen P32[J].Virol J,2010,7:245.
[13]Markoulatos P,Mangana-Vougiouka O,Koptopoulos G,et al.Detection of Sheep pox virus in skin biopsy samples by a multiplex polymerase chain reaction [J].J Virol Meth,2000,84(2):161-167.
[14]Zheng M,Liu Q,Jin N,et al.A duplex PCR assay for simultaneous detection and differentiation of Capripoxvirus and Orf virus[J].Mol Cell Prob,2007,21(4):276-281.
[15]Lamien C E,Le Goff C,Silber R,et al.Use of the Capripoxvirus homologue of Vaccinia virus 30kDa RNA polymerase subunit(RPO30)gene as a novel diagnostic and genotyping target:development of a classical PCR method to differ-entiate Goat poxvirus from Sheep pox virus[J].Vet Microbiol,2011,149(1-2):30-39.
[16]Balinsky C A,Delhon G,Smoliga G,et al.Rapid preclinical detection of Sheep pox virus by a real-time PCR assay[J].J Clin Microbiol,2008,46(2):438-442.
[17]Balamurugan V,Jayappa K D,Hosamani M,et al.Comparative efficacy of conventional and taqman polymerase chain reaction assays in the detection of capripoxviruses from clinical samples[J].J Vet Diagnostic Investig,2009,21(2):225-231.
[18]Kallesh D J,Hosamani M,Balamurugan V,et al.Quantitative PCR:aquality control assay for estimation of viable virus content in live attenuated Goat pox vaccine[J].Indian J Experimental Biol,2009,47(11):911-915.
[19]赵志荀,吴国华,颜新敏,等.羊痘病毒及其疫苗研究进展[J].动物医学进展,2010,31(4):77-81.
[20]Awad M,Michael A,Soliman S M,et al.Trials for preparation of inactivated Sheep pox vaccine using binary ethyleneimine[J].Egypt J Immunol,2003,10(2):67-72.
[21]赵利平,魏学峰,陈九连,等.山羊痘灭活疫苗免疫保护试验 [J].中国兽药杂志,2005(8):21-23.
[22]Bhanuprakash V,Indrani B K,Hegde R,et al.A classical live attenuated vaccine for sheep pox[J].Tropical Animal Health Production,2004,36(4):307-320.
[23]Hosamani M,Singh S K,Mondal B,et al.A bivalent vaccine against Goat pox and Peste des Petits ruminants induces protective immune response in goats[J].Vaccine,2006,24(35-36):6058-6064.
[24]Romero C H,Barrett T,Chamberlain R W,et al.Recombinant capripoxvirus expressing the hemagglutinin protein gene of rinderpest virus:protection of cattle against rinderpest and lumpy skin disease viruses[J].Virology,1994,204(1):425-429.
[25]Chen W,Hu S,Qu L,et al.A Goat pox virus-vectored peste-des-petits-ruminants vaccine induces long-lasting neutralization antibody to high levels in goats and sheep[J].Vaccine,2010,28(30):4742-4750.