一株鸭源大肠埃希菌强毒株的分离鉴定
张文波,冷 闯,邓舜洲*,蒋新华,余根莲
(1.江西农业大学动物科学技术学院,江西南昌 330045;2.南昌金牧动物保健服务有限公司,江西南昌 330013)
2010年9月初,江西某规模化鸭场的雏鸭突然发病,发病率高达100%,病死率40%左右。主要临床症状为嗜睡,共济失调,食欲减退或废绝,排黄绿色或恶臭稀粪,有的鸭迅速死亡。用磺胺和喹喏酮类药物效果不明显。剖检主要病理变化有肝周炎、纤维素性心包炎、脾脏呈紫黑色斑纹状、肺有淤血或水肿,腹水为淡黄色、肠道黏膜呈卡他性或坏死性炎症。实验室诊断为大肠埃希菌病,并分离到一株强毒力大肠埃希菌。
1 材料与方法
1.1 材料
1.1.1 病料来源 江西某养鸭场的病死鸭。
1.1.2 药敏纸片 (批号:20101006)和微量生化鉴定管(批号:20101102)均为杭州天和微生物试剂有限公司生产。
1.1.3 试验用动物 20日龄非免疫樱桃谷鸭购自南昌市某种鸭场;昆明系小鼠,体重15g左右,购自于南昌大学实验动物中心。
1.2 方法
1.2.1 病原菌的分离培养 在无菌条件下取送检病死鸭的肝脏、心脏,划线接种于兔血琼脂平板、普通琼脂平板和麦康凯平板,37℃培养12h,观察菌落形态、大小和颜色等,挑单个菌落进行革兰染色镜检,观察细菌形态特征。挑单个菌落分别接种于伊红美蓝琼脂平板和SS琼脂平板,37℃培养12h,观察细菌的培养特性。
1.2.2 生化试验 挑取分离菌纯培养物接种于普通肉汤培养基中,37℃、200r/min,振荡培养10h~12h。然后将培养的菌液接种于微量生化鉴定管,37℃培养24h后,观察结果。
1.2.3 动物试验 取培养的菌液进行细菌计数,并稀释到浓度为105cfu/mL,取0.2mL通过腹腔注射小鼠,同时用普通肉汤进行腹腔注射小鼠作正常对照;取分离菌培养液0.2mL皮下接种雏鸭,同时用普通肉汤皮下接种雏鸭作正常对照,观察实验动物的发病及死亡情况,并从死亡实验动物的肝脏和心脏中分离细菌。
1.2.4 药敏试验 用无菌棉签将培养的菌液均匀涂布于普通琼脂平板上,贴药敏纸片,37℃,培养24 h,测量抑菌圈的直径。判定标准参照文献[1]进行。
1.2.5 临床治疗 使用药敏试验筛选的高度敏感药物进行治疗,并采取消毒等综合防控措施,观察治疗效果。
2 结果
2.1 细菌的分离纯化
划线接种的平板,37℃培养12h。在血平板上形成圆形、稍凸、边缘整齐、灰白色、不透明的菌落,有明显的β溶血环;普通培养基上形成均一的菌落,呈中等大小、圆形、凸起、湿润、灰白色半透明、边缘整齐。革兰染色为阴性,散在或成对排列、两端钝圆的短杆菌。麦康凯培养基上形成红色、圆形隆起、湿润和边缘整齐的中等大小菌落。从麦康凯培养基上挑单个菌落接种于伊红美蓝平板上,可形成紫黑色带金属光泽的菌落。SS琼脂平板上形成红色的菌落。
2.2 生化试验结果
该分离菌株能发酵葡萄糖、麦芽糖、木糖、乳糖、棉子糖和山梨醇,产酸产气;鼠李糖、触酶和甲基红阳性;吲哚、H2S、枸橼酸盐、VP和尿素为阴性。符合大肠埃希菌的生化特征。结合分离菌的形态、培养特性及部分生物学性状,鉴定为大肠埃希菌。
2.3 动物试验结果
腹腔注射分离菌培养液的5只小鼠在12h内全部死亡;皮下注射分离菌培养液的5只雏鸭在16 h内全部死亡。剖检发现小鼠的心脏和肠道出血、肝上有针尖大小出血点、脾脏呈深黑色;雏鸭有肝周炎、心包积液、纤维素性渗出、肠道出血严重等病变。从死亡小鼠和雏鸭的心脏、肝脏以及腹水中分离细菌,细菌的形态等生物学特性,与从病死鸭肝脏和心脏中分离的细菌一致。普通肉汤对照组全部存活。
2.4 药物敏感试验结果
分离菌株对阿莫西林棒酸、头孢克洛、奈替米星和红霉素高度敏感,对呋喃唑酮、大观霉素、头孢噻吩、庆大霉素、氧氟沙星和氨苄西林中度敏感,对其他药物为低敏或耐药(表1)。
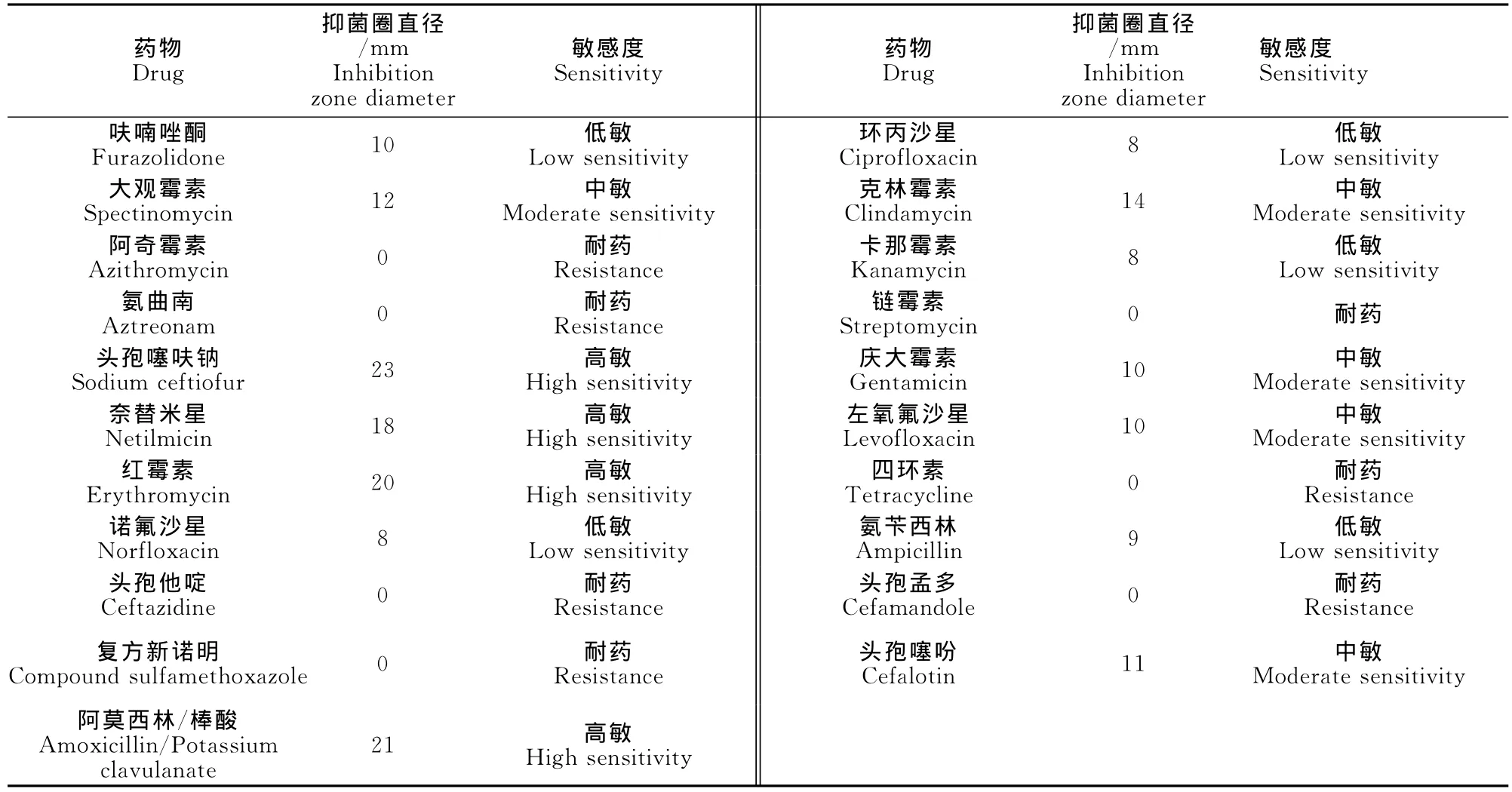
表1 药敏试验结果Table 1 The results of drug sensitive test of isolate strains
3 讨论
根据分离菌的培养特性、形态特征、生化试验结果,确定该分离菌为大肠埃希菌。分离的大肠埃希菌分别在12h致死小鼠和16h内致死雏鸭,死亡雏鸭的病理变化与自然感染死亡鸭的病理变化完全一致[2-3],且鸭场的发病率和死亡率均较高,表明本次分离菌是强致病性的大肠埃希菌。
药敏试验结果表明,分离菌对头孢噻呋钠、阿莫西林/棒酸、红霉素和奈替米星高度敏感,对大观霉素、庆大霉素、头孢噻吩、克林霉素和左氧氟沙星中度敏感,对其它药物均低敏或耐药。原因可能与这类药物在临床上应用不广泛、联合用药效果要优于单药等有关,与其他学者的研究结果相似[4-6]。根据药敏试验结果,在发病鸭场使用头孢噻呋钠进行治疗,连用3d,效果不明显。换用阿莫西林/棒酸配合大观霉素注射治疗,同时采取消毒、加强管理等综合防治措施,很快控制了疫情。
随着养鸭场抗生素使用的常态化,大肠埃希菌的耐药性也随之不断增强、变化;而且大肠埃希菌的血清型众多,交叉保护性差,疫苗免疫效果不佳,因此通过药敏试验筛选高敏药物是治疗和控制鸭大肠埃希菌病的有效途径之一[7]。但在临床上经常会出现临床治疗和药敏试验结果不相符的情况,其原因主要有:①体外和体内环境不同[8],体内某些细菌可以合成降解抗生素的酶,使抗生素失效,就会出现体外敏感而体内耐药的情况;②某些致病菌在体外培养时,因条件与体内不同,可能发生变异而产生耐药性或失去耐药性;③致病菌判断不正确,或者未分离到[9]。④药敏试验方法选择错误导致药敏试验结果不正确。例如根据CLSI药敏试验规范,非肠杆菌科革兰阴性杆菌除铜绿假单胞菌和不动杆菌可用K-B法外,假单胞菌属其他细菌、嗜麦芽窄食单胞菌和其他不发酵葡萄糖的革兰阴性杆菌的药敏试验均需用稀释法;⑤药敏纸片失效,造成假耐药情况。如放置时间过长、未按要求放置等;⑥临床用药剂量与药敏试验的实际剂量有较大差异[10];⑦临床上部分细菌是条件性病原菌,要有诱因才有可能致病,若单纯用药而未清除诱因,用药也可能无效。本研究在治疗过程中出现高敏药物头孢噻呋钠治疗无效,其原因有待于进一步研究。大肠埃希菌是一种条件性致病菌,只有当动物在饲养管理不当、应激、机体抵抗力降低时,才会引起较严重的病症,因此在养鸭场应在加强饲养管理,降低鸭群密度,及时消毒,做好生物安全措施、减少应激、及时隔离和淘汰病鸡等方面的工作,才能有效减少该病造成的经济损失。
[1]Clinical and laboratory standards institute(CLSI).Performance Standards for Antimicrobial Susceptibility Testing Twentieth;informational Supplement[S].Document M100-S20.Wayne,PA:Clinical and Laboratory Standards Institute,2010:59-123.
[2]李文杨,黄 瑜,施少华,等.我国部分地区致病性鸭大肠杆菌的分离及血清型鉴定[J].中国兽医杂志,2009,45(12):43-44.
[3]罗玲,艾地云,杨 峻,等.湖北省部分地区鸭致病性大肠杆菌的分离与血清型鉴定[J].中国家禽,2009,31(8):44-45.
[4]艾地云,邓均华,罗 玲,等.武汉地区鸭源致病性大肠杆菌体外耐药性测定[J].中国家禽,2008,30(20):47-49
[5]陈文静,韩先干,何 亮,等.鸭致病性大肠杆菌的分离鉴定及其生物学特性分析[J].中国动物传染病学报,2010,18(2):34-40.
[6]于学辉,黄 兰,杨晓农,等.98株鸭源致病性大肠杆菌氨基糖苷类耐药基因型与耐药表型的比较[J].畜牧兽医学报,2010,41(12):1568-1575.
[7]李必富,王远微,于学辉,等.鸭源大肠杆菌O46血清型分离株的主要生物学特性研究[J].西南民族大学学报:自然科学版,2011,37(2):238-241.
[8]刘 静,贺生中,陈 祥,等.依赖药敏试验治疗鸡大肠杆菌病的误区[J].黑龙江畜牧兽医,2010,14:98.
[9]德育慧,樊明春,王 枫.复方恩诺沙星可溶性粉对畜禽主要致病菌的体外抑菌效果[J].动物医学进展,2009,30(7):46-49.
[10]王 颖,赵秀华,李长华.细菌药敏试验的临床价值及局限性[J].医学检验与临床,2008,19(4):86-87.