广东省猪圆环病毒2型感染的血清学调查
徐廷川,王 衡,张得玉,张桂红
(华南农业大学兽医学院,广东广州 510642)
猪圆环病毒病是由猪圆环病毒2型(Porcine circovirus type 2,PCV-2)引起的单独或继发/混合感染其他致病微生物的一系列疾病的总称,包括断奶仔猪多系统衰弱综合征(Postweaning multisystemic wasting syndrome,PMWS)、新生仔猪先天性震颤(Congenital tremors,CT)、猪增生性坏死性间质性肺炎(Interstitial pneumonia,IP)以及怀孕母猪的繁殖障碍等[1]。PCV-2、猪繁殖与呼吸道综合征(Porcine reproductive and respiratory syndrome virus,PRRSV)和伪狂犬病病毒(Pseudorabies virus,PRV)的混合感染已经成为PMWS阳性猪的主要致病因素,以两病毒混合感染的比例很高,在德国高达75.9%,美国60%[2],中国30%左右[3]。近年来,该病的发生呈现上升趋势,在引起免疫抑制的同时,还容易继发、并发一系列疾病,给我国养猪业造成了相当大的经济损失,严重制约了养猪业的发展,已成为猪群的又一重要免疫抑制病[4]。为了解广东省猪PCV-2的感染及与PRV或PRRSV混合感染情况,在2007年—2011年,采用PCV-2ELISA诊断试剂盒对该地区猪血清PCV-2抗体进行了检测,并对该病毒与高致病性与低致病性PRRSV、PRV等混合感染情况进行了相关调查,旨在了解广东省PCV-2的感染情况,为广东省防控PCV-2的感染,促进养猪业的发展提供参考。
1 材料与方法
1.1 材料
1.1.1猪血清和病料样本收集 分别在江门、佛山、惠州、深圳、肇庆等地区随机选择15个猪场(均未免疫商品化猪圆环病毒疫苗),对选定的猪场采用分层随机抽样方法,按5%的比例随机采集不同年龄段的猪的血清。从猪耳静脉或前腔静脉采血,分离血清,4℃保存备用。采集送检疑似PCV-2猪的脾、肺、肾、肝、淋巴结等组织,研磨后,置-20℃保存备用。PCV-2、PRV、PRRSV阳性对照株由华南农业大学兽医学院传染病研究室分离并保存。
1.1.2 试剂盒 PCV-2抗体检测试剂盒购于武汉科前动物生物制品有限责任公司;gpI-PRV抗体检测试剂盒购于武汉科前动物生物制品有限责任公司;PRRSV抗体检测试剂盒购于北京IDEXX元亨生物科技有限公司。
1.1.3 主要试剂 DNA抽提试剂盒为上海生工生物工程技术服务有限公司产品;Trizol Reagent为Invitrogen公司产品;反转录酶AMV、RNA酶抑制剂(Ribonuclease inhibitor)、TaqTMDNA 聚合酶、dNTP Mixture(2.5and 10mmol/L)、DNA Marker DL 2 000均为宝生物工程(大连)有限公司产品;其他化学试剂,如氯仿、无水乙醇等均为国产分析纯。
1.2 方法
1.2.1 ELISA检测 将采集的各猪场的血清进行PCV-2抗体检测,检测PCV-2、PRV、PRRSV抗体具体操作及结果判定按说明书进行。
1.2.2 引物的设计与合成 根据已经发表PCV-2核苷酸全序列(AY188355)、PRRSV核苷酸全序列(AY032626)、PRV 核苷酸全序列(BK001744)分别设计一对特异性引物[5-7](表1)。
1.2.3 抗原检测 送检病料研磨后按上海生工生物工程技术服务有限公司试剂盒说明书提取病毒DNA,参照Invitrogen公司的Trizol试剂说明书提取病毒RNA。
应用相应的 PCV-2、PRV、PRRSV 引物进行PCR扩增。采用25μL体系:10×PCR buffer(Mg2+Plus)2.5μL;dNTP(2.5mmol/L)2.5μL;上、下游引物(25pmol/μL)各0.25μL,TaqTM DNA 聚合酶0.25μL,DNA/cDNA 2μL,灭菌双蒸水17.25 μL。PCV-2PCR扩增条件为:95℃3min后,按94℃45s,54℃40s,72℃1min,共进行30个循环,最后72℃延伸10min;PRV PCR扩增条件为:95℃4 min后,按94℃40s,53℃40s,72℃1min,共进行30个循环,最后72℃延伸10min;PRRSV PCR扩增条件为:94℃5min后,按94℃45s,50℃30s,72℃50min,共进行35个循环,最后72℃延伸10min。取PCR产物5μL,用10g/L琼脂糖凝胶电泳进行检测。
1.2.4 统计分析 材料中所有数据均用SPSS 10.0进行统计分析。不同生长阶段、不同地区PCV-2阳性率均采用卡方检验,PCV-2感染与PRRSV和PRV免疫应答率进行相关性分析,PCV-2感染率与PRRSV感染率之间的相关性进行分析。
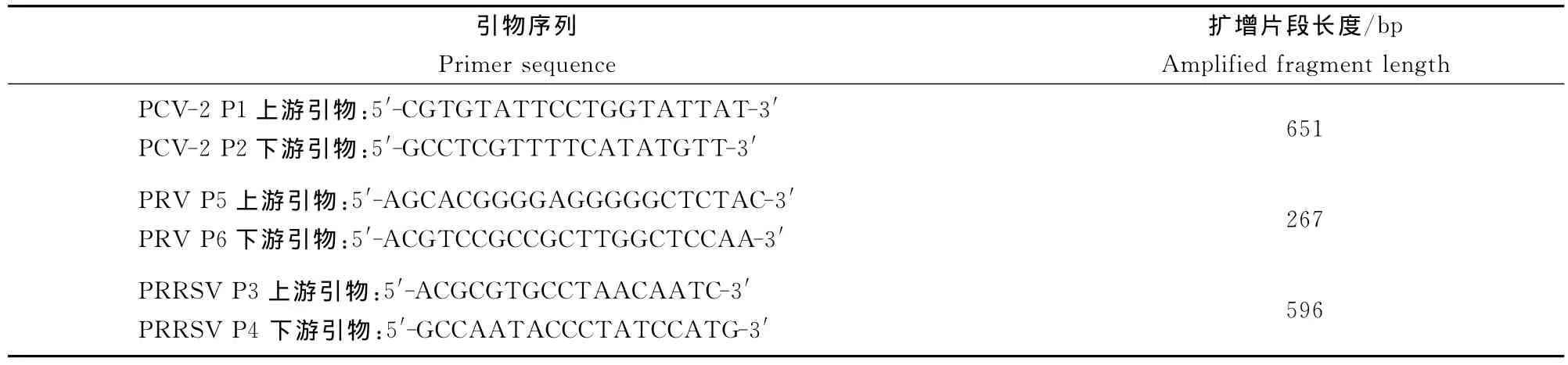
表1 PCV-2、PRRSV和PRV引物序列Table 1 Primer sequence of PCV-2、PRRSV and PRV
2 结果
2.1 猪场及猪群的PCV-2阳性率
对来自广东省15个猪场2007年—2011年764份血清样品进行分析发现,所有被检测猪场均存在PCV-2感染,猪场的抗体阳性率为100%(15/15),全部猪的PCV-2平均抗体阳性率为61.91%(473/764)(表2)。
2.2 不同年龄段猪的PCV-2抗体阳性率
种公猪的PCV-2抗体阳性率为70.97%(22/31),经产母猪的抗体阳性率为67.29%(72/l07),后备母猪的抗体阳性率为64.81%(35/54),断奶仔猪的抗体阳性率为59.52%(322/541)。对种公猪、经产母猪和断奶仔猪进行卡方分析,发现不同生长阶段猪的PCV-2抗体阳性率差异极显著(P<0.01)。进行趋势卡方检验发现PCV-2的抗体阳性率随着年龄增长而升高,并且相关性显著(P<0.01)(表3)。
2.3 部分猪场PRV和PRRSV抗体检测结果
PRV检测是采用PRV gpI抗体检测试剂盒,可以区分野毒感染和疫苗免疫抗体。由结果可知,PCV-2的感染率和PRV的感染率息息相关,不仅能引起猪繁殖障碍性疾病,同时也是引起猪呼吸道疾病综合征的主要原发病因,PCV-2阳性率高的猪场,PRV的阳性率也很高。PCV-2阳性的猪群PRRSV抗体阳性率也很高,这可能与猪场主动免疫有关,也有可能是猪场曾经或正在感染PRRSV(表4)。
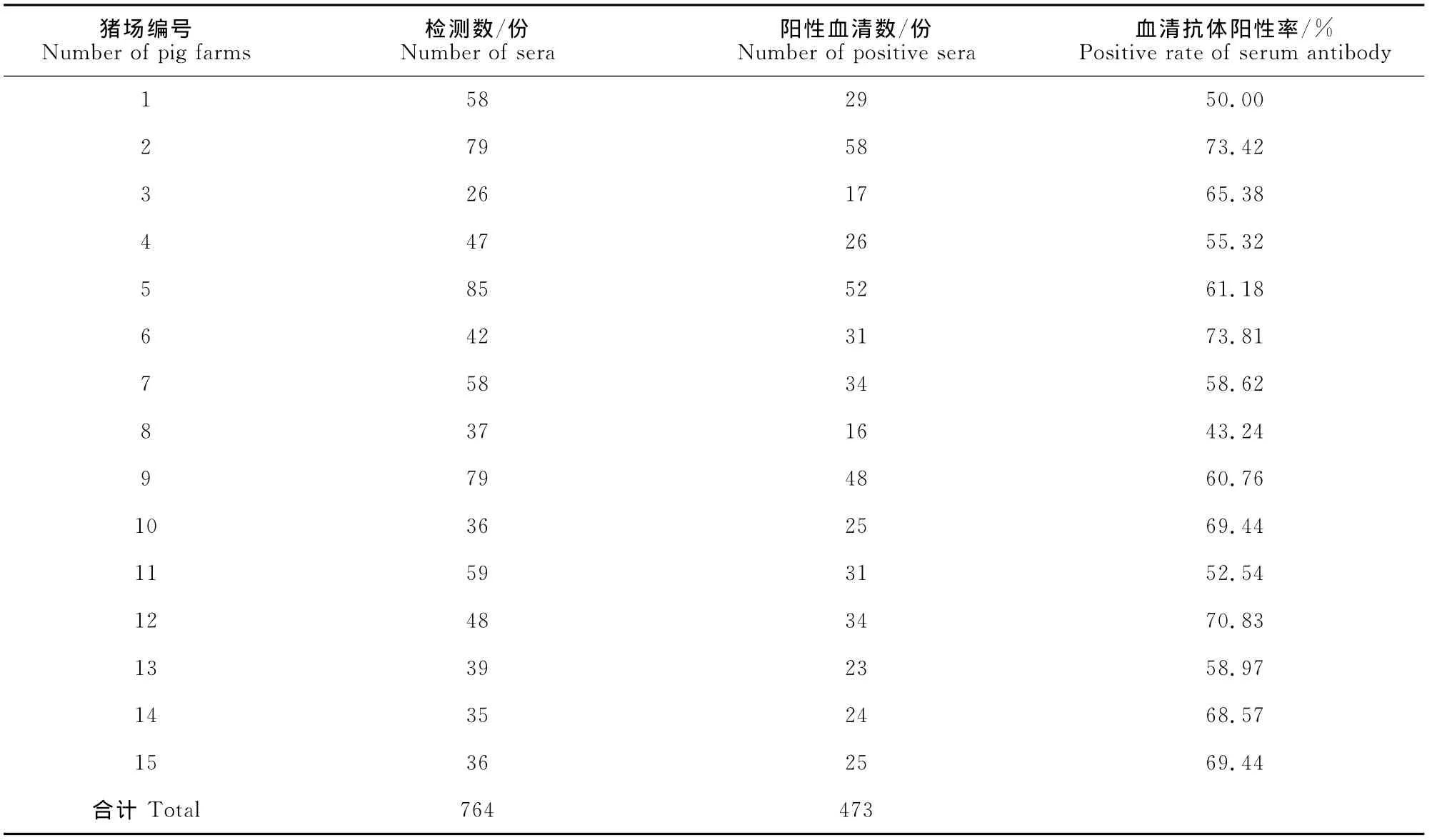
表2 不同猪场猪群的PCV-2抗体检测Table 2 Antibody positive rate of different pig farms
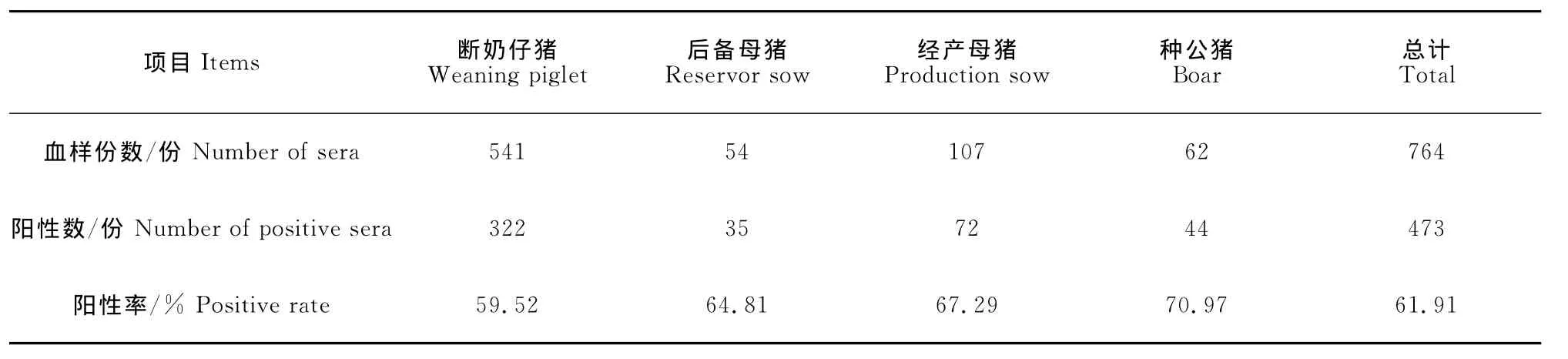
表3 不同生长阶段猪的PCV-2抗体检测Table 3 Detection results of PCV-2antibody from different growth phases of pigs
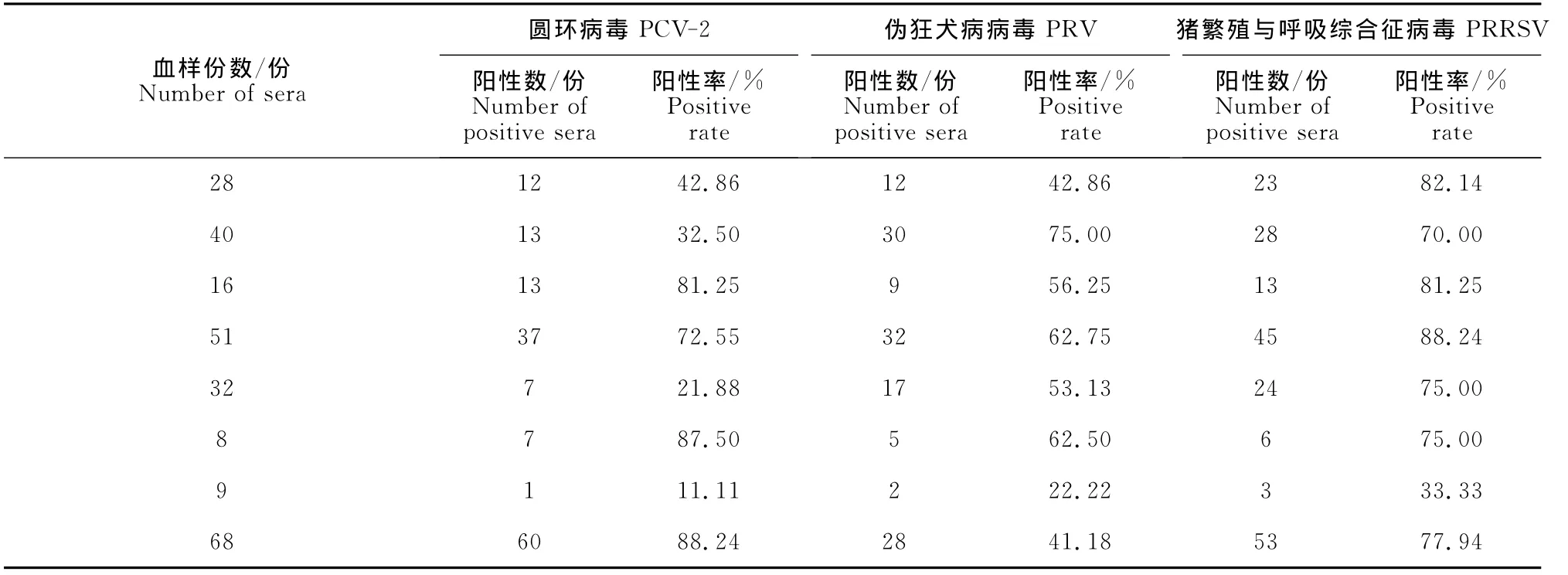
表4 部分猪场PRV和PRRSV抗体检测Table 4 Detection results of PRV and PRRSV antibodies from part of pig farms
2.4 部分猪场PCV-2、PRV和PRRSV检测结果
PCV-2、PRV、PRRSV 病原检测采 用特异性PCR方法,结果见表5。由检测结果可见,总共检测猪头数为238头,其中PCV-2阳性率为75.21%(179/238),与 PRV 混合感染阳性率为14.71%(35/238),与 PRRSV 混合感染阳性率为47.48%(113/238),PCV2、PRRSV 和 PRV 三者混合感染的阳性率为8.82%(21/238)。PRRSV 阳性中71头是变异株感染,变异株占PRRSV阳性感染的62.83%(71/113)。

表5 部分猪场PCV-2、PRV和PRRSV病原检测Table 5 Detection results of in PCV-2,PRV and PRRSV in part of pig farms
2.5 PCV-2、PRV、PRRSV扩增结果
从2007年-2011年采集的部分组织样品中检测PCV-2、PRRSV、PRV,其PCR扩增片段大小分别为651、596、267bp(图1),与预期结果相符。
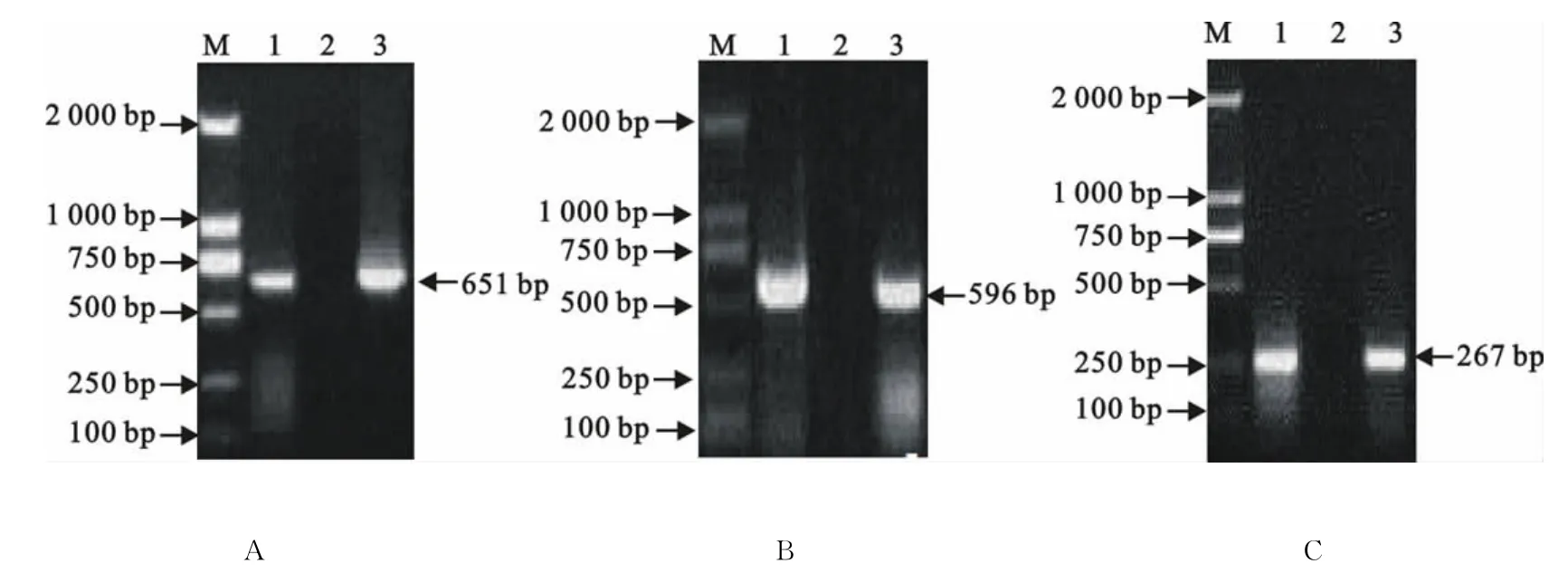
图1 部分样品PCV-2(A)、PRRSV(B)、PRV(C)电泳图Fig.1 Electrophoresis of PCV-2(A)、PRRSV(B),PRV(C)PCR products in part of samples
3 讨论
全世界许多国家和地区的猪群中都存在着PCV-2,但其流行情况不尽相同。此次检测的我国广东省15个猪群,既有国外引进的纯种猪,也有国内种猪;既有断奶仔猪,又有后备母猪、经产母猪和种公猪,因而具有一定代表性。本研究中被检测猪场均存在PCV-2感染,PCV-2的总抗体阳性率为61.91%(473/764),这与郎洪武等[8]报道的全国7个养猪大省42.9%的总阳性率相比,要高出19个百分点;较赵东升等[9]报道的全国(2002年-2007年)PCV-2血清抗体总阳性的平均水平38.47%要高出23.4个百分点。表明广东被调查地区的PCV-2感染已经较普遍,可能与引种不规范、饲养管理水平低下等方面原因有关,需要引起高度重视。
调查结果表明,受检猪群断奶仔猪、后备母猪、经产母猪和种公猪的PCV-2感染阳性率较高。由此推测,猪群中PCV-2感染比例随着猪生长日龄的增加而升高,与郎洪武等[8,10-11]报道的结果相似。
近年来,随着规模化养猪的不断发展,在猪群中存在PCV-2、PRRSV、PRV及猪附红细胞体等病原的感染,且混合感染比较普遍,对养猪业造成的危害正日益加剧[12-13]。本研究对所有 PCV-2抗体阳性血清样品与PRV及PRRSV混合感染的调查发现,存在PRRSV(47.48%)、PRV(14.71%),这与万根等[14-15]报道的 PCV-2抗体阳性率均不同程度地存在PRRSV(43.75%)、PRV(17%~19%)相一致,其相关性有待于进一步研究。
本研究通过对来自广东省的猪血清样本和病料样品进行PCV-2抗体和其他病原混合感染的检测,系统分析了PCV-2在猪群中的感染及流行规律,为开展PCV-2所致疾病的诊断与防控奠定了基础。
[1]Chae C.A review of porcine circovirus 2-associated syndromes and diseases[J].Vet J,2005,169(3):326-336.
[2]Krakowka S,Ellis J A,Neilly F,et al.Immunologic feature of porcine circovirus type 2infection[J].Viral Immunol,2002,15:567-582.
[3]王天户,娄中子,刘思当.猪PRRSV单独感染及与PCV2混合感染的免疫病理学研究[J].西南农业学报,2008,21(1):187-190.
[4]Schibahara G W,Kiupel M ,Mittal S K.Tissue distribution and genetic typing of porcine circoviruses in pigs with naturally occurring congenital tremors[J].J Vet Diagn Invest,2001,13(1):57-62.
[5]Fernandez J,Navasa M,Gomez J,et al.Bacterial infections in cirrhosis:Epidemiological changes with invasive procedures and norfloxacin prophylaxis[J].Hepatology,2002,35(1):140-148.
[6]魏 宏,林锋强.猪繁殖障碍与呼吸道综合征病毒福州株ORF2-7基因结构分析[J].中国畜牧兽医,2007,34(1):82-85.
[7]Chiou M T,Yang C Y,Chang T C,et al.Shedding pattern and serological profile of porcine circovirus type 2infection in cesarean-derived,colostrum-deprived and farm-raised pigs[J].J Vet Med Sci,2011,73(4):521-525.
[8]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[9]赵东升,刘有昌,安福生,等.近年来我国猪圆环病毒病的流行状况及分析[J].养猪,2009,(1):57-59.
[10]吴 瑗,王燕丽,李君荣.用ELISA法对金华地区猪圆环病毒的血清学调查[J].黑龙江畜牧兽医,2011(9):117-118.
[11]薛 霞,孙泉云,沈 悦,等.上海市规模化猪场猪圆环病毒2型血清学调查[J].动物医学进展,2006,27(8):102-104.
[12]Opriessnig T,Meng X J,Halbur P G.Porcine circovirus type 2-associated disease update on current terminology,clinical manifestations,pathogenesis,diagnosis and intervention strategies[J].Vet Diagn Invest,2007,19(9):591-615.
[13]蒋大良,余兴龙.猪圆环病毒2型致病机制研究进展[J].动物医学进展,2009,30(4):77-82.
[14]万 根,陶清松,龚国建,等."猪高热病"中猪繁殖与呼吸综合征病毒和猪圆环病毒Ⅱ型的检测分析[J].上海畜牧兽医通讯,2010(5):5-7
[15]戴爱玲,李晓华,黄思琼,等.福建省龙岩市规模化猪场伪狂犬野毒感染的血清学调查[J].龙岩学院学报,2011,29(2):79-82.