八肽胆囊收缩素通过p38 MAPK通路抑制LPS诱导的RAW264.7细胞IL-1β表达
倪志宇,丛 斌,董 玫,马春玲,李淑瑾,付丽红,张晓静,文 迪,徐之璐
(河北医科大学基础医学院法医学系,河北省法医学重点实验室,河北石家庄 050017)
丝裂原活化蛋白激酶(mitogen-activated proteinkinase,MAPK)是介导细胞反应的重要信号系统,参与细胞增殖、分化和凋亡等生理及病理过程,p38 MAPK是控制炎症反应最主要的MAPK家族成员之一[1]。在许多重症疾病如脓毒症、ARDS、严重烧伤、急性胰腺炎中均可检测到p38 MAPK的激活,大量研究表明阻断p38级联能减轻炎症反应[2]。
八肽胆囊收缩素(cholecystokinin octapeptide,CCK-8)属小分子肽类物质,参与调节中枢神经、内分泌、免疫等多系统机能活动。研究表明,CCK-8具有抗内毒素休克(endotoxin shock,ES)作用。在ES大鼠肺组织及大鼠肺间质巨噬细胞(pulmonary interstitial macrophages,PIMs),CCK-8 可通过激活cAMP-PKA 信号通路[3],抑制 PKC 通路[4-5]而抑制NF-κB 的活性[6],从而抑制炎症介质的表达[7],发挥抗ES作用。但CCK-8是否通过p38 MAPK通路调控炎症反应尚未见报道。本研究将观察CCK-8对LPS诱导RAW264.7细胞 IL-1β表达的影响及p38 MAPK在CCK-8调控LPS诱导IL-1β表达中的作用,以进一步阐明CCK-8的抗炎作用机制。
1 材料与方法
1.1材料RAW264.7细胞(同济医科大学)、大肠杆菌脂多糖(LPS E.Coli 0111:B4)、八肽胆囊收缩素、p38 MAPK特异性抑制剂SB203580(美国Sigma公司);小鼠单克隆磷酸化p38抗体(美国Santa Cruz公司);HRP-羊抗小鼠IgG(北京中山公司);小鼠IL-1β ELISA Kit(法国Diaclone公司);TRIzol(美国Invitrogen公司);AMV逆转录酶(美国Promega公司);Taq DNA聚合酶(上海Sangon公司)。
1.2细胞培养及分组RAW264.7细胞在含10%胎牛血清的RPMI 1640培养基中培养,细胞生长至对数生长期时,调整细胞浓度为每瓶1×107细胞,加入无血清RPMI 1640培养基及不同处理因素,孵育细胞。分组:① LPS诱导RAW264.7细胞IL-1β表达高峰的时间点:细胞培养基中加入LPS(1 mg·L-1),分别孵育不同时间(0、3、6、12、24 h);②不同浓度CCK-8对LPS诱导RAW264.7细胞IL-1β表达及p38 MAPK活化的影响:对照组:细胞培养基中加入与实验组等体积的生理盐水;LPS组:细胞培养基中加入LPS(1 mg·L-1);LPS+CCK-8组:细胞培养基中先加入 CCK-8(10-10、10-8、10-6mol·L-1),孵育10 min 后加入 LPS(1 mg·L-1);LPS+SB203580组:细胞培养基中加入 SB203580(10 μmol·L-1),孵育30 min 后加入 LPS(1 mg·L-1);LPS+SB203580+CCK-8组:细胞培养基中加入SB203580(10 μmol·L-1),孵育 30 min 后加入CCK-8(10-8mol·L-1),孵育 10 min 后加入 LPS(1 mg·L-1);CCK-8组:细胞培养基中加入 CCK-8(10-8mol·L-1);SB203580 组:细胞培养基中加入SB203580(10 μmol·L-1);CCK-8+SB 组:细胞培养基中加入 SB203580(10 μmol·L-1),孵育 30 min后加入CCK-8(10-8mol·L-1)。以上各组分别孵育不同时间后检测细胞IL-1β(6 h)、IL-1β mRNA(3 h)、p38 MAPK(30 min)的表达。
1.3ELISA法检测IL-1β的表达使用ELISA试剂盒分析细胞培养上清中IL-1β浓度。
1.4RT-PCR法检测IL-1βmRNA表达利用TRIzol提取细胞总RNA。取4.0 μg总RNA,65℃变性5 min,经AMV逆转录酶42℃逆转录30 min,合成cDNA。取5 μl cDNA产物,依次加入10×PCR缓冲液,上、下游引物 50 pmol,dNTP 0.2 mmol·L-1,MgCl22.0 mmol·L-1,Taq DNA polymerase 1 U,以下列条件进行扩增:94℃ 3 min;94℃ 45 s;52℃ 45 s(IL-1β),55℃ 45 s(β-actin);72℃ 45 s。进行30次循环后进一步延伸72℃ 5 min。扩增产物经1.8%琼脂糖凝胶电泳。引物由上海生工公司合成。序列如下:IL-1β(上游5'-GCTTCAGGCAGGCAGTAT-3',下 游 5'-ACAAACCGCTTTTCCATCT-3',扩增产物475 bp),β-actin(上游5'-CTGTCCCTGTATGCCTCT-3',下游 5'-ATGTCACGCACGATTTCC-3',扩增产物218 bp)。用Gel-pro凝胶分析软件对电泳谱带进行半定量分析,用任意单位(AU)表示凝胶谱带的面积×荧光强度值,各细胞因子与β-actin的AU比值代表各mRNA相对表达水平。
1.5Western blot法检测p-p38 MAPK表达将各组细胞提取蛋白质并进行定量后,电印迹转移法将凝胶内的蛋白转至硝酸纤维素膜。加入p-p38小鼠单克隆抗体(稀释度1∶80),4℃孵育过夜,TBS洗膜3次,加入 HRP标记的二抗(稀释度1∶1 000),37℃孵育1 h,TBS洗膜后,化学发光法显色。使用成像分析系统对显色条带进行光密度分析。
1.6统计学分析用SPSS统计分析软件进行统计学分析。数据用±s表示,各组均数的比较行单因素方差分析(ANOVA),用最小显著差法(least significant difference,LSD)作两两比较。
2 结果
2.1LPS诱导RAW264.7细胞IL-1β表达高峰的时间点RAW264.7细胞mRNA水平及细胞培养上清中IL-1β含量随LPS刺激时间的延长而升高,分别于LPS刺激后3 h及6 h达到高峰,与其他时间点相比差异均有显著性(P<0.01,P<0.05),见Tab 1,Fig 1。
Tab 1 The production of IL-1β in RAW264.7 cells induced by LPS for different time(±s,n=3)
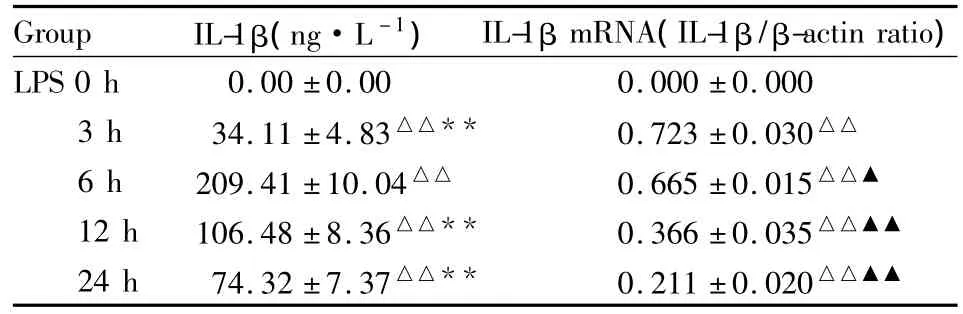
Tab 1 The production of IL-1β in RAW264.7 cells induced by LPS for different time(±s,n=3)
△△P<0.01 vs LPS 0 h;**P <0.01 vs LPS 6 h;▲P <0.05 ,▲▲P<0.01 vs LPS 3 h
Group IL-1β(ng·L-1)IL-1β mRNA(IL-1β/β-actin ratio)LPS 0 h 0.00 ±0.00 0.000 ±0.000 3 h 34.11 ±4.83△△** 0.723 ±0.030△△6 h 209.41 ±10.04△△ 0.665 ±0.015△△▲12 h 106.48 ±8.36△△** 0.366 ±0.035△△▲▲24 h 74.32 ±7.37△△** 0.211 ±0.020△△▲▲

Fig 1 The expression of LPS-induced IL-1β mRNA in RAW264.7 cells for different time
2.2不同剂量CCK-8对LPS诱导RAW264.7细胞IL-1β表达的影响1 mg·L-1LPS孵育RAW264.7细胞6 h(3 h),细胞上清中IL-1β含量(细胞IL-1β mRNA水平)明显高于对照组(P<0.01)。10-10mol·L-1CCK-8 对 LPS诱导的 IL-1β生成无影响,10-8、10-6mol·L-1CCK-8 可明显抑制LPS诱导的IL-1β生成,和LPS组相比抑制率分别为 50.7%、82.2%(IL-1β含量)及 50.5%、72.5%(IL-1β mRNA)(P<0.01),见 Tab 2,Fig 2。
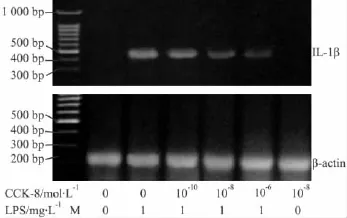
Fig 2 Effects of CCK-8 on LPS-induced IL-1βmRNA expression in RAW264.7 cells
Tab 2 Effects of CCK-8 on LPS-induced IL-1β production and p-p38 MAPK expression in RAW264.7 cells(±s,n=3)

Tab 2 Effects of CCK-8 on LPS-induced IL-1β production and p-p38 MAPK expression in RAW264.7 cells(±s,n=3)
**P<0.01 vs control;▲P>0.05,▲▲P<0.01 vs LPS
Group IL-1β(ng·L -1)IL-1β mRNA(IL-1β/β-actin ratio)p-p38 MAPK(p-p38 MAPK/β-actin ratio)Control 0.00 ±0.00 0.000 ±0.000 0.114 ±0.021 LPS 209.41 ±10.04** 0.728 ±0.044** 1.177 ±0.090**LPS+CCK-8 10-10mol·L-1 202.98 ±9.65**▲ 0.718 ±0.044**▲ 1.194 ±0.061**▲LPS+CCK-8 10-8mol·L-1 103.26±12.14**▲▲ 0.360±0.040**▲▲ 0.633 ±0.606**▲▲LPS+CCK-8 10-6mol·L-1 37.32±7.37**▲▲ 0.200±0.013**▲▲ 0.320 ±0.026**▲▲CCK-8 10 -8mol·L -10.00 ±0.00 0.000 ±0.000 0.083 ±0.017
2.3不同剂量CCK-8对LPS诱导RAW264.7细胞p38 MAPK活性的影响对照组及CCK-8组RAW264.7细胞p-p38 MAPK水平较低,LPS刺激30 min可使细胞 p-p38 MAPK水平明显升高,较对照组相比增加了约9.32倍(P<0.01)。10-10mol·L-1CCK-8对LPS诱导的 p-p38 MAPK水平无明显影响,10-8、10-6mol·L-1CCK-8 剂量依赖性地抑制LPS诱导的p-p38 MAPK水平,抑制率分别为44.1%和71.9%(P<0.01),但 p-p38 MAPK水平仍高于对照组(P<0.01),见Tab 2,Fig 3。

Fig 3 Effects of CCK-8 on p-p38 MAPK expression in LPS-induced RAW264.7 cells
2.4p38 MAPK在CCK-8调控LPS诱导RAW264.7细胞IL-1β表达中的作用对照组、CCK-8组、SB组及CCK-8+SB组均未检测到IL-1β及其mRNA的表达。1 mg·L-1LPS诱导了IL-1β及其 mRNA 的表达(P<0.01)。10-8mol·L-1CCK-8抑制了LPS诱导的IL-1β及其mRNA表达,抑制率为分别为50.6%和47.7%(P<0.01)。10 μmol·L-1SB203580抑制了 IL-1β 及其 mRNA表达,抑制率分别为57.3%及56.7%(P<0.01)。10 μmol·L-1SB203580 与 10-8mol·L-1CCK-8 共同作用进一步抑制了LPS诱导的IL-1β及其mRNA表达,抑制率分别77.6%和78.4%(P<0.01vsLPS组、LPS+SB 组、LPS+CCK-8 组),见 Tab 3,Fig 4。
3 讨论
在参与炎症反应的众多介质中,最有影响的是TNF-α、IL-1β等,与内毒素休克发病和死亡的关系也最为密切[7-8]。本研究发现,LPS刺激可迅速诱导RAW264.7细胞IL-1β及其mRNA的表达,而预先给予CCK-8可抑制LPS诱导的RAW264.7细胞IL-1β及其mRNA的表达。说明CCK-8通过抑制促炎性细胞因子的表达参与机体抗炎反应过程,且CCK-8对细胞因子生成的调控作用发生在转录水平。这与本室报道CCK-8可抑制LPS诱导的大鼠PIMs TNF-α[6]、IL-1β[7]表达的结果一致。
Tab 3 Effects of CCK-8 and SB203580 co-incubation on IL-1β production in LPS-induced RAW264.7 cells(±s,n=3)

Tab 3 Effects of CCK-8 and SB203580 co-incubation on IL-1β production in LPS-induced RAW264.7 cells(±s,n=3)
**P<0.01 vs control;▲▲P<0.01 vs LPS;△△P<0.01 vs LPS+CCK-8 and LPS+SB
0.00 ±0.00 0.000 ±0.000

Fig 4 Effects of CCK-8 and SB203580 co-incubation on IL-1β mRNA expression in LPS-induced RAW264.7 cells
MAPK是介导细胞外信号引起细胞核反应的极其重要的信号系统,已证明在哺乳动物中存在4个MAPK成员,即 ERK、JNK/SAPK、p38和 ERK5/BMK1等MAPK亚族,其中p38 MAPK通路主要对炎性细胞因子和多种类型的细胞应激信号进行转导,大量研究表明阻断 p38级联能减轻炎症反应[1-2]。本研究发现,LPS 迅速诱导 RAW264.7 细胞p38 MAPK的激活,而CCK-8则浓度依赖性地抑制LPS诱导的p38 MAPK的活化,说明CCK-8发挥抗炎作用是通过抑制p38 MAPK的活化完成的。
为进一步明确p38 MAPK在CCK-8调控LPS诱导的RAW264.7细胞IL-1β表达中的作用,我们又观察了p38 MAPK特异性抑制剂 SB203580和CCK-8共同作用对LPS诱导的RAW264.7细胞 IL-1β 表达的影响。研究发现,10 μmol·L-1SB203580抑制了LPS诱导的p38 MAPK的活化,抑制率为87.2%,接近至未刺激水平;但10 μmol·L-1SB203580仅抑制了约57.3%IL-1β及56.7%IL-1β mRNA表达,说明还有p38 MAPK之外的其他通路调控IL-1β的表达,这与多数学者证实的多条通路调控IL-1β表达的研究结果一致。而加入CCK-8后进一步抑制了 LPS诱导的IL-1β及其IL-1β mRNA的表达(分别抑制了约77.6%及78.4%),说明CCK-8通过抑制p38 MAPK的激活以及p38 MAPK以外的其他通路抑制IL-1β的表达,参与炎症反应。我室多项研究证实,CCK-8可抑制 ES大鼠 PIMs CD14[9]及TLR4[10]的表达、抑制 PKC 活性[5]及 NF-κB[6]、AP-1(数据未发表)的DNA结合活性,从而抑制TNF-α和IL-1β的表达而发挥抗ES作用。已知在LPS诱导的炎症反应中,LPS与其受体CD14、TLR4结合,将LPS信号由细胞外传导至细胞内,通过一系列信号通路使NF-κB、AP-1等转录因子激活,诱导炎症介质的表达[11]。而CCK-8则可通过抑制信号通路中 CD14、TLR4、PKC、p38 MAPK、NF-κB、AP-1 等多层次、多靶点调控TNF-α、IL-1β等炎性介质的表达,从而发挥抗炎作用。提示我们在一些急慢性炎症相关性疾病的治疗中,CCK-8可能是一种潜在有效的治疗因子。
以往有关CCK-8与p38 MAPK的研究多针对急性胰腺炎,并证实,CCK-8通过激活p38 MAPK参与急性胰腺炎的发病过程。但CCK的信号转导机制具有细胞及组织特异性。Meng等[12]发现,CCK-8可激活ES大鼠肺组织及脾组织p38 MAPK并抑制了肺组织TNF-α水平。本室已证实,CCK-8可抑制TNF-α诱导的滑膜细胞株RSC-364 p38 MAPK活性[13]。因此,CCK-8在不同组织和细胞对 p38 MAPK的调控尚需进一步研究。
[1]Keshet Y,Seger R.The MAP kinase signaling cascades:a system of hundreds of components regulates a diverse array of physiological functions[J].Methods Mol Biol,2010,V661N:3 -38.
[2]Chen S R,Xu X Z,Wang Y H,et al.Icariin Derivative inhibits inflammation through suppression of p38 mitogen-activated protein kinase and nuclear factor-κB pathways[J].Biol Phar Bull,2010,33(8):1307-13.
[3]高维娟,许顺江,丛 斌,等.CCK-8对大鼠肺间质巨噬细胞cAMP-PKA信号通路的激活作用[J].中国药理学通报,2007,23(3):321 -6.
[3]Gao W J,Xu S J,Cong B,et al.Activation of cAMP-PKA signal pathway by CCK-8 in rat pulmonary interstitial macrophages[J].Chin Pharmacol Bull,2007,23(3):321 -6.
[4]高维娟,许顺江,丛 斌,等.CCK-8抗炎作用中DAG-PKC信号通路对cAMP-PKA信号通路的影响[J].中国药理学通报,2008,24(9):1156-9.
[4]Gao W J,Xu S J,Cong B,et al.Effects of DAG-PKC signaling pathway on cAMP-PKA signaling pathway in anti-inflammatory effects of CCK-8[J].Chin Pharmacol Bull,2008,24(9):1156 -9.
[5]Xu S J,Gao W J,Cong B,et al.Effect of cholecystokinin octapeptide on diacylglycerol-PKC signaling pathway in rat pulmonary interstitial macrophages stimulated by lipopolysaccharide[J].Acta Pharmacol Sin,2005,26(12):1497 -504.
[6]李淑瑾,姚玉霞,朱桂军,等.八肽胆囊收缩素抑制脂多糖诱导的大鼠肺间质巨噬细胞TNF-α及NF-κB活性[J].中国病理生理杂志,2004,20(8):635-8.
[6]Li S J,Yao Y X,Zhu G J,et al.Cholecystokinin octapeptide inhibits tumor necrosis factor-α transcription and nuclear factor-κB activity induced by lipopolysaccharide in rat pulmonary interstitial macrophages[J].Chin J Pathophys,2004,20(8):635 -8.
[7]倪志宇,丛 斌,李淑瑾,等.CCK-8对LPS攻击小鼠IL-1β、IL-6、IL-4、IL-10表达的影响[J].中国病理生理杂志,2007,23(2):331-5.
[7]Ni Z Y,Cong B,Li S J,et al.Effects of cholecystokinin octapeptide on expression of IL-1β,IL-6,IL-4 and IL-10 in LPS-attacked mice[J].Chin J Pathophys,2007,23(2):331 - 5.
[8]Tang X R,Woodward T,Amar S.A PTP4A3 peptide PIMAP39 modulates TNF-alpha levels and endotoxic shock[J].J Innate Immun,2009,2(1):43-55.
[9]Li S J,Cong B,Yan Y L,et al.Cholecystokinin octapeptide inhibits thein vitroexpression of CD14 in rat pulmonary interstitial macrophages induced by lipopolysaccharide[J].Chin Med J,2002,115(2):276-9.
[10]倪志宇,李淑瑾,丛 斌,等.CCK-8抑制LPS诱导的大鼠肺间质巨噬细胞TLR4及IL-1β的表达[J].基础医学与临床,2005,25(2):137-40.
[10]Ni Z Y,Li S J,Cong B,et al.Inhibitory effect of CCK-8 on the expressions of TLR4 and IL-1β in LPS-induced pulmonary interstitial macrophages of rats[J].Basic Clin Med,2005,25(2):137 -40.
[11]Mogensen T H.Pathogen recognition and inflammatory signaling in innate immune defenses[J].Clin Microbiol Rev,2009,22(2):240-73.
[12]Meng A H,Ling Y L,Zhang X P,et al.CCK-8 inhibits expression of TNF-α in the spleen of endotoxic shock rats and sigual transduction mechanism of p38 MAPK[J].World J Gastroenterol,2002,8(1):139-43.
[13]韩冬艳,丛 斌,徐锦荣,等.CCK-8对IL-1β诱导大鼠滑膜细胞株RSC-364增殖的影响[J].中国药理学通报,2006,22(9):1075-8.
[13]Han D Y,Cong B,Xu J R,et al.Effect of CCK-8 on IL-1β-induced RSC-364 proliferation[J].Chin Pharmacol Bull,2006,22(9):1075-8

