亚硝酸钠对人肝癌细胞增殖与凋亡的影响
张付利,厉永强,史 齐,李延红,皇甫超申
(河南大学医学院环境医学研究所,河南开封 475004)
亚硝酸钠是一种常见的亚硝酸盐,广泛存在于自然界水体、蔬菜中,在食品加工过程中常用作添加剂防腐和增加风味,同时也广泛用于工业防腐和医药领域,因此广受人们关注。亚硝酸盐有可能与人体二级胺反应形成亚硝胺类物质,通常被认为有致癌作用。流行病学研究表明摄入过多的亚硝酸盐有导致消化道癌发生和致畸的危险,由于一直缺乏有力的实验支持,目前并不清楚亚硝酸盐对癌细胞的确切作用[1]。最近发现,人体亚硝酸盐不仅来自外源性饮水和食物,也可以由一氧化氮氧化内源性产生。亚硝酸盐在人体缺氧或酸性环境下,可以还原为一氧化氮,因此,维持人体一定剂量的亚硝酸盐可以调节生理机能,减轻心血管病的危害[2]。在这种背景下,研究亚硝酸盐对癌细胞生物作用就显得尤为迫切。课题组前期发现[3],亚硝酸钠对人肝癌细胞SMMC-7721增殖具有双相剂量效应,但机制不清,为此,课题组对亚硝酸钠诱导的人肝癌细胞SMMC-7721增殖、凋亡相关的早期增殖基因和缺氧诱导因子表达做了进一步研究。
1 材料与方法
1.1主要试剂与仪器
1.1.1主要试剂 亚硝酸钠(NaNO2),天津市晨福化学试剂厂(分析纯);DMEM培养基(Gibco,with high glucose);新生牛血清,杭州四季青生物公司产品;二甲基亚砜(DMSO),噻唑兰(MTT),Hochest33258购自Sigma公司;TRIzol试剂(美国 Invitrogen公司),反转录试剂盒(美国Promega公司),Taq酶(美国MBI公司),其他试剂均为国产或进口分析纯。c-myc引物由上海生工合成。HIF-1α单克隆抗体购自碧云天生物有限公司,鼠抗鸡囊(C4)βactin单抗、ECL Western blot化学发光检测试剂盒均购自Santa Cruz公司。
1.1.2主要仪器 MK3型酶标仪(Labsystem,Helsink,芬兰),FACSSalibur流式细胞仪(BD,美国);BX51荧光显微镜(OLYMPUS,日本);UV-540紫外-可见分光光度计(UNICAM,美国)。
1.2方法
1.2.1细胞培养 肝癌细胞系SMMC-7721购自中国医学科学院基础医学研究所。细胞生长在含100 ml·L-1胎牛血清的 DMEM培养基中,置5%CO237℃培养箱培养。
1.2.2MTT细胞增殖分析 SMMC-7721细胞于5%CO237℃恒温培养至对数生长期,用胰酶和EDTA消化,调整细胞数为1×1010cells·L-1接种到96孔细胞培养板,0.2 ml/孔,继续培养24 h后换液,分别用含不同浓度亚硝酸钠的DMEM培养液处理细胞(每个浓度5个复孔),对照组只加培养液,继续培养细胞48 h,每孔加入5 g·L-1MTT 20 μl培养4 h后,吸去培养液,每孔加入150 μl DMSO于振荡器上振摇,待兰色晶体完全溶解后,在酶标仪上测定570 nm处的吸光度值(A值)并计算生长率。以含有等体积的培养液和DMSO的无细胞孔测得的吸光度值为空白对照,实验重复3次。
1.2.3RT-PCR法检测SMMC-7721细胞c-myc mRNA的表达 将SMMC-7721细胞种植于50 ml培养瓶中生长至亚融合状态后,在含1%胎牛血清DMEM培养液中培养24 h,然后加入不同浓度的亚硝酸钠作用24 h后收集细胞,采用异硫氰酸胍-酸性酚-氯仿抽提法提取总RNA,以β-actin为内参照,按RT-PCR试剂盒说明书进行逆转录和扩增。c-myc上游引物:5'-CAAGAGGCGAACACACAACGT CT-3',下游引物:5'-AACTGTTCTCGTCGTTTCCGC-3',扩增产物为 219 bp。β-actin上游引物:5'-GCACTCTTCCAGCCTTCCTTCC-3',下 游 引 物:5'-TCACCTTCACCGTTCCAGTTTTT-3',扩增产物为516 bp。反应条件:94℃ 变性 30 s,55℃ 退火 30 s,72℃延伸60 s,共进行30个循环。扩增产物行2%琼脂糖凝胶电泳(含0.5 mg·L-1溴乙锭),胶片经光密度扫描,测定各条带吸光度值,以β-actin作内参照,计算相对比值。
1.2.4Hoechst 33258单染分析细胞增殖分数 细胞以5×107cell·L-1浓度接种培养于预置盖玻片(用0.1 g·L-1多聚赖氨酸处理)的6孔培养板内,每孔接种细胞数为1.5×105个。在不同时间点取出细胞爬片,经4%多聚甲醛固定、PBS冲洗、hoechst33258染色,紫外光激发,OLYMPUS-BX51荧光显微镜观察。实验重复3次,每张爬片随机选5个视野,计数正常有丝分裂细胞占总细胞比例为细胞相对增殖分数。
1.2.5流式细胞术测定细胞凋亡 采用FITC-annexinⅤ/PI双染法,分别收集各组细胞到10 ml的离心管中,每样本细胞数为1×109·L-1,1 000×g离心5 min,弃去培养液。用孵育缓冲液洗涤1次,1 000×g离心5 min,用100 μl的标记溶液重悬细胞,室温下避光孵育15 min,1 000×g离心5 min,沉淀细胞孵育缓冲液洗1次。加入annexinⅤ-FITC/PI溶液 5 μl 4℃下孵育 20 min,最后补 PBS 400 μl,以流式细胞仪检测细胞凋亡情况。每个样品检测1万个细胞,用cellquest软件进行细胞凋亡分析。
1.2.6Western blot检测HIF-1α蛋白表达 细胞于对数生长期加入各种浓度的亚硝酸钠,作用24 h后用RIPA 200 μl充分裂解提取蛋白,考马斯亮蓝G-250法测样品蛋白浓度,均衡每组蛋白浓度后,以12%SDS-PAGE凝胶电泳分离电转移蛋白至NC膜,5%脱脂奶粉封闭过夜,加入各种一抗(1∶200)于4℃封闭袋中孵育过夜,二抗(辣根过氧化物酶标记的羊抗鼠抗体,1∶4 000)孵育1 h。化学发光法显示结果,压片曝光,凝胶图像分析系统拍照,检测蛋白质印迹条带。
1.2.7统计学分析数据均采用±s表示,应用SPSS 12.0软件包处理,经正态分布和方差齐性检验后,进行单因素方差分析及两两比较t检验。
2 结果
2.1亚硝酸钠对人肝癌细胞SMMC-7721增殖的影响MTT分析结果显示,亚硝酸钠对人肝癌细胞SMMC-7721增殖作用呈双相剂量效应关系曲线(Fig 1),低剂量刺激增殖,高剂量抑制增殖,最明显的刺激细胞增殖作用出现在第24 h,最大促增殖效应为对照组的156%,IC50值为3 400 mg·L-1。

Fig 1 Cell proliferation in SMMC-7721 cells treated with sodium nitrite for 12,24,36,48 h(±s,n=3)
2.2亚硝酸钠对人肝癌细胞SMMC-7721 c-myc mRNA表达的影响根据MTT实验结果,从上述处理细胞的亚硝酸钠浓度范围内选取4个剂量,处理SMMC-7721细胞24 h,由 Fig 2可见,20、200 mg·L-1亚硝酸钠处理组细胞c-myc mRNA表达量明显高于空白对照组(P<0.05),而800和3 400 mg·L-1亚硝酸钠处理组细胞c-myc mRNA表达量与空白对照组差别无显著性(P>0.05)。
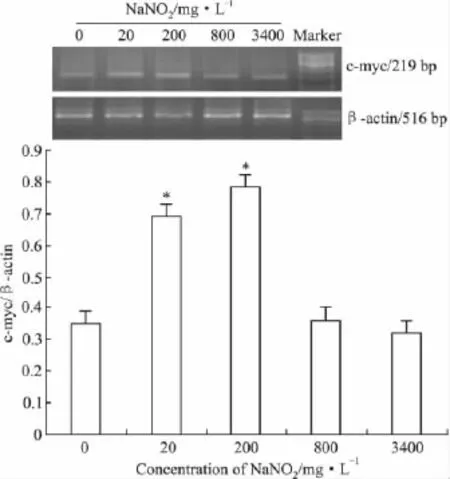
Fig 2 Expression of c-myc mRNA in SMMC-7721 cells treated with sodium nitrite for 24 h(±s,n=3)
2.3亚硝酸钠对SMMC-7721细胞分裂指数和凋亡的影响用Hoechst 33258荧光染料对细胞染色质染色,荧光显微镜下可分辨分裂期细胞。用200 mg·L-1亚硝酸钠作用SMMC-7721细胞24 h,细胞分裂指数为(6.88±1.2)%,与对照组(2.65±0.56)%相比,差异具有显著性(P<0.05)。800 mg·L-1亚硝酸钠作用细胞24 h,细胞分裂指数为(2.76±1.1)%,比对照组略增高,但差异无显著性(P>0.05),3 400 mg·L-1亚硝酸钠作用24 h,细胞分裂几乎被完全抑制,细胞分裂指数为(0.98±0.12)%,用实验组细胞分裂指数与对照组分裂指数相比,得出细胞相对分裂指数制成柱状图见Fig 3C。流式细胞术分析结果见Fig 3F,200 mg·L-1亚硝酸钠作用细胞24 h,细胞凋亡率为(3.54±2.93)%(Fig 3B),对照组细胞凋亡率为(5.98±2.16)%(Fig 3A),经t检验,差异具有显著性(P<0.05);800 mg·L-1亚硝酸钠作用24 h,细胞凋亡率为(6.55±3.12)%(Fig 3D),比对照组高,但差异无显著性(P>0.05);3 400 mg·L-1亚硝酸钠作用细胞24 h,细胞凋亡率为(53.54±4.62)%(Fig 3E),与对照组相比明显升高(P<0.05)。

Fig 3Mitotic and apoptosis efficiency in SMMC-7721 cells treated with sodium nitrite(±s,n=3)
2.4亚硝酸钠对人肝癌细胞SMMC-7721 HIF-1α蛋白表达的影响Western blot检测结果显示,正常培养的对照组SMMC-7721细胞有少量HIF-1α蛋白表达,亚硝酸钠终浓度在20~800 mg·L-1范围作用24 h,与空白对照组相比,细胞HIF-1α蛋白表达明显增加(P<0.05),而亚硝酸钠终浓度在3 400 mg·L-1时,细胞HIF-1α蛋白表达量有所下降,但与空白对照组相比差异无显著性(P>0.05)。见Fig 4。

Fig 4 Protein expression of HIF-1α in SMMC-7721 cells treated with sodium nitrite for 24 h(±s,n=3)
3 讨论
MTT实验发现,用终浓度20~200 mg·L-1范围内亚硝酸钠处理人肝癌SMMC-7721细胞24 h,可明显促进细胞增殖,随着时间延长,促增殖作用有所减弱,但皆可维持48 h。用200 mg·L-1亚硝酸钠处理细胞24 h,细胞分裂指数增加,细胞早期增殖基因c-myc mRNA表达增加,结果表明,亚硝酸钠在一定剂量下,对SMMC-7721细胞有促进增殖作用。
低剂量亚硝酸钠促进细胞增殖作用可能与下列机制有关:①在培养体系内产生少量一氧化氮:一般认为,亚硝酸钠在低剂量时是一种还原剂,在酸性或缺氧条件下,细胞利用酶或非酶途径将亚硝酸盐还原为NO[4],低剂量的NO或低剂量亚硝酸根离子本身都是信号分子,具有刺激细胞增殖的效应[5]。本实验是在普通培养条件下进行的,细胞培养24 h后,培养液pH值从7.3降至6.3左右,因此培养体系有可能产生少量一氧化氮。②刺激细胞分泌细胞因子:自分泌或旁分泌细胞因子是癌细胞的基本特征,借此无需外源性生长因子也能维持其自身生长和恶性表型转化。有报道,亚硝酸钠通过刺激胃癌细胞分泌 TNF、IL-6、IL-8发挥促进细胞增殖作用[6],据此推测,亚硝酸钠可能会促进 SMMC-7721细胞分泌细胞因子,促进细胞增殖。③增加细胞有氧糖酵解:低剂量亚硝酸盐刺激细胞增殖的作用,与亚硝酸盐及其还原的NO与线粒体呼吸链Ⅰ及Ⅳ结合,阻滞了呼吸链电子传递[7],减少细胞内氧消费,细胞转而采用糖酵解方式获取能量[8]。本实验发现低剂量亚硝酸钠诱导c-myc mRNA表达增加,而c-myc能促进糖酵解通路上许多酶活性增加,促进细胞葡萄糖转运,增加糖酵解,促进细胞增殖[9]。④促进细胞缺氧诱导因子表达:HIF-1是肿瘤细胞适应缺氧而产生的一种核转录因子,广泛参与哺乳动物细胞中缺氧诱导产生的特异应答,在缺氧诱导的基因表达调节中起着关键作用。肿瘤中HIF-1上调糖转运和糖酵解酶的相关基因,诱导血管生成因子表达增加,刺激细胞增殖。HIF-1除受缺氧调控以外,其他非氧依赖因素,如激素、生长因子、细胞因子、一氧化氮皆可调控其表达[10]。本实验结果显示,亚硝酸钠在一定剂量范围内可以促进SMMC-7721细胞HIF-1α蛋白的表达,提示低剂量亚硝酸钠促进细胞增殖与其增加细胞HIF-1α蛋白的表达有关。
本次实验还发现,200 mg·L-1亚硝酸钠作用细胞24 h,细胞凋亡率比空白对照组还要低,这可能与低剂量亚硝酸盐抑制线粒体呼吸链复合物Ⅰ,减少活性氧产生有关[11]。
本实验一个重要发现就是低剂量亚硝酸钠促进细胞早期增殖基因c-myc和HIF-1α表达,有关这方面的研究目前尚未见报道。在生理情况下,HIF-1抑制c-myc的活性,但是在肿瘤缺氧微环境,HIF-1协同c-myc共同促进下游有关细胞增殖、能量代谢等相关基因的转录[12]。课题组认为,c-myc和HIF-1α协同参与了亚硝酸钠促进细胞增殖作用,因为两者都是细胞核转录因子,通常情况下以c-myc和HIF-1α复合体的形式协同作用,促进下游一系列与细胞增殖有关的基因表达,如血管生成因子和糖酵解有关的酶,而后两者皆可促进细胞增殖[13]。
当亚硝酸钠浓度超过800 mg·L-1时,呈现浓度依赖性的细胞增殖抑制效应。用3 400 mg·L-1(24 h时的IC50值)亚硝酸钠处理SMMC-7721细胞24 h,大量细胞凋亡或坏死,说明亚硝酸钠在高剂量时作为一种氧化剂,大量破坏细胞膜结构和染色质的完整性,由此导致细胞死亡,这种细胞死亡与细胞内大量产生活性氧有关[14]。本实验还显示,由于高剂量亚硝酸钠导致细胞表达的c-myc mRNA和HIF-1α蛋白量与低剂量组相比有所下降,SMMC-7721细胞大量死亡,这从另外一个方面提示c-myc和HIF-1α参与了细胞增殖。
综上所述,亚硝酸钠对人肝癌SMMC-7721细胞呈现低剂量促进细胞增殖,抑制细胞凋亡,高剂量抑制细胞增殖,促进细胞凋亡的双相剂量效应关系;早期增殖基因c-myc和缺氧诱导因子表达增加在低剂量亚硝酸钠促进SMMC-7721细胞增殖过程中发挥重要作用。
[1]Hord N G,Tang Y,Bryan N S.Food sources of nitrates and nitrites:the physiologic context for potential health benefits[J].Am J Clin Nutr,2009,90(1):1-10.
[2]Lundberg J O,Gladwin M T,Ahluwalia A,et al Nitrate and nitrite in biology,nutrition and therapeutics[J].Nat Chem Biol,2009,5(12):865-9.
[3]孙玉生,史 齐,李延红,等.低浓度亚硝酸钠对人肝癌SMMC-7721细胞的毒物兴奋性效应[J].中国药理学通报,2010,26(3):419-20.
[3]Sun Y S,Shi Q,Li Y H,et al.Characterization of low dose sodium nitrite induced hormesis-like effects in human hepatocarcinoma SMMC-7721 cells[J].Chin Pharmacol Bull,2010,26(3):419-20.
[4]Duranski M R,Greer J J,Dejam A,et al.Cytoprotective effects of nitrite during in vivo ischemia-reperfusion of the heart and liver[J].J Clin Invest,2005,115(5):1232-40.
[5]Bryan N S,Fernandez B O,Bauer S M,et al.Nitrite is a signaling molecule and regulator of gene expression in mammalian tissues[J].Nat Chem Biol,2005,1(5):290-7.
[6]Sun J,Aoki K,Wang W,et al.Sodium nitrite-induced cytotoxicity in cultured human gastric epithelial cells[J].Toxicol In Vitro,2006,20(7):1133-8.
[7]Raat N J,Noguchi A C,Liu V B,et al.Dietary nitrate and nitrite modulate blood and organ nitrite and the cellular ischemic stress response[J].Free Radic Biol Med,2009,47(5):510-7.
[8]Jensen F B.Nitric oxide formation from nitrite in zebrafish[J].J Exp Biol,2007,210(19):3387-94.
[9]Dang C V,Le A,Gao P.MYC-induced cancer cell energy metabolism and therapeutic opportunities[J].Clin Cancer Res,2009,15(21):6479-83.
[10]Kim J W ,Gao P ,Liu Y C,et al.Hypoxia-inducible factor 1 and dysregulated c-Myccooperativelyinduce vascularendothelial growth factor and metabolic switches hexokinase and pyruvate dehydrogenase kinase 1[J].Mol Cell Biol,2007,27(21):7381-93.
[11]Shiva S.Mitochondria as metabolizers and targets of nitrite[J].Nitric Oxide,2010,22(2):64-74.
[12]Podar K,Anderson K C.A therapeutic role for targeting c-Myc/Hif-1-dependent signaling pathways[J].Cell Cycle,2010,9(9):1722-8.
[13]Zhang J,Sattler M,Tonon G,et al.Targeting angiogenesis via a c-Myc/hypoxia-inducible factor-1alpha-dependent pathway in multiple myeloma[J].Cancer Res,2009,69(12):5082-90.
[14]Erkekoˇglu P,Baydar T.Effect of allyl isothiocyanate(AITC)in both nitrite-and nitrosamine-induced cell death,production of reactive oxygen species,and DNA damage by the single-cell gel electrophoresis(SCGE):does it have any protective effect on HepG2 cells[J]?.Int J Toxicol,2010,29(3):305-12.

