白藜芦醇对过氧化氢诱导的人脐静脉血管内皮细胞损伤的保护作用
刘永刚, 罗景慧
(1.武警广东总队医院药剂科,广东广州510507;2.南方医科大学南方医院药学部,广东广州 510515)
白藜芦醇对过氧化氢诱导的人脐静脉血管内皮细胞损伤的保护作用
刘永刚1, 罗景慧2*
(1.武警广东总队医院药剂科,广东广州510507;2.南方医科大学南方医院药学部,广东广州 510515)
目的 研究白藜芦醇(Res)对过氧化氢(H2O2)诱导人脐静脉血管内皮细胞(HUVECs)损伤及凋亡的保护作用及机制。方法 体外培养第4~6代HUVECs,分为空白对照组、H2O2损伤组(300 μmoL/L)、Res低浓度(5 μmoL/L)、中浓度(10 μmoL/L)、高浓度(20 μmoL/L)预处理1 h加H2O2损伤组。用噻唑蓝比色法检测HUVECs活力,试剂盒检测丙二醛(MDA)、乳酸脱氢酶(LDH)量、超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)活性,流式细胞仪分析细胞凋亡率,western blot检测caspase-3的表达。结果 与空白对照组比较,H2O2损伤模型组细胞活力显著降低、MDA和LDH量显著增加、SOD和GSH活性显著下降、细胞凋亡率和caspase-3表达显著增加(P<0.01)。结论 Res通过降低与凋亡过程直接相关的caspase-3表达,抑制H2O2诱导内皮细胞凋亡,减轻H2O2对内皮细胞的损伤作用,从而产生保护血管内皮细胞的作用。
白藜芦醇;氧化性损伤;内皮细胞
白藜芦醇(resveratrol,Res)是中药虎杖的主要活性成分之一,具有广泛而重要的生物学活性。研究表明,Res是一种天然抗氧化剂,具有降低血液黏稠度保持血液畅通、预防癌症的发生及发展、抗过敏、抗突变、抗炎症、调节免疫等药理活性,被广泛应用于医药、保健品、化妆品和食品添加剂等领域[1-3]。研究表明,Res对缺血-再灌注脑损伤、心肌缺血损伤具有保护作用,且保护作用均与抗病灶局部氧化性反应、炎性反应等相关[4-6],提示Res对心脑血管的保护作用存在着共同作用机制,但是,Res防治脑损伤的机制尚未阐明。本研究拟通过体外培养人脐静脉血管内皮细胞(HUVECs),以过氧化氢(H2O2)诱导HUVECs损伤模型,研究Res对氧化性损伤的内皮细胞保护作用及其与凋亡的关系,探讨Res防治心、脑血管损伤性疾病的作用机理,为开发Res及其类似物治疗心脑血管损伤性疾病提供实验资料和理论依据。
1 材料与方法
1.1 试剂与药品 Res购自西安奥赛斯生物技术工程有限公司,用DMSO配制成原液,分装冻存,临用前用培养基稀释成所需浓度,使DMSO在培养液中的体积分数不大于0.000 5,实验表明该浓度对细胞的生长没有影响。人脐静脉血管内皮细胞(HUVECs)购自中国科学院上海生物化学研究所。马血清、DMEM/F12(DF12)培养基、胰蛋白酶购于Gibco公司(USA),胎牛血清购于杭州四季青生物技术有限公司,碘化丙啶(propidium iodide,PI)、Annexin V-异硫氰荧光素(FITC)、DNA酶、RNA酶、均购于Sigma公司(USA),多聚赖氨酸(poly-l-lysine,PLL)、3,(4,5-二甲基噻唑)-2,5-二苯基溴化四氮唑(MTT)购自武汉博士德生物技术工程公司,丙二醛(MDA)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)试剂盒购于南京建成生物工制品研究所,其它试剂均为国产分析纯。
1.2 细胞培养 HUVECs,以 DMEM/F12培养基进行体外培养。每500 mL DMEM/F12培养基含人表皮细胞生长因子(hEGF)2.0 mL、胎牛血清(FBS)10 mL、GA-1000(50 g/L硫酸庆大霉素和50 mg/L两性霉素-B)0.5 mL、人成纤维细胞生长因子(hFGF-B)2.0 ml、抗坏血酸 0.5 mL、血管内皮细胞生长因子 (VEGF)0.5 mL以及R3-IGF-1(长链R-胰岛素样生长因子)0.5 mL,培养第4~6代细胞用于实验。
1.3 MTT比色法测定细胞活力 取对数生长期细胞,以每孔2×105/mL接种于多聚赖氨酸包被的96孔板中,于37℃、5%CO2培养箱中进行孵育,24 h内细胞达到80~90%融合后,用含体积分数0.01%FBS的DMEM孵育细胞24 h,使细胞同步化。将接种孔分为五组:空白对照组、H2O2损伤组(300 μmol/L)、Res低浓度(5 μmol/L)、中浓度(10 μmol/L)、高浓度(20 μmol/L)预处理 20 min 加H2O2损伤组。损伤组是在经更换1%胎牛血清的培养液24 h后,加入终浓度为300 μmol/L H2O2继续作用24 h,各保护组加入不同终浓度Res预处理1 h,再进行损伤组相同处理,正常对照组加入等量的培养液,每个浓度及对照组均设6个平行孔。孵育24 h后,每孔加入20 μL MTT(5 g/L),37 ℃孵育4 h后,弃去培养液,每孔加入DMSO进制150 μL,振荡10 min后,用酶标仪于570 nm检测每孔光密度值(OD)值,按公式:细胞存活率=OD570(模型组或Res干预组)/OD570(正常对照组)×100%计算细胞存活率。
1.4 MDA、LDH、SOD和 GSH 的测定 HUVECs接种、用药处理步骤同1.3项。取上清细胞培养液,供LDH测定之用。以0.25%胰酶消化、收集 HUVECs,超声波打碎细胞后,根据试剂盒说明书加入检测试剂,用721分光光度计测定OD值,考马斯亮蓝法测定蛋白质量,以蛋白质量分别较正计算MDA、LDH、SOD、GSH 量及活性。
1.5 流式细胞仪检测细胞凋亡率 HUVECs接种、用药处理步骤同1.3项。细胞用Res和H2O2处理后,以0.25%胰酶消化、收集HUVECs,70%冷乙醇固定过夜,弃去冷乙醇,用冷PBS洗2次,调整细胞密度为1×109/L,加终浓度1 mg/mL RNase A 200 μL,37 ℃ 孵育30 min,避光加终浓度20 μL Annexin V-FITC和5 μL碘化吡啶染液,室温避光放置30 min,立即用流式细胞仪检测细凋亡细胞及死亡细胞数。
1.6 Western blot检测caspase-3的表达 HUVECs接种、用药处理步骤同1.3项。细胞用Res和H2O2处理后,用细胞刮刀刮下细胞,用冷PBS冲洗2遍,离心,弃去上清,在内皮细胞中加入1 mL细胞裂解缓冲液[1%(v/v)NP-40,0.1%(m/v)SDS,0.5%(m/v)脱氧胆酸钠,150 mmol/L NaCl和20 mmol/L Tris-HCl,pH 8.0],其中含苯甲磺酰氟(PMSF,1 μmol/L)、蛋白抑制剂 cocktail和磷酸酶抑制剂cocktail,匀浆液在4℃以15 000 g离心20 min,取上清液即为蛋白提取液,-80℃保存备用。取蛋白提取液,Folin-酚进行蛋白质定量,取相当于15 μg蛋白量的蛋白提取液样本上样,然后按常规进行SDS-PAGE凝胶电泳,电转移至PVDF膜,以含5%脱脂奶粉的TBS室温下封闭2 h,在膜上加入兔抗caspase-3(1∶500),4℃下孵育过夜。弃一抗,以TBS洗涤3次,每次10 min。加入TBS稀释的HRP-IgG二抗中 (1∶5 000),室温孵育2 h。弃二抗,以TBS洗涤3次,每次10 min,加入 ECL发光剂,室温下孵育5 min后用X线感光胶片曝光、显影和定影。用凝胶成像分析系统对caspase-3蛋白条带与相应的内参照β-actin条带进行灰度扫描,以两者扫描强度比值作为caspase-3蛋白的相对表达量。
1.7 统计学处理 所有数据表示为均值±标准差,采用SPSS13.0软件对数据进行统计学分析。
2 结果
2.1 Res对H2O2诱导HUVECs损伤后细胞活力的影响
与正常对照组相比,H2O2损伤模型组细胞活力显著降低 (P<0.01),Res各剂量组与H2O2损伤模型组相比,细胞活力显著升高 (P<0.05或P<0.01),且具有明显的剂量依赖性。结果见图1。与空白对照组比较:##P<0.01;与 H2O2损伤模型组比较:*P<0.05,**P<0.01
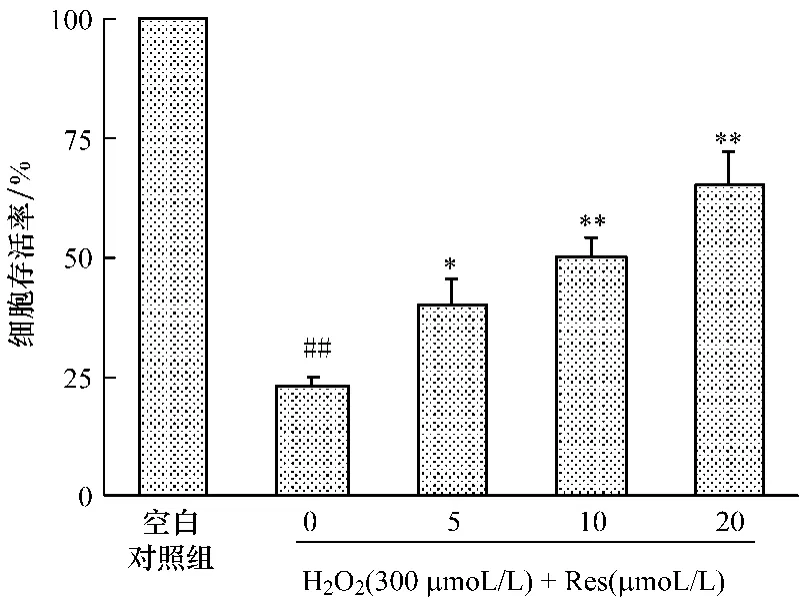
图1 Res对H2O2诱导HUVECs损伤后细胞活力的影响(±s,n=6)Fig.1 Effect of Res on the cell viability of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)
2.2 Res对 H2O2诱导 HUVECs损伤后 MDA和LDH量的影响
由表1可见,与空白对照组相比,H2O2损伤模型组MDA量和释放LDH水平显著升高(P<0.01),Res各剂量组与H2O2损伤模型组相比,MDA量和释放 LDH水平显著降低(P<0.05或P<0.01),呈明显的剂量依赖性。
表1 Res对H2O2诱导HUVECs损伤后MDA和LDH水平的影响(±s,n=6)Tab.1 Effect of Res on the level of MDA and LDH of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)
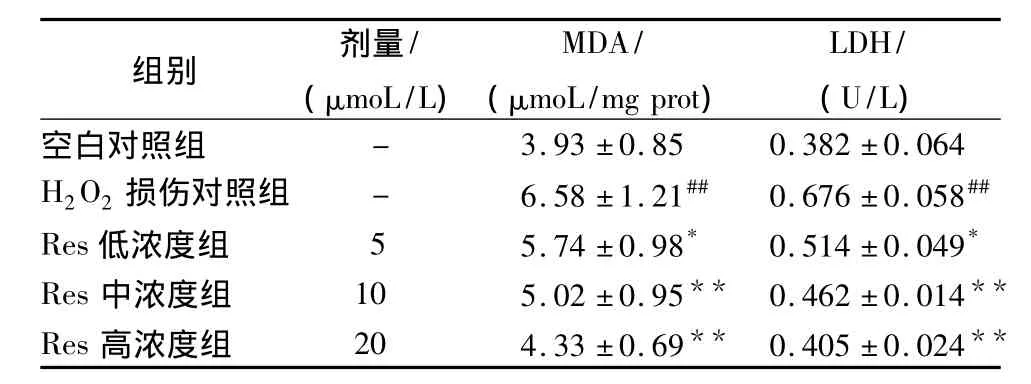
表1 Res对H2O2诱导HUVECs损伤后MDA和LDH水平的影响(±s,n=6)Tab.1 Effect of Res on the level of MDA and LDH of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)
注:与空白对照组比较:##P<0.01;与H2O2损伤模型组比较:*P <0.05,**P <0.01。
组别 剂量/(μmoL/L)MDA/(μmoL/mg prot)LDH/(U/L)空白对照组 - 3.93 ±0.85 0.382 ±0.064 H2O2损伤对照组 - 6.58±1.21## 0.676±0.058##Res低浓度组 5 5.74 ±0.98* 0.514 ±0.049*Res中浓度组 10 5.02 ±0.95** 0.462 ±0.014**Res高浓度组 20 4.33 ±0.69** 0.405 ±0.024**
2.3 Res对 H2O2诱导 HUVECs损伤后 SOD和GSH活性的影响
由表2可见,与空白对照组相比,H2O2损伤模型组SOD和还原型GSH活性显著降低 (P<0.01),Res各剂量组与H2O2损伤模型组相比,SOD和GSH活性显著升高 (P<0.05或P<0.01),呈明显的剂量依赖性。
表2 Res对H2O2诱导HUVECs损伤后SOD和GSH量的影响(±s,n=6)Tab.2 Effect of Res on the activity of SOD and GSH of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)

表2 Res对H2O2诱导HUVECs损伤后SOD和GSH量的影响(±s,n=6)Tab.2 Effect of Res on the activity of SOD and GSH of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)
注:与空白对照组比较,##P<0.01;与H2O2损伤模型组比较,*P <0.05,**P <0.01。
组别 剂量/(μmoL/L)SOD/(U/mg prot)GSH/(U/mg prot)空白对照组 - 265.3 ±16.8 60.58 ±0.72 H2O2损伤对照组 - 128.8±9.26## 10.64±1.45##Res低浓度组 5 155.4 ±7.82* 16.52 ±1.08*Res中浓度组 10 185.2 ±10.5** 31.86 ±2.13**Res高浓度组 20 228.3 ±12.7** 48.42 ±1.29**
2.4 Res对H2O2诱导HUVECs损伤后凋亡率的影响

图2 Res对H2O2诱导HUVECs损伤后细胞凋亡率的影响Fig.2 Effect of Res on apoptosis of human umbilical vein endothelial cell injury induced by hydrogen peroxide
由图2和表3可见,与空白对照组相比,H2O2损伤模型组细胞凋亡率明显增加 (P<0.01),Res各剂量组与H2O2损伤模型组相比,细胞凋亡率显著降低 (P<0.05或P<0.01),且随着 Res剂量的增加凋亡率降低越明显。
表3 Res对H2O2诱导HUVECs损伤后细胞凋亡率的影响(±s,n=6)Tab.3 Effect of Res on the apoptosis rate of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)

表3 Res对H2O2诱导HUVECs损伤后细胞凋亡率的影响(±s,n=6)Tab.3 Effect of Res on the apoptosis rate of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)
注:与空白对照组比较,##P<0.01;与H2O2损伤模型组比较,*P <0.05,**P <0.01。
组别 剂量/(μmoL/L) 凋亡率/%空白对照组6.52 ±1.45 H2O2损伤对照组 - 35.68±2.23##Res低浓度组 5 25.74 ±1.98*Res中浓度组 10 15.19 ±1.95**Res高浓度组 20 9.56 ±1.69-**
2.5 Res对 H2O2诱导 HUVECs损伤后 caspase-3表达的影响
由图3和表4可见,与空白对照组相比,H2O2损伤模型组caspase-3表达显著增加(P<0.01);与H2O2损伤模型组相比,Res各剂量组caspase-3表达显著降低 (P<0.01),且随着Res剂量的增加降低越明显。

图3 Res对H2O2诱导HUVECs损伤后caspase-3表达的影响Fig.3 Effect of Res on expression of Caspase-3 of human umbilical vein endothelial cell injury induced by hydrogen peroxide
表4 Res对H2O2诱导HUVECs损伤后caspase-3表达的影响(±s,n=6)Tab.4 Effect of Res on expression of Caspase-3 of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)

表4 Res对H2O2诱导HUVECs损伤后caspase-3表达的影响(±s,n=6)Tab.4 Effect of Res on expression of Caspase-3 of human umbilical vein endothelial cell injury induced by hydrogen peroxide(±s,n=6)
注:与空白对照组比较,##P<0.01;与H2O2损伤模型组比较,*P <0.05,**P <0.01。
组别 剂量/(μmoL/L) Caspase-3相对表达量空白对照组0.075 ±0.013 H2O2损伤对照组 - 0.352±0.083##Res低浓度组 5 0.211 ±0.098**Res中浓度组 10 0.096 ±0.021**Res高浓度组 20 0.076 ±0.014-**
3 讨论
前期研究表明,Res对缺血再灌注造成的脑损伤与心脏损伤均具有对抗和保护作用,且与抗炎作用和抗氧化作用相关[4-6]。但是Res对心脑血管疾病的防治作用是通过什么环节发挥的,尚未能阐明。本研究通过体外培养HUVECs,采用氧化性损伤诱导内皮细胞凋亡的方法初步探讨Res对心脑血管损伤的保护作用机制。
血管内皮细胞活力的强弱反映细胞增殖、代谢能力与血管机能状态,而LDH反映细胞膜完整性和细胞损伤与死亡程度。结果表明,Res减少H2O2诱导的细胞线粒体损伤,增加细胞活力;H2O2损伤模型组细胞培养液中LDH漏出率明显高于空白对照组,而给予Res后,细胞培养上清液中的LDH量明显减少,提示Res可减轻H2O2所致的细胞膜损伤,从而对内皮细胞产生保护作用。
氧化应激在心脑血管疾病中起着关键作用,H2O2是活性氧之一,可在细胞外诱导细胞凋亡,同时促进羟自由基产生,诱导细胞膜脂质过氧化反应,导致内皮细胞受损而死亡[8-9],并继发组织损伤,而体内存在天然抗氧化系统SOD和还原型GSH对抗氧化应激的细胞损伤作用。因此,凡抑制氧化应激和/或提高抗氧化系统功能均可防止细胞损伤的发生。Res作为抗氧化剂,可以使MDA水平降低,SOD和GSH活性增加,提示Res可能是通过增强体内抗氧化性应激系统作用拮抗氧化应激诱导内皮细胞损伤作用的。
在氧化性应激下激发产生的细胞凋亡是体内外因素触发细胞内预存的死亡程序导致的细胞死亡过程[10-11],而在不同的细胞凋亡因素刺激下,细胞内多个酶系统发生变化,其中caspase-3为最关键的酶之一,其位于凋亡的下游,一经活化,凋亡就不可逆转,如果抑制其活化,则可抑制凋亡的发生[12]。在细胞周期中,G0/G1期的细胞数量百分比减少,S期细胞数量百分比增加反映细胞内DNA增殖,细胞活力较高,反之,如果G0/G1期细胞比例偏大,说明静息或进入程序性死亡的细胞增多[13]。本实验结果表明,Res预处理能使G0/G1期的细胞数量百分比减少,S期细胞数量百分比增加,凋亡率显著降低,caspase-3表达降低,提示Res能使受损内皮细胞减少,增殖活力提高,且与caspase-3表达相关。
近年来研究表明,血管内皮细胞功能损害是心血管疾病早期的重要特征,是促发动脉粥样硬化、血管顺应性改变、血管对缩血管性因素和扩血管性因素反应改变的最重要始动因素[14-15],而在这过程中,内皮细胞凋亡的发生与内皮细胞受损伤关键尤为密切,因此,如何防止内皮细胞凋亡的发生,从而保护内皮细胞完整性和功能正常是目前临床医药工作者必须解决的重要课题,同时,寻找抗内皮细胞凋亡和保护内皮细胞功能的药物也为防治心血管疾病提供了新的靶点。
[1]Baur J A,Sinclair D A.Therapeutic potential of resveratrol:in vivoevience[J].Nat Rev Drug Discov,2006,5(6):493-506.BAUR J A,SINCLAIR D A.Therapeutic potential of resveratrol:in vivoevience[J].Nat Rev Drug Discov,2006,5(6):493-506.
[2]Bertelli A A,Das D K.Grapes,wines,resveratrol,and heart health[J].J Cardiovasc Pharmacol,2009,54(6):468-476.
[3]Sadruddin S,Arora R.Resveratrol:biologic and therapeutic implications[J].J Cardiometab Syndr,2009,4(2):102-106.
[4]刘永刚,王晓东,张小兵.白藜芦醇对脑缺血/再灌注损伤炎症反应的影响[J].中国中药杂志,2007,32(17):1792-1795.
[5]刘永刚,李芳君,谢少玲.白藜芦醇对脑缺血再灌注损伤的抗氧化活性及线粒体保护作用的研究[J].中成药,2007,29(9):1274-1277.
[6]张小兵,刘永刚,王晓东.白藜芦醇对实验性心肌缺血再灌注损伤的保护作用[J].中药材,2007;30(7):839-841.
[7]Cho E S,Jang Y J,Kang N J,et al.Cocoa procyanidins attenuate 4-hydroxynonenal-induced apoptosis of PC12 cells by directly inhibiting mitogen-activated protein kinase kinase 4 activity[J].Free Radic Biol Med,2009,46:1319-1327.
[8]Shinizu S,Ishii M,Miyasaka Y,et al.Role of the mitochondrial permeability transition and cytochrome C release in hydrogen peroxide-induced apoptosis[J].Int J Biochem Cell,2005,37(4):864-875.
[9]王桂霞,刘 义,杨春玲.原花青素对血管内皮细胞过氧化氢损伤的保护作用[J].中国动脉硬化杂志,2009,17(3):193-196.
[10]Kondo T,Hirose M,Kageyama K.Roles of oxidative stress and redox regulation in atherosclerosis[J].J Atheroscler Thromb,2009,16(5):532-538.
[11]Chen J,Patschan S,Goligorsky M S.Stress-induced premature senescence of endothelal cells[J].J Nephrol,2008,21(3):337-344.
[12]Mazumder S,Plesca D,Almasan A.Caspase-3 activation is a critical deperminant of genotoxic stress-induced apoptosis[J].Methods Mol Bil,2008,414:13-21.
[13]Katakura M,Hashimoto M,Shahdat H M,et al.Docosahexaenoic acid promotes neuronal differentiation by regulating basic helix-loop-helix transcription factors and cell cycle in neural stem cells[J].Neurosci,2009,160:651-660.
[14]Ribeiro F,Alves A J,Teixeira M,et al.Endothelial function and atherosclerosis:circulatory markers with clinical usefulness[J].Rev Port Cardiol,2009,28(10):1121-1151.
[15]Victor V M,Rocha M,Solá E,et al.Oxidative stress,endothelial dysfunctionand atherosclerosis[J].Curr Pharm Des,2009,15(26):2988-3002.
Protective effect of resveratrol on human umbilical vein endothelial cell injury induced by hydrogen peroxide
LIU Yong-gang1,LUO Jing-hui2*
(1.Department of Pharmacy,Guangdong Province Corps Hospital,Chinese People's Army Force,Guangzhou 510507,China;2.Pharmaceutical Department,Nanfang Hospital,Guangzhou 510515,China)
AIMTo investigate the protective effect of resveratrol(Res)on the injury of human umbilical vein endothelial cell(HUVECs)induced by hydrogen peroxide(H2O2)in vitroand to explore its mechanism.METHODSThe HUVECs was subculturedin vitroand used for experiment.They were divided into five groups as follows:control group,H2O2-injured group(300 μmoL/L),low-dosage of Res group(5 μmoL/L),mid-dosage of Res group(10 μmoL/L)and high-dosage of Res group(20 μmoL/L).MTT was used to determine the HUVECs viability.The contents of malondialdehyde(MDA),lactate dehydrogenase(LDH),superoxide dismutase(SOD),reduced glutathion(GSH)were measured by the commercial kits.Apoptosis rate of the HUVECs was analyzed by flow cytometry.The expression of apoptosis-related protein caspase-3 was measured by western blot.RESULTSCompared with the control group,H2O2significantly decreased HUVECs viability,increased the contents of MDA,LDH,and decreased the contents of SOD and GSH,and meantime increased the apoptosis rate and caspase-3 expression in H2O2-injured group.CONCLUSIONRes can protect HUVECs from HUVECs from H2O2-induced injury through lowering the expression of caspase-3,and inhibiting the endothelial cel apoptosis.
resveratrol;oxidative stress injury;endothelial cell
R962
A
1001-1528(2011)07-1126-05
2010-07-30
刘永刚(1971—),男,副主任药师,博士,从事中药新药研究与医院药学。Tel:(020)61627401,E-mail:liuyg1999@163.com
*通信作者:罗景慧(1971—),女,副主任药师,博士,从事肾脏损伤防治新药研究与开发。E-mail:yangyingluohui@hotmail.com

