吗啡成瘾及戒断大鼠前额叶皮质蛋白质组变化的初步研究*
杨 烨,张春燕,王 斌,林海英,邬丽莎△
(1.泸州医学院生物化学教研室,2.泸州市人民医院心内科,3.泸州医学院生理教研室,四川 泸州 646000)
药物成瘾是由于滥用药物与大脑奖赏系统相互作用产生的慢性、复发性脑疾病,有着极其复杂的机制。其主要原因就是形成了成瘾记忆[1]。因此,了解有成瘾特征化的学习和记忆机制对探求成瘾的本质具有重要意义。Berke等人的研究发现,前额叶皮层(prefrontal cortex,PFC)等多种神经元回路参与药物成瘾有关的学习和记忆过程[1],并与已知的记忆储存相关通路有很多相似之处。因此,在对成瘾记忆机制的阐明中,这些部位将为成瘾研究打开重要的突破口,并为其治疗开辟新的途径。
已有研究表明:PFC参与了物质成瘾相关的认知、行为和情绪变化的调节和控制[2]。功能的改变,必然涉及蛋白的改变,本研究采用蛋白质组学的研究方法,获得吗啡成瘾大鼠与自然戒断大鼠PFC蛋白质图谱。通过对这些图谱进行蛋白质表达差异分析并结合GenBank数据库资料,确定与吗啡成瘾及自然戒断相关的PFC蛋白质成分的表达改变,为进一步明确阿片类药物成瘾机制,特别是防止戒断后“复吸”提供实验依据。
1 材料与方法
1.1 实验动物
成年健康雄性SD大鼠30只,质量180~220g。由泸州医学院动物科提供。随机分为成瘾组、戒断组和正常对照组,每组10只。清洁级动物实验室分笼饲养,自由饮水进食。
1.2 吗啡成瘾及自然戒断大鼠模型建立
采用连续5 d背部皮下递增注射盐酸吗啡方法建立大鼠吗啡成瘾模型,每日给药量依次为 5、10、20、40、50mg/kg,每天3 次(8∶00,12∶00,16∶00),对照组按同样方式注射生理盐水。末次注射吗啡2 h后,动物腹腔注射2 mg/kg的纳洛酮进行催促戒断,记录1 h内动物出现的可数戒断症状及体质量变化情况。以改进的柳田知司评分标准对记录症状及体质量变化进行评分,作为判断成瘾的指标。对照组大鼠给予同样处理和评分。确认吗啡依赖后,成瘾组给予每天1次(8∶00)30mg/kg盐酸吗啡背部皮下注射1周。戒断组采取自然戒断法,仅给予同等量生理盐水注射1周。第13天8∶00观察大鼠的自然戒断症状并参照Koob吗啡成瘾大鼠躯体症状评分标准评分。
1.3 双向电泳分离大鼠PFC总蛋白,蛋白样品制备及双向电泳
上述处理完毕后,根据催促戒断反应验证吗啡成瘾大鼠模型成功建立。3组各取5只大鼠迅速断头处死,参照大鼠脑立体定位图谱,冰台上迅速分离PFC脑组织,去除脑膜,预冷三蒸水洗去血渍,滤纸吸去多余液体,移入匀浆器,加入细胞裂解液400μl后4℃震荡30min;4℃、12000r/min离心1 h,收集的上清液即为蛋白质提取物。用Bradford法测定各样品的总蛋白含量,分装,-80℃保存,备用。采用17 cm的线性IPG预制干胶条(pH 4~7),每根胶条上样量100μg,按照Bio-Rad公司说明书进行第一向固相pH梯度等电聚焦,总伏时数约为80000。随后按常规方法进行第二向SDS-PAGE。
1.4 差异蛋白的筛选和质谱鉴定
采用银染法对双向电泳后的凝胶进行染色。采用ImageMaster 2D Platinum v5.0软件进行成瘾组、戒断组和对照组蛋白质的差异分析,经过与对照组蛋白斑点的匹配和对比分析,初步筛选出成瘾组和戒断组差异表达的蛋白质,即表达量的增加或减少具有统计学意义的蛋白斑点。取实验组表达量增高达5倍以上的差异表达蛋白斑点4个,胶内酶切,进行基质辅助激光解吸附离子化飞行时间质谱(MALDI-TOFMS)鉴定,获得2个蛋白斑点的肽指纹图谱。再结合这些蛋白斑点的pI和MW等信息,使用肽指纹图谱匹配软件Mascot检索匹配GenBank数据库进行蛋白斑点的鉴定。
1.5 统计学方法
2 结果
2.1 动物模型的建立
随机选取的大鼠注射纳洛酮1 h内均出现湿狗样颤抖、伸展、清理皮毛、吞咽、站立、跳跃、齿颤、腹泻和体质量下降等戒断症状,评分也明显高于对照组(P<0.05)。证明吗啡成瘾大鼠模型成功建立。
2.2 各组行为表现
戒断一周组与正常对照组比较有非常显著性差异,吗啡成瘾组与正常对照组比较无显著性差异(表1)。
Tab.1 Behavior of rats in each group(,n=10)

Tab.1 Behavior of rats in each group(,n=10)
*P<0.05,**P<0.01 vs control
Symptoms Wet dog shakes Writhing Penile licking Jumping Teeth chattering Grooming Rearing Control 0.67±0.52 0 0.67±1.820.67±0.52 0 1.33±0.52 1.33±0.52 Morphine-addicted 1.33±0.52* 0 1.33±0.52*1.00±0.62* 0 2.67±0.52* 1.83±0.75*Morphine-withdrawal123.30±1.75**18.80±1.42**19.80±1.02**3.83±0.75**8.33±1.03**9.33±1.64**11.03±0.89**
2.3 成瘾组和戒断组大鼠PFC蛋白质双向电泳图谱分析
比较成瘾组和戒断组与正常对照组的双向电泳图谱,可见成瘾组和戒断组表达蛋白质组图谱发生了明显的改变,主要表现为双向电泳图谱中蛋白斑点数量的增减和灰度值的变化。通过ImageMaster 2D Platinum v5.0软件对2-DE图谱的蛋白斑点进行自动检测,成瘾组共检获蛋白斑点287个;戒断组共检获蛋白斑点296个。经蛋白斑点的匹配和对比分析,成瘾组差异表达(增高或降低))的蛋白斑点总数为87个,戒断组差异表达(增高或降低))的蛋白斑点总数为79个,绝大多数集中于pH 4.2~6.8的偏酸性区域,相对分子量介于 30~ 110kDa(图 1A、B、C)。

Fig.1 2-DE maps of proteome from PFC of morphine-addicted/withdrawal rats and normal rats
2.4 蛋白斑点的质谱鉴定
通过ImageMaster 2D Platinum v5.0软件匹配及对比分析,筛选出成瘾组表达量增高达5倍以上的蛋白斑点共计4个进行质谱检测鉴定,获得了2个蛋白斑点的肽指纹图谱(图2 B、C)。采用Mascot软件将各蛋白斑点的肽指纹图谱与Gen-Bank数据库中已知蛋白的标准肽指纹图谱相比对,获得各蛋白斑点的鉴定结果(图1B,表2)
3 讨论
PFC作为与药物成瘾相关的重要中枢,必然在吗啡成瘾及戒断的过程中发生适应性的病理改变。利用蛋白质组学技术研究不同个体不同时间的中枢神经系统蛋白质表达变化,已经成为神经功能研究的重要方向。

Fig.2 Peptide mass fingerprinting of 2 protein spots from 2-DE map of morphine-addicted group
本实验通过对成瘾大鼠PFC蛋白样品双向电泳图谱分析、MALDI-TOF-MS及生物信息学分析鉴定,并结合种属特异性在GenBank数据库中鉴定了2个有意义的吗啡成瘾组大鼠上调而戒断组及正常对照组大鼠下调的PFC蛋白斑点:(1)Snap 25 亚型 β-Snap25突 触相关蛋白 25(Snap25 isoform β-Snap25 of synaptosomal-associated protein 25,β-Snap)是突触前胞膜蛋白,在PFC和其他脑区的神经细胞中高度表达,是胞吐装置SNARE核心复合体的组成成分,介导突触囊泡的锚定和融合,在神经递质的释放中起重要作用,并参与突触可塑性的调节[3]。(2)β-肌动蛋白(actb actin,cytoplasmic 1)是帮助形成细胞骨架的结构蛋白,用于维持细胞结构和强度。
赵艳梅等[4]通过Western blot测定吗啡处理不同状态下γ-Snap的蛋白表达结果发现,慢性吗啡依赖大鼠尾壳核内γ-Snap蛋白表达上调约1.24倍(P<0.05),自然戒断2 d后γ-Snap蛋白表达下降至正常水平,在自然戒断 3、7 d时与对照组相比无变化。β-Snap和γ-Snap均属于SNAPs蛋白家族,参与细胞内膜的融合和囊泡移动。越来越多的研究表明,SNAPs在钙依赖的胞吐机制和神经递质释放过程中发挥重要作用。本研究中已鉴定的成瘾组差异表达蛋白斑点1即为β-Snap,在成瘾组上调而戒断组下调,与之研究结果一致。说明吗啡成瘾引起该蛋白表达上调,在成瘾损害相关的神经细胞生长、分化、信号转导、轴突生长和突触形成过程中发挥重要作用。Procaccio等[5]研究发现大脑细胞中结构蛋白—β-肌动蛋白的突变体与耳聋及肌张力障碍相关。突变体由于蛋白质的构象的改变不能结合ATP,引起细胞受损和死亡,最终导致大脑神经组织的损害。本研究中已鉴定的成瘾组差异表达蛋白斑点2即为β-肌动蛋白,说明吗啡成瘾大鼠神经组织β-肌动蛋白可能发生突变,导致神经细胞的供能障碍,与成瘾相关的神经细胞能量代谢变化相关。总之,上述已鉴定的与吗啡成瘾差异表达相关的蛋白质涉及神经细胞生长、凋亡、分化、信号转导、轴突生长和突触形成、细胞能量代谢等方面,将有助于更好的阐明阿片类药物依赖形成的分子机制。
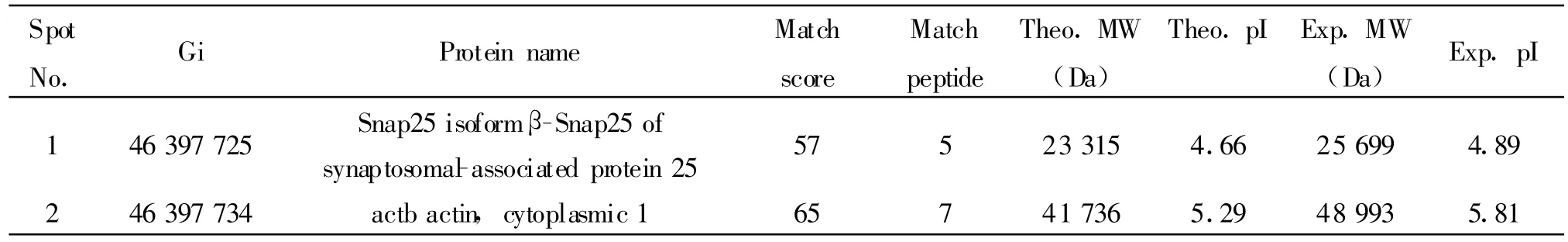
Tab.2 Proteins differentially expressed among morphine-addicted and withdrawal rats and normal rats identified by MS analysis
[1]Berke J D,Hyman S E.Addiction,dopamine,and the molecular mechanisms of memory[J].Neuron,2000,25(3):515-532.
[2]Davidson R J,Jackson D C,Kalin N H.Emotion,plasticity,context,and regulation:perspectives from affective neuroscience[J].Psychol Bull,2000,126(6):890-909.
[3]Zhang H M,Su Q,Luo M.Thyroid hormone regulates the expression of SNAP-25 during rat brain development[J].Mol Cell Biochem ,2008,307(1-2):169-175.
[4]赵艳梅,吴 宁,李 锦.慢性吗啡依赖及戒断对大鼠不同脑区NSF附着蛋白表达的影响[J].中国药理学通报,2008,24(5):616-621.
[5]Procaccio V,Salazar G,Ono S.A mutation of beta-actin that alters depolymerization dynamics is associatedwith autosomal dominant developmental malformations,deafness,and dystonia[J].Am J Hum Genet,2006,78(6):947-960.

