丹参注射液对庆大霉素耳中毒豚鼠耳蜗NOS异构体表达的影响*
王爱梅,汤 浩,宝东艳,于 利
(1.辽宁医学院生理学教研室,锦州 121001;2.中国医科大学生理学教研室,辽宁 沈阳 110001)
丹参注射液(salvia miltiorrhiza injection,SM)系由传统中药丹参提取制得,具有清除氧自由基、防止脂质过氧化、改善微循环等多种药理作用。研究表明,SM可有效抑制庆大霉素(gentamicin,GM)耳中毒后豚鼠耳蜗一氧化氮合酶(nitric oxide synthase,NOS)的表达,以减少NO的过量生成,从而拮抗GM的耳蜗毒性[1]。已知催化合成NO的NOS异构体有三种类型,即神经元型(neuronal NOS,nNOS/NOSⅠ)、诱导型(inducible NOS,iNOS/NOSⅡ)和内皮型(endothelial NOS,eNOS/NOSⅢ),SM是否对这三型NOS的表达都有影响目前尚不清楚。为此,本研究通过免疫组织化学方法及显微图像分析技术,结合听脑干反应(auditory brainstem response,ABR)测试,观察SM 对GM耳中毒后豚鼠耳蜗NOS三型异构体表达的影响,以进一步探讨SM对GM耳毒性的防护机制。
1 材料与方法
1.1 材料
健康白毛红目豚鼠,耳廓反射正常,体重250~300g,雌雄不限,由中国医科大学第二临床学院动物室提供;丹参注射液购自上海中西制药有限公司;硫酸庆大霉素购自天津药业集团新郑股份有限公司;兔抗nNOS/NOSⅠ和抗eNOS/NOSⅢ抗体为Santa Cruz公司产品,兔抗iNOS/NOSⅡ抗体为Sigma公司产品;即用型SABC免疫组织化学染色试剂盒和DAB显色试剂盒由武汉博士德生物工程有限公司提供。
1.2 实验动物分组及耳毒模型制备
将豚鼠随机分成4组(n=10):对照组、GM组、SM组和GM+SM组。GM组每日腹腔注射硫酸庆大霉素100mg/kg;SM组每日腹腔注射丹参注射液6 g/kg;GM+SM组同时注射硫酸庆大霉素和丹参注射液;对照组则每日腹腔注射与GM等量的生理盐水2.5 ml/kg。四组皆连续用药10d。用药期间每天监测动物体重以调整药量。
1.3 ABR测试
各组动物于用药前及停药第2天分别测试ABR。操作在隔音屏蔽室内进行。豚鼠用1%戊巴比妥钠40mg/kg经腹腔麻醉后,将电极的正极置于动物颅顶正中皮下,负极置于给声侧耳廓后下,接地电极置于对侧耳廓后下。利用Danac-7型声刺激器发出2000Hz为主的短声(click)刺激信号,间隔90ms,带通滤波 50~ 3000Hz,叠加 200次,扫描时程20ms。声刺激强度从95 dB SPL开始,以5 dB逐次递减,观察P3波以判定两侧耳的ABR阈值。
1.4 耳蜗标本制备
待各组动物停药并测试完ABR后,立即断头处死,速取听泡。充分暴露耳蜗后,在体视显微镜下刺破前庭窗及蜗窗,蜗尖钻孔并缓慢灌流含4%多聚甲醛的0.1 mol/L PBS(pH 7.4),并将标本浸入该固定液中4℃下2 h。经PBS冲洗后放入10%的EDTA中,4℃下脱钙20~25 d。然后移入25%蔗糖溶液中4℃过夜沉淀。用OCT包埋耳蜗,行20μm恒冷冰冻切片。
1.5 免疫组织化学方法检测NOS表达
切片干燥后用蒸馏水冲洗。0.5%H2O2室温孵育切片30min,蒸馏水冲洗。抗原修复液处理10min,蒸馏水冲洗。以正常血清封闭液室温下孵育切片20min后,滴加抗NOSⅠ~Ⅲ抗体(抗nNOS/NOSⅠ1∶400;抗 iNOS/NOS Ⅱ1∶4000;抗 eNOS/NOS Ⅲ 1∶100),4℃过夜,PBS冲洗。加生物素化二抗,37℃孵育30min,PBS冲洗。加SABC试剂,37℃孵育30min,PBS 冲洗。DAB显色,脱水,透明,封片,显微镜下观察。阴性对照染色切片用0.01 mol/L PBS(pH 7.4)代替一抗,其它实验步骤不变。
1.6 显微图像分析技术
每组随机抽取10张切片,置于显微镜下呈现图像后,用数码照相机拍照,并将图像输入计算机。应用Luzex-F图像分析仪,在同等条件下测量耳蜗血管纹、螺旋韧带、螺旋器和螺旋神经节处三型NOS阳性反应产物的灰度值,分别计算每组各部位的平均灰度值。灰度值越小,表示阳性反应越强烈。
1.7 统计学处理
2 结果
2.1 SM对GM耳中毒豚鼠ABR阈值的影响
连续用药10d后,GM组ABR阈值比用药前明显升高,并且与对照组比较差异显著(P<0.01)。GM+SM组ABR阈值虽然在用药后也有增高,但较GM组明显降低(P<0.01)。SM组与对照组ABR阈值无明显差异(表1)。
Tab.1 ABR thresholds of guinea pigs in each group(,n=20ears)
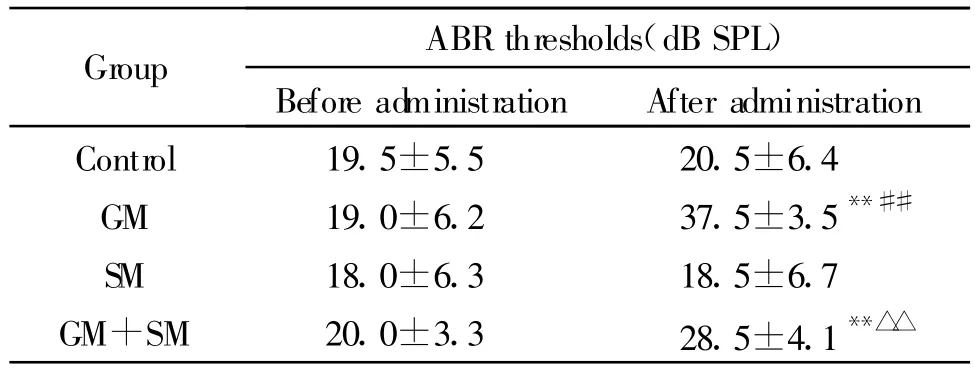
Tab.1 ABR thresholds of guinea pigs in each group(,n=20ears)
ABR:Auditory brainstem response;GM:Gentamicin;SM:Salvia miltiorrhiza injection**P<0.01 vs before administration;##P<0.01 vs control group;△△ P<0.01 vs GM group
Group ABR thresholds(dB SPL)Before administration After administration Control 19.5±5.5 20.5±6.4 GM 19.0±6.2 37.5±3.5**##SM 18.0±6.3 18.5±6.7 GM+SM 20.0±3.3 28.5±4.1**△△
2.2 SM对GM耳中毒豚鼠耳蜗NOS异构体表达的影响
2.2.1 iNOS/NOSⅡ 光镜下观察,可见对照组豚鼠耳蜗中iNOS的阳性染色较弱,其免疫反应产物呈棕黄色颗粒,分布于耳蜗血管纹(stria vascularis,SV)、螺旋韧带(spiral ligament,SL)、螺旋器(the organ of Corti)和螺旋神经节(spiral ganglion,SG)细胞的胞浆内。GM组、SM组和GM+SM组豚鼠耳蜗中iNOS阳性反应产物的分布与对照组大致相同,但GM组的阳性染色比对照组明显加深,阳性颗粒显著增多,而GM+SM组的阳性染色则较GM组明显减弱(图1~3)。显微图像分析结果显示,GM组豚鼠耳蜗各部位iNOS免疫反应的平均灰度值较对照组明显减小(P<0.01),即GM 组耳蜗iNOS表达显著增强;而GM+SM组豚鼠耳蜗iNOS免疫反应的平均灰度值则较GM组有所增大,即iNOS表达明显弱于GM组(P<0.05,P<0.01,表2)。
Tab.2 Average gray value of iNOS immunoactivity in the guinea pig cochleae of each group(,n=10)

Tab.2 Average gray value of iNOS immunoactivity in the guinea pig cochleae of each group(,n=10)
SV:Stria vascularis;SL:Spiral ligament;SG:Spiral ganglion;GM:Gentamicin;SM:Salvia miltiorrhiza injection**P<0.01 vs control group;#P<0.05,##P<0.01 vs GM group
Group Average gray value SV SL Organ of Corti SG Control 110.48±10.60 125.15±10.80 127.59±6.32 116.91±8.72 GM 90.01±9.02** 101.30±9.14** 102.31±7.51** 97.44±7.92**SM 111.20±9.89 126.13±9.54 128.18±8.14 119.06±9.66 GM+SM 99.89±6.19# 114.67±9.49## 116.67±6.18## 108.28±6.73##

Fig.1 Expression of iNOS in the SV and SL of guinea pig cochleae(SABC method of immunohistochemistry,cryostat section×200)
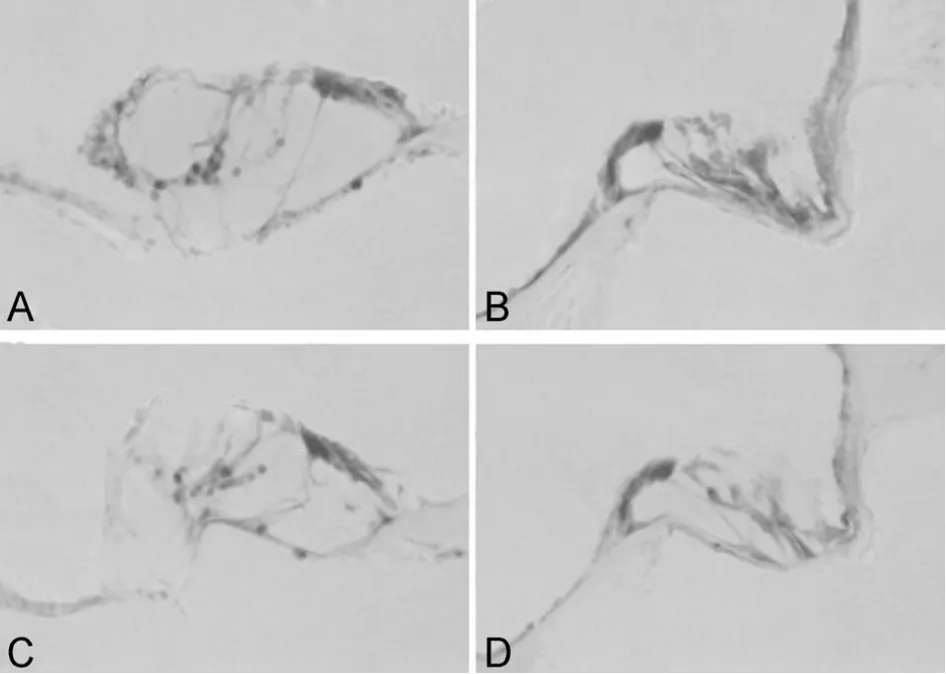
Fig.2 Expression of iNOS in the organ of Corti of guinea pig cochleae(SABC method of immunohistochemistry,cryostat section×200)
2.2.2 nNOS/NOSⅠ和eNOS/NOSⅢ 光镜下可见,各组豚鼠耳蜗中nNOS和eNOS阳性反应产物亦为棕黄色颗粒,并且与iNOS的分布大致相同,但各组间nNOS和eNOS阳性染色无明显差别。显微图像分析结果表明,各组间nNOS和eNOS免疫反应的平均灰度值无显著性差异。

Fig.3 Expression of iNOS in the SG of guinea pig cochleae(SABC method of immunohistochemistry,cryostat section ×400)
2.3 豚鼠耳蜗各部位 iNOS免疫反应的平均灰度值与ABR阈值的关系
连续给药10d后,各组豚鼠耳蜗不同部位iNOS免疫反应的平均灰度值发生变化,同时伴有ABR阈值的改变,提示二者之间关系密切。通过直线相关检验证明二者高度相关(|r|>0.7,表3),表明iNOS表达越强,ABR阈值越高。
Tab.3 Correlation between average gray value of iNOS immunoactivity and ABR thresholds of guinea pig from each group(,n=10)
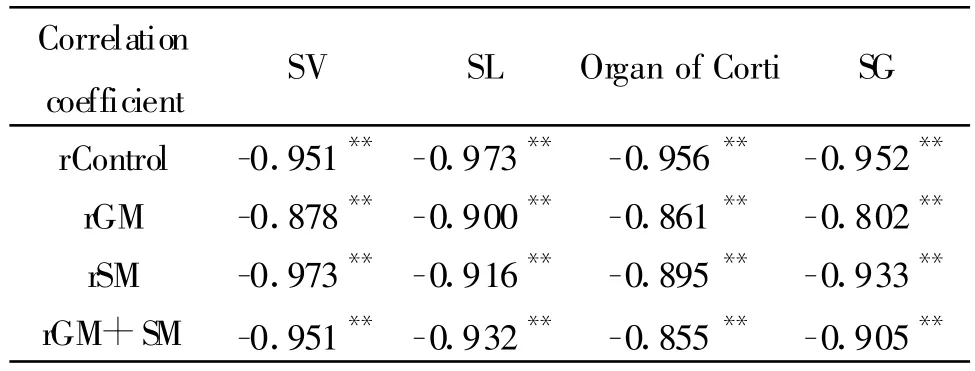
Tab.3 Correlation between average gray value of iNOS immunoactivity and ABR thresholds of guinea pig from each group(,n=10)
SV:Stria vascularis;SL:Spiral ligament;SG:Spiral ganglion;GM:Gentamicin;SM:Salvia miltiorrhiza injection**P<0.01
Correlation coefficient SV SL Organ of Corti SG rControl -0.951**-0.973** -0.956** -0.952**rGM -0.878**-0.900** -0.861** -0.802**rSM -0.973**-0.916** -0.895** -0.933**rGM+SM -0.951**-0.932** -0.855** -0.905**
3 讨论
研究表明,NOS三型异构体均存在于豚鼠耳蜗结构中,并且可在生理状态下表达其活性[2,3],而病理状态下iNOS的诱导表达及其产生的大量NO可能参与了内耳疾病的发病过程[4,5]。Shi等[4]发现噪声暴露可诱导豚鼠耳蜗螺旋器毛细胞及SV边缘细胞内iNOS的高表达,提示iNOS参与了噪声所致听力丧失。Watanabe等[5]报道给予耳毒性药物顺铂后,小鼠耳蜗SV和SL中iNOS表达增强,同时伴有ABR阈移增大,提示iNOS介导了顺铂的耳毒性,导致听力丧失。本研究结果显示,单独接受GM注射10d后,豚鼠耳蜗SV、SL、螺旋器和SG细胞中iNOS表达明显增强,且与ABR阈值升高高度相关,表明iNOS及其产生的大量NO也参与了GM耳中毒过程,进一步证实了本研究室的前期工作结果。此外,我们还观察到,GM耳中毒后,豚鼠耳蜗各部位nNOS和eNOS的表达与对照组比较并无显著性差异,这与Hess等[6]的报道相似。他们将细菌性脂多糖和肿瘤坏死因子α的混合物注入豚鼠鼓室腔后,耳蜗nNOS和eNOS的表达也无改变。综合我们的研究结果,提示GM可能并不影响nNOS和eNOS的表达,而是通过使iNOS表达显著增强,进而产生过量的NO,引起耳蜗损害,导致听力丧失。
SM主要是中药丹参的水溶性成分,包括丹参素、丹参酮及丹酚酸等。近来的研究表明,SM及其有效单体均可通过抑制iNOS的表达而发挥防护作用,如SM可抑制慢性缺氧大鼠肺小动脉内iNOS的表达,从而影响缺氧性肺动脉高压形成中的肺小动脉重构[7];丹参酮能降低β淀粉样蛋白诱导的iNOS高表达,从而防护β淀粉样蛋白对大鼠海马神经元的损伤[8]。此外,SM还可明显降低链霉素所致豚鼠ABR阈值升高,并可抑制耳蜗SG细胞内iNOS的过表达,从而减轻耳毒性损伤[9]。本研究结果显示,GM+SM组豚鼠耳蜗SV、SL、螺旋器以及SG细胞中nNOS、eNOS和iNOS的分布均与GM 组相同,且其nNOS和eNOS表达与GM组比较无显著性差异,但iNOS表达则明显弱于GM组,同时豚鼠ABR阈值也显著降低,并且与iNOS表达下调高度相关。由此提示,SM虽然对GM耳中毒后豚鼠耳蜗各部位nNOS和eNOS表达无明显影响,但可抑制GM所致iNOS表达的增强,以减少NO的过量生成,从而发挥对GM耳毒性的防护作用。至于SM下调GM耳中毒豚鼠耳蜗iNOS表达的具体机制,还有待于今后更深入的研究。
[1]王爱梅,汤 浩,沈 静,等.丹参注射液对庆大霉素耳中毒豚鼠耳蜗NOS活性的影响[J].中国医科大学学报,2001,30(2):6-8.
[2]Heinrich U R,Maurer J,Mann W.Evidence for a possible NOS back-up system in the organ of Corti of the guinea pig[J].Eur Arch Otorhinolaryngol,2004,261(3):121-128.
[3]Wang A M,Tang Hao,Zhang Z M,et al.Localization and expression of three nitric oxide synthase isoforms in the cochlea of guinea pigs and the effects in the hearing processof inner ear[J].Chin J Clin Rehabil,2005,9(37):160-161.
[4]Shi X,Dai C,Nuttall A L.Altered expression of inducible nitric oxide synthase(iNOS)in the cochlea[J].Hear Res,2003,177(1-2):43-52.
[5]Watanabe K I,Hess A,Bloch W,et al.Nitric oxide synthase inhibitor suppresses the ototoxic side effect of cisplatin in guinea pigs[J].Anticancer Drugs,2000,11(5):401-406.
[6]Hess A,BlochW,Huverstuhl J.Expression of inducible nitric oxide synthase(iNOS/NOSⅡ)in the cochlea of guinea pigs after intratympanical endotoxin-treatment[J].Brain Res,1999,830(1):113-122.
[7]Chen Y,Ruan Y,Li L,et al.Effects of salvia miltiorrhiza extracts on rat hypoxic pulmonary hypertension,heme oxygenase-1 and nitric oxide synthase[J].Chin Med J,2003,116(5):757-760.
[8]Li L X,Dai J P,Ru L Q,et al.Effects of tanshinone on neuropathological changes induced by amyloid beta-peptide(1-40)injection in rat hippocampus[J].Acta Pharmacol Sin,2004,25(7):861-868.
[9]石丽娟,官 捷,汤 浩.链霉素耳中毒豚鼠耳蜗螺旋神经节iNOS、AChE表达及丹参的保护作用[J].中国应用生理学杂志,2009,25(2):264-267.

