灌胃和皮下注射脂肪膜蛋白卵黄抗体对大鼠生长和脂肪沉积的影响*
周 杰,赵茹茜,陈 杰,陈永秦
(1.安徽农业大学,合肥 230036;2.南京农业大学农业部动物生理生化重点开放实验室,江苏 南京 210095;3.上海华扩达生化科技有限公司,上海 201206)
自20世纪80年代末以来,利用脂肪细胞膜(adipocyte plasma membeane,APM)免疫技术在调节动物生长和提高动物胴体瘦肉率方面取得了很大的进展,经脂肪细胞膜免疫的动物,不仅脂肪沉积减少,瘦肉量增加[1,2]。目前,主要通过被动免疫的方式处理动物,所用抗体通常来自抗血清,通过皮下或腹膜注射处理动物,这样会引起动物短时间内的应激反应,且在生产上的应用也受到限制。卵黄抗体因其特有的理化性质,对消化酶具有较强的抵抗能力,因而可供口服(钟青萍等,1998)。但口服脂肪细胞膜蛋白卵黄抗体对哺乳动物脂肪沉积的影响尚未见报道。本试验以大鼠为动物模型,在制备猪脂肪细胞膜蛋白卵黄抗体的基础上采用口服方式被动免疫大鼠,并与皮下注射方式进行比较,通过测定大鼠生长性能、脂肪沉积和相关血清生化及激素等指标,为脂肪细胞膜免疫中和技术的应用提供科学依据。
1 材料与方法
1.1 试验动物
选择体重140g左右清洁级雌性SD大鼠96只(由南京医科大学动物房提供),随机分成4组(n=24):每组共分8笼,每笼3只,大鼠自由采食和饮水,常规饲养管理。大鼠饲料由江浦实验动物饲料厂提供,营养成分经测定为:干物质:89.32%,粗蛋白质24.02%,粗脂肪3.94%,灰份7.9%,钙1.4%,总磷0.8%,盐分1.31%。
1.2 试验材料
试验用阳性卵黄含脂肪细胞膜蛋白卵黄抗体,由本实验室提取猪脂肪细胞膜蛋白,免疫蛋鸡后获得,ELISA测定抗体效价为1∶12800[3]。
1.3 试验设计
试验采用被动免疫方式,大鼠分灌胃组、灌胃对照组、皮下注射组和皮下注射对照组。灌胃组大鼠经灌胃给予1 ml阳性卵黄,每3 d灌胃1次。灌胃对照组同途径给予等量阴性卵黄。皮下注射组大鼠经背部皮下多点注射1 ml阳性卵黄。连续注射4 d,30d后同方式加强免疫1次。皮下注射对照组同途径给予等量阴性卵黄。
1.4 样品采集
试验始末均测定体重,试验过程中测定摄食量。正式试验75 d后进行屠宰试验,测定肠系膜脂肪、子宫周脂、肾脂肪囊以及腓肠肌湿重。采集血样,分离血清后-20℃冰箱保存。
1.5 样品分析
血清激素水平用放射免疫法(RIA)测定。胰岛素试剂盒购自上海生物制品研究所;瘦素(Leptin)试剂盒购自解放军总医院科技开发中心放免所;肿瘤坏死因子α(TNF-α)试剂盒购自解放军总医院科技开发中心放免所。血清甘油三酯用甘油磷酸氧化酶法测定,试剂盒购自浙江东瓯生物工程有限公司;血清胆固醇用酶终点法测定,试剂盒购自上海荣盛生物技术有限公司;血清游离脂肪酸用硫酸铜法测定,试剂盒购自南京建成生物工程研究所。
1.6 数据统计分析
以器官湿重(g)/体重(kg)表示器官指数,试验数据以平均数()来表示,SPSS软件进行数据处理和结果分析。
2 结果
2.1 脂肪细胞膜蛋白卵黄抗体对大鼠生长的影响
各组大鼠的初始体重、终末体重、饲料摄入量均无显著差异,卵黄抗体处理对大鼠每周的体增重和摄食量均无显著影响(结果未列出),表明脂肪细胞膜蛋白卵黄抗体对大鼠的生长和饲料利用率没有影响(表1)。
Tab.1 Effect of oral and subcutaneous administration of IgY against APM proteins on growth and food intake of rats(,n=24,g)
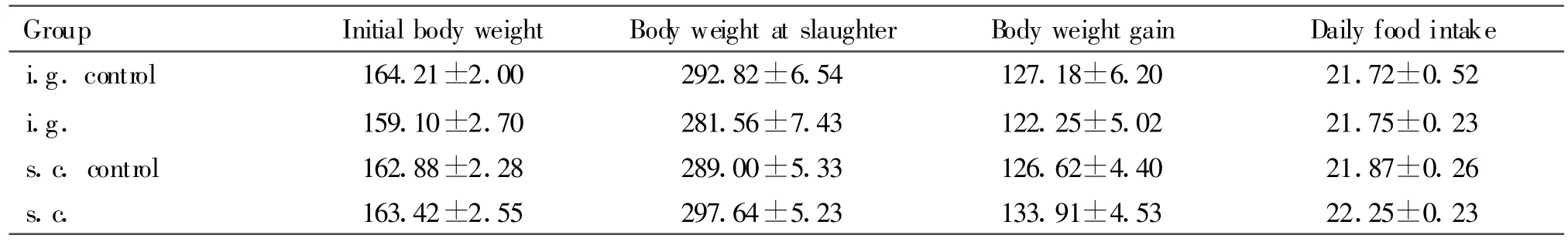
Tab.1 Effect of oral and subcutaneous administration of IgY against APM proteins on growth and food intake of rats(,n=24,g)
i.g.control:Intragastric administration control;i.g.:Intragastric administration;s.c.control:Subcutaneous injection control;s.c.:Subcutaneous injection
Group Initial body weight Body weight at slaughter Body weight gain Daily food intake i.g.control 164.21±2.00 292.82±6.54 127.18±6.20 21.72±0.52 i.g. 159.10±2.70 281.56±7.43 122.25±5.02 21.75±0.23 s.c.control 162.88±2.28 289.00±5.33 126.62±4.40 21.87±0.26 s.c. 163.42±2.55 297.64±5.23 133.91±4.53 22.25±0.23
2.2 脂肪细胞膜蛋白卵黄抗体对大鼠不同部位脂肪沉积的影响
阳性卵黄灌胃分别使肠系膜脂重和肠系膜脂指数下降20.20%和17.14%;使子宫周脂重和子宫周脂指数下降28.41%和24.22%;使肾脂肪囊重和肾脂肪囊指数下降24.35%和21.62%(P<0.05)。而皮下注射阳性卵黄后,各部位脂肪沉积及沉积指数虽有下降趋势,但与对照相比均未达到显著水平(表2)。
2.3 脂肪细胞膜蛋白卵黄抗体对大鼠腓肠肌生长的影响
阳性卵黄灌胃对腓肠肌和腓肠肌指数均无显著差异,而皮下注射阳性卵黄使腓肠肌重和腓肠肌指数提高7.83%和5.20%(P<0.05,表2)。
Tab.2 Effect of IgY against APM proteins on adipose tissue depots and growth of gastrocnemiusmuscle of rats(,n=24)

Tab.2 Effect of IgY against APM proteins on adipose tissue depots and growth of gastrocnemiusmuscle of rats(,n=24)
*P<0.05 vs i.g.control;#P<0.05 vs s.c.control
Group Organweight(g)Mesenteric fat Parametrial fat Perorenal fat Gastrocnemius muscle Organ index(g/kg)Mesenteric fat Parametrial fat Perorenal fat Gastrocnemius muscle i.g.control 5.06±0.407.31±0.764.53±0.421.70±0.03 17.16±1.0524.58±2.2415.32±1.255.83±0.09 i.g. 4.04±0.31*5.24±0.53*3.43±0.36*1.66±0.06 14.22±1.02*18.63±1.98*12.01±1.17*5.89±0.11 s.c.control 5.44±0.337.96±0.525.53±0.391.66±0.03 18.75±0.8727.58±1.7819.18±1.325.73±0.06 s.c. 5.41±0.287.90±0.565.39±0.481.79±0.02#18.06±0.7226.43±1.7217.95±1.486.03±0.11#
2.4 脂肪细胞膜蛋白卵黄抗体对大鼠血脂的影响
阳性卵黄灌胃使血清甘油三酯浓度下降22.33%(P<0.05),游离脂肪酸浓度升高32.44%(P<0.01)。而对血清胆固醇浓度无显著影响。皮下注射阳性卵黄可使血清甘油三酯浓度降低25.52%(P<0.01),但对血清游离脂肪酸和总胆固醇无显著影响(表3)。
Tab.3 Effect of IgY against APM proteins on serum fat of rats(,n=24)
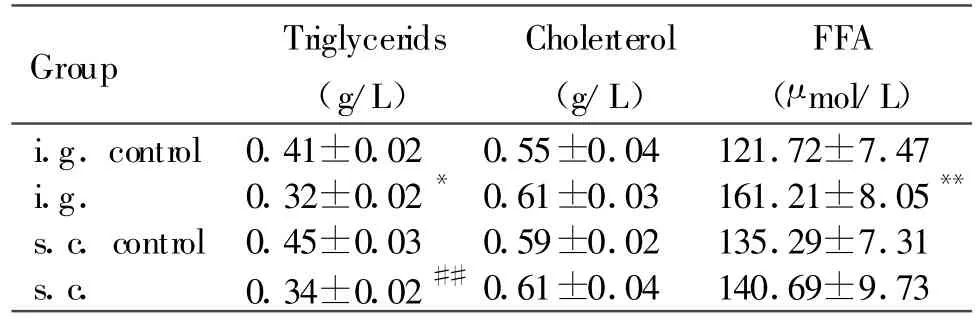
Tab.3 Effect of IgY against APM proteins on serum fat of rats(,n=24)
*P<0.05,**P<0.01 vs i.g.control;##P<0.01 vs s.c.control
Group Triglycerids(g/L)Cholerterol(g/L)FFA(μmol/L)i.g.control0.41±0.02 0.55±0.04 121.72±7.47 i.g. 0.32±0.02*0.61±0.03 161.21±8.05**s.c.control0.45±0.03 0.59±0.02 135.29±7.31 s.c. 0.34±0.02##0.61±0.04 140.69±9.73
2.5 脂肪细胞膜蛋白卵黄抗体对大鼠血清Leptin、胰岛素和TNF-α水平的影响
阳性卵黄灌胃可使血清leptin水平降低27.78%(P<0.01),血清胰岛素水平降低13.94%(P<0.05),使血清TNF-α水平降低 10.50%(P<0.05);皮下注射阳性卵黄使血清Leptin水平降低21.33%(P<0.01),使血清TNF-α水平升高19.07%(P<0.05),而对血清胰岛素无产生显著影响(表4)。
Tab.4 Effect of IgY against APM proteins on serum leptin,insulin and TNF-α(,n=24)

Tab.4 Effect of IgY against APM proteins on serum leptin,insulin and TNF-α(,n=24)
*P<0.05,**P<0.01 vs i.g.control;#P<0.05,##P<0.01 vs s.c.control
Group Leptin(ng/ml)Insulin(μU/ml)TNF-α(ng/ml)i.g.control2.16±0.14 18.94±0.70 2.00±0.08 i.g. 1.56±0.14**16.30±0.72* 1.79±0.07*s.c.control3.75±0.19 18.12±0.96 1.94±0.10s.c. 2.95±0.14##17.78±0.79 2.31±0.09#
3 讨论
近年来,随着IgY理化性质和免疫性质众多优点的发现,IgY在生物制品的开发和疾病防治方面的应用已受到人们的普遍重视。IgY可以直接注射,也可以口服,液体蛋黄或固体蛋黄口服同样有效。兽医上口服卵黄抗体预防或治疗由病毒或细菌引起的疾病已取得较好的结果。但是以往的报道主要是针对动物体内外源性病原微生物的,而有关口服卵黄抗体对哺乳动物内源性物质(如脂肪细胞)的作用未见报道。
本试验首次给生长期大鼠灌胃猪脂肪细胞膜蛋白卵黄抗体,发现卵黄抗体处理后显著降低了大鼠肠系膜脂、子宫周脂和肾脂肪囊等处的脂肪沉积。这与 Futter[2]和 Panton[4]用抗血清处理大鼠,Kestin[5]和唐宝定在猪上的结果一致,表明脂肪细胞膜蛋白卵黄抗体与抗血清一样有降低动物脂肪沉积的作用。尤其值得注意的是,卵黄抗体可通过口服途径降低动物的脂肪沉积,且灌胃卵黄抗体的效果优于皮下注射卵黄抗体。一般认为,皮下注射途径往往由于吸收快而见效迅速,但代谢快导致作用时间较短。口服途径虽然由于吸收慢而见效迟缓,但因代谢也慢,能保持较长的作用时间。此外,利用脂肪细胞膜蛋白为高度保守蛋白质的特点,由一种动物脂肪细胞膜蛋白为抗原制备的卵黄抗体可以作用于另一种动物的脂肪细胞。
本试验发现卵黄抗体处理后大鼠每周的体增重和摄食量均无显著差异。这与文献报道不尽相同。Panton[4]在大鼠、Kestin[5]在猪上的试验均显示抗血清注射后会引起短时间的不良反应,如摄食量减少,增重下降,然后逐渐恢复到一般水平。造成这种差异的原因可能是因为鸟类与哺乳动物的亲源关系比哺乳动物不同种类之间更远,IgY与哺乳动物特异蛋白质产生免疫应答的同时,与其他蛋白的交叉反应较小[6]。此外,本试验卵黄抗体皮下注射显著促进了腓肠肌的生长,与Kestin[5]在猪上的报道一致,而灌胃对腓肠肌生长没有影响,有关机制尚需进一步研究。
动物脂肪沉积与血脂水平之间存在密不可分的关系,据Hu等在大鼠和Dulor等在兔上试验报道,被动免疫使血液游离脂肪酸和甘油三酯浓度升高,Nassar等用抗血清处理羊后,血中游离脂肪酸含量下降,而甘油三酯不受影响。唐宝定[6]在猪上的试验表明,血液游离脂肪酸在免疫初期升高,在试验后期没有变化,血清甘油三酯和胆固醇不受免疫的影响。在Moloney[7]的试验中,血中游离脂肪酸含量在免疫初期升高,随后又显著下降。本试验中卵黄抗体处理可降低血清甘油三酯浓度,同时提高血清游离脂肪酸浓度,而对血清总胆固醇无显著影响,灌胃处理的作用大于注射处理。被动免疫对动物血液中游离脂肪酸、甘油三酯和胆固醇的影响不一。这可能是因为血脂水平最终取决于脂肪细胞中脂肪的动员和其他组织对血脂的利用。
机体脂肪代谢受血液激素水平的影响,其中胰岛素可以促进脂肪的合成。本试验中卵黄抗体注射处理对血清胰岛素水平无显著影响,这与Moloney[7]和唐宝定等的结果一致。Moloney认为抗体可能是作用于脂肪细胞上的受体,增加脂肪细胞对胰岛素的抗性,从而降低脂肪沉积。而本试验中灌胃处理降低了胰岛素水平,提示胰岛素减少也是抗体降脂作用的机理之一。Leptin作为脂肪组织分泌的激素,在一定程度上可反映体脂沉积程度,它不仅抑制摄食,在能量平衡中起重要作用,还参与激发细胞凋亡调节脂肪细胞数量。本试验中卵黄抗体处理降低了血清 Leptin水平,与 Flint在大鼠上的结果一致[8],这可能与脂肪组织减少有关,至于Leptin在卵黄抗体免疫过程中与脂肪组织减少的因果关系还有待于进一步研究。肿瘤坏死因子α(TNF-α)可抑制脂肪细胞的分化和脂肪合成,刺激脂肪分解,并引起脂肪细胞凋亡[9]。本试验中卵黄抗体处理改变了血清TNF-α水平,提示TNF-α参与了卵黄抗体对脂肪沉积的调节。
几乎所有的试验结果都表明,动物经脂肪细胞膜蛋白抗体免疫后其脂肪沉积率有不同程度的降低,而抗体处理对动物体增重、摄食量、血脂浓度、血清激素等的影响报道不一,这可能与抗体性质、免疫方式及时间、被免疫动物种类有关。本试验中,灌胃处理降低TNF-α水平,注射处理却提高TNF-α水平,以及二种处理对血清游离脂肪酸浓度、腓肠肌生长的不同影响,表明卵黄抗体不同的给予途径可能有不同的作用机制。
[1]Flint D J.Immunological manipulation of adiposity[J].Biochem Soc Trans,1996,24(2):418-422.
[2]Futter C E,Panton D,Kestin S,et al.Mechanism of action of cytotoxic antibodies to adipocytes on adipose tissue,liver and food intake in the rats[J].IntJ Obesity,1992,16(8):615-622.
[3]Jiang J P,Zhou J,Chen J,et al.Effect of Chicken Egg YolkAntibody against Adipocyte Plasma Membranes on Carcass Composition and Lipogenic Hormones and Enzymes in Pigs[J].Livestock Sci,2007,107(2-3):235-243.
[4]Panton D,Futter C,Kestin S,et al.Increased growth and protein deposition in rats treatedwith antibodies to adipocytes[J].Am J Physiol,1990,258(6):E985-989.
[5]KestinS,Kemedy R,Tonner E,et al.Decreased fat content and increared lean in pigs treated with antibodies to adipocyte plasma adipocytes[J].J Anim Sci,1993,71(6):1486-1494.
[6]Gassmann M,Thommes P,Weiser T,et al.Efficient production of chicken egg yolk antibodies against a conserved mammalian protein[J].FASEB J,1990,4(8):2528-2532.
[7]Moloney A P.Immunizing against adipose plasma membranes to reduce body fat:effects on plasma metabolites and insulin[J].Biochem Soc Trans,1990,18(2):336-337.
[8]Flint D J.Effectsof antibodies to adipocytes on body weight,food intake,and adipose tissue cellularity in obese rats[J].Biochem Biophys Res Commun,1998,252(1):263-268.
[9]Prins J B,Niesler C U,Winterford C M,et al.Tumor necrosis factor-αinduces apoptosis of human adipose cells[J].Diabetes,1997,46(12):1939-1944.

