硫化氢对急性心肌缺血大鼠心肌线粒体损伤的影响*
刘 芳,张建新,李兰芳,张勤增,丁艳艳,张新艳
(河北省医学科学院药研室,石家庄 050021)
心肌缺血指冠状动脉供血绝对或相对不足或冠状动脉供血中断而导致心肌急性暂时性的或者持久性的缺血缺氧,从而导致心肌功能紊乱并伴有严重的细胞损伤;然而在心肌细胞的损伤和死亡中,线粒体首当其害。线粒体是生物能量代谢的重要场所,对维持细胞的功能和代谢具有重要作用。硫化氢(hydrogen sulfide,H2S)为一种小分子气体,具有不通过受体发挥作用、由内源性关键酶调节生成、生理浓度时具有特殊作用等特点,是一种新型气体信号分子[1],在机体内发挥着调节生理及病理生理的重要作用。研究显示,硫氢化钠后处理可以调控缺氧/复氧心肌细胞线粒体渗透性转换,阻止线粒体渗透性转换孔开放,减轻缺氧/复氧造成的心肌细胞损伤[2]。而H2S对急性心肌缺血大鼠心肌线粒体是否存在影响有待探讨。本实验研究旨在通过建立大鼠急性心肌缺血模型,观察H2S对急性心肌缺血大鼠心肌线粒体结构和功能的影响,探讨H2S对急性心肌缺血大鼠线粒体损伤的保护作用。
1 材料与方法
1.1 动物与药品
雄性SD大鼠(250~300g)由河北省实验动物中心提供。NaHS和PPG均购自美国Sigma公司;甲氮甲唑兰(MTT)购自北京索莱宝科技有限公司;ATP酶、MDA、SOD和GSH-PX测定试剂盒均购自南京建成生物工程研究所;其余均为国产分析纯试剂。
1.2 实验动物分组及模型制备
健康雄性SD大鼠48只,随机分为6组(n=8):⑴假手术组(sham)、⑵缺血组(ischemia)、⑶缺血组+NaHS低剂量组(I+L NaHS)、⑷缺血+NaHS中剂量组(I+M NaHS)、⑸缺血+NaHS高剂量组(I+H NaHS)、⑹缺血+PPG组(I+PPG)。SD大鼠腹腔注射10%水合氯醛(350mg/kg)麻醉后取仰卧位固定;消毒后沿胸骨左缘3、4肋间开胸,剪开心包膜,暴露心脏,轻压胸壁将心脏挤出,在室间沟处左心耳下方穿线,结扎左冠状动脉前降支后将心脏回纳入胸腔,记录心电图,观察ST段的改变,ST段抬高≥0.15mv表示造模成功。假手术组:只穿线不结扎;缺血组:于术后3 h时腹腔注射生理盐水(2 ml/kg);缺血+NaHS低、中、高剂量组:分别于术后3 h时腹腔注射0.78、1.56、3.12 mg/kg的NaHS(用前半小时生理盐水新鲜配置,均为2 ml/kg),缺血+PPG组于术后3 h时腹腔注射30mg/kg的PPG(2ml/kg)。各组动物均在术后6 h时经右颈总动脉取血后处死、取材备用。
1.3 观察指标及方法
1.3.1 心肌组织线粒体超微结构观察 术后6 h摘取大鼠心脏,取心尖,4%戊二醛固定,H-7500型透射电镜下观察心肌组织超微结构的变化。
1.3.2 血浆中H2S含量的测定[3]采用去蛋白的方法,在预先准备好的试管中加入0.5 ml 1%醋酸锌后加入0.1ml血浆标本,振荡混匀,再依次加入0.5 ml 20mmol/L对苯二胺盐酸盐和0.4 ml 30mmol/L三氯化铁,室温孵育20min,使之充分显色。加入1 ml 10%三氯醋酸,用蒸馏水补足体积至5ml。6000r/min离心5min,吸取上清液,测上清液在670nm波长处吸光度值,根据NaHS标准曲线计算血浆中H2S的含量,结果以μmol/L表示。
1.3.3 心肌组织中胱硫醚-γ-裂解酶(CSE)活性的测定[3]采用亚甲基蓝方法,取左心室前壁部分组织,在预冷的生理盐水中洗去残血,滤纸吸干。分析天平分别称量所取心肌组织质量,按10%质量体积比加入预冷的磷酸钾缓冲液(50mmol/L,pH 6.8),用电动匀浆器制成匀浆后于4℃、4000r/min离心10min,吸取上清0.3 ml做为反应液,测定心肌组织CSE活性。用分光光度计在波长670nm处检测各样本反应后吸光度值,组织中CSE活性以每毫克组织在单位时间内生成H2S的量表示,单位为mmol/(min◦mg)。
1.3.4 心肌线粒体活力、膜肿胀度,以及总ATP酶、GSH-PX、SOD活性和MDA含量测定 采用差速离心法提取心肌线粒体[4]。取左室前壁组织约0.5 g,剪碎,按1∶9(质量体积比)加入带有冰渣的分离介质A(70mmol/L蔗糖,210mmol/L甘露醇,1 mmol/L EDTA,50mmol/L Tris-HCl pH 7.4)冰浴中匀浆。匀浆液1300r/min离心3 min,取上清,10000r/min离心8min,取沉淀,重新悬浮于介质B(70mmol/L蔗糖,210mmol/L甘露醇,50mmol/L Tris-HCl pH 7.4)中,再以同样速度离心10min后得到的沉淀为心肌线粒体。整个过程控制在1 h以内,温度保持0~4℃。沉淀加入1 ml分离介质B制成线粒体悬液,考马斯亮兰法测蛋白含量。
取新鲜制备的线粒体悬液100μl,加入酶标板微孔中,加入5 g/L甲氮甲唑蓝40μl,30℃继续孵育30min,再加入 100μl异丙醇 20min 后于酶联免疫检测仪570nm比色,OD570值大小表示线粒体活力。
取新鲜制备线粒体,反应前4℃放置。反应缓冲液(蔗糖250mmol/L、KH2PO45 mmol/L、琥珀酸钠3 mmol/L,pH 7.2),加入线粒体悬液,调整线粒体蛋白含量为0.5 mg/ml,于722分光光度计上540nm处测定吸光度数值(OD540)[4],反应条件保持25℃恒温。
ATP酶可分解ATP生成ADP及无机磷,测定无机磷的量可判断ATP酶活性的高低。ATP酶活力单位以每小时分解每毫克组织蛋白产生的无机磷(Pi)的含量(μmol)来表示。具体方法按试剂盒说明书进行。
测定GSH-PX活性测定采用二硫代二硝基苯甲酸比色法,SOD活性测定采用黄嘌呤氧化酶法,MDA含量测定采用硫代巴比妥酸法。具体操作方法按试剂盒说明书进行。
1.4 统计学分析
采用SPSS 13.0统计软件进行分析,所有数据以均数±标准差()表示,组间比较采用方差分析。
2 结果
2.1 电镜观察心肌组织超微结构的变化
假手术组大鼠心肌细胞核周隙稍扩张,肌原纤维排列整齐、清晰;线粒体膜完整,部分轻度水肿,嵴清晰。缺血组大鼠心肌细胞核周隙扩张,核膜部分溶解消失;线粒体嵴和膜排列紊乱,部分溶合,线粒体空泡化,糖原颗粒明显减少。与缺血组相比,缺血+NaHS各组大鼠心肌损伤明显减轻,尤以高剂量组减轻明显,线粒体膜结构完整,仅轻度水肿,嵴清晰,可见糖原颗粒。缺血+PPG组大鼠心肌损伤加重,核质和核周胞质高度水肿,核周肌原纤维消失;线粒体严重肿胀变形,嵴和膜融合消失,空泡样变(图1)。

Fig.1 Pathological changes of ultrastructure of myocardium by electron microscope(×15 k)
2.2 大鼠H2S/CSE体系变化
与假手术组比较,缺血组大鼠血浆H2S含量和心组织中CSE活性降低(P<0.01);与缺血组比较,缺血+NaHS低、中、高剂量组大鼠血浆H2S含量和心组织中CSE活性均升高,缺血+PPG组大鼠血浆H2S含量和心组织中CSE活性均降低(P<0.05或P<0.01,表1)。
Tab.1 Changes of the content of H2S in plasma and the activity of CSE in myocardial tissue of rats(,n=8)
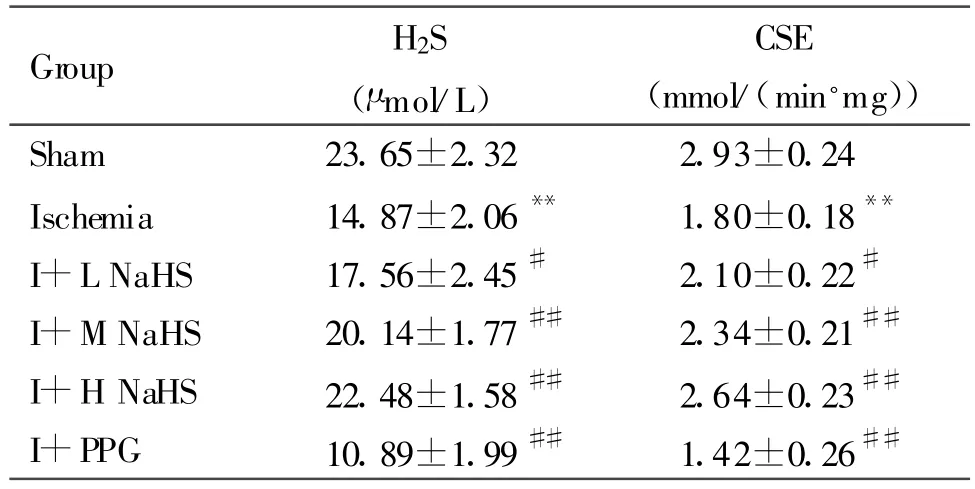
Tab.1 Changes of the content of H2S in plasma and the activity of CSE in myocardial tissue of rats(,n=8)
I+L NaHS:Ischemia+0.78mg/kg NaHS;I+M NaHS:Ischemia+1.56 mg/kg NaHS;I+H NaHS:Ischemia+3.12 mg/kg NaHS;I+PPG:Ischemia+30mg/kg PPG**P<0.01 vs sham;#P<0.05,##P<0.01 vs ischemia
Group H2S(μmol/L)CSE(mmol/(min◦mg))Sham 23.65±2.32 2.93±0.24 Ischemia 14.87±2.06** 1.80±0.18**I+L NaHS 17.56±2.45# 2.10±0.22#I+M NaHS 20.14±1.77## 2.34±0.21##I+H NaHS 22.48±1.58## 2.64±0.23##I+PPG 10.89±1.99## 1.42±0.26##
2.3 H2S对大鼠心肌线粒体活力、膜肿胀度,以及总ATP酶、GSH-PX、SOD活性和 MDA含量
线粒体活力以加入MTT后570nm处吸光度值表示,线粒体膜肿胀表现为540nm处吸光度值下降。与假手术组比较,缺血组大鼠心肌线粒体OD540、OD570值下降(P<0.01)。与缺血组比较,缺血+NaHS中、高剂量组大鼠心肌线粒体OD540值明显高于缺血组(P<0.05或 P<0.01);缺血+NaHS低、中、高剂量组大鼠心肌线粒体OD570值明显高于缺血组(P<0.05或P<0.01);而缺血+PPG组大鼠心肌线粒体OD570、OD540值下降(P<0.05,表2)。
与假手术组比较,缺血组大鼠心肌线粒体中MDA含量明显升高,ATP酶、SOD、GSH-Px活性明显降低(P<0.01)。与缺血组相比,缺血+NaHS中、高剂量组大鼠MDA含量明显减少(P<0.05或P<0.01);缺血+NaHS低、中、高剂量组大鼠ATP酶、SOD、GSH-Px活性明显升高(P<0.05或 P<0.01);缺血+PPG组大鼠心肌线粒体中MDA含量明显升高,ATP酶、SOD、GSH-Px活性明显降低(P<0.05或P<0.01,表2,3)。
3 讨论
随着人们对H2S的深入研究发现,它不再单单是一种对人体有害的气体,而是在体内,尤其是在心血管系统和中枢神经系统中具有重要的生理作用[5]。
我们根据相关文献[3,6,7]以及前期实验和预实验结果,分别在急性缺血3 h后腹腔注射 0.78、1.56、3.12 mg/kg的NaHS及30mg/kg的PPG(CSE酶抑制剂),结果显示在此剂量对急性心肌缺血损伤有较好的治疗或加重作用,因此选择上述剂量分别观察了其对急性心肌缺血的影响。本研究发现,急性缺血后大鼠心肌线粒体明显肿胀,部分空泡状改变,部分破裂溶解;而且血浆中H2S含量和心肌CSE活性降低。给予NaHS后大鼠心肌线粒体损伤减轻,血浆中H2S含量和心肌CSE活性升高;而给予CSE抑制剂PPG后大鼠心肌线粒体损伤加重。提示给予外源性H2S可明显减轻急性心肌缺血时线粒体损伤,进而减轻急性心肌缺血时心肌损伤。
Tab.2 Effect of H2S on the swelling,activity of mitochondria and content of MDA in myocardium mitochondrial in acute myocardial ischemia in rats(,n=8)
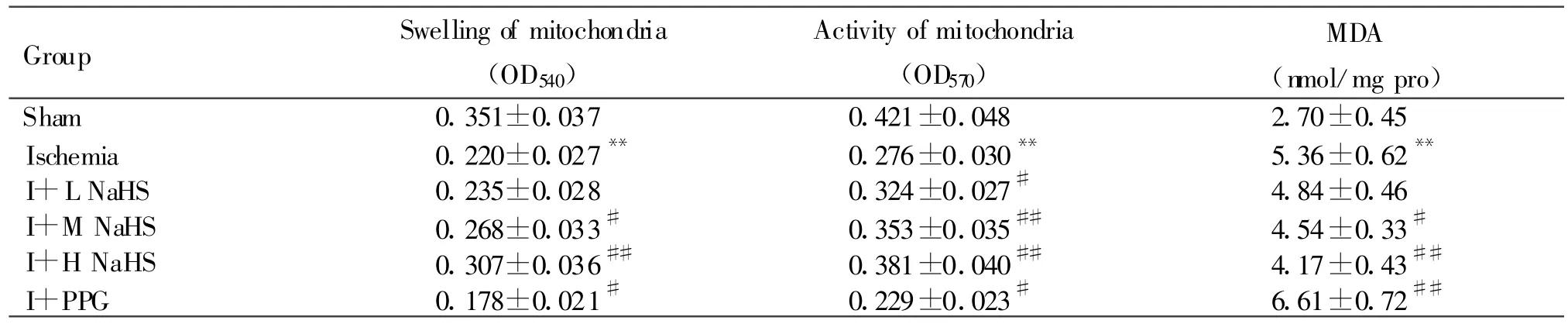
Tab.2 Effect of H2S on the swelling,activity of mitochondria and content of MDA in myocardium mitochondrial in acute myocardial ischemia in rats(,n=8)
I+L NaHS:Ischemia+0.78mg/kg NaHS;I+M NaHS:Ischemia+1.56mg/kg NaHS,I+H NaHS:Ischemia+3.12 mg/kg NaHS;I+PPG:Ischemia+30mg/kg PPG**P<0.01 vs sham;#P<0.05,##P<0.01 vs ischemia
Group Swelling of mitochondria(OD540)Activity of mitochondria(OD570)MDA(nmol/mg pro)Sham 0.351±0.037 0.421±0.048 2.70±0.45 Ischemia 0.220±0.027** 0.276±0.030** 5.36±0.62**I+L NaHS 0.235±0.028 0.324±0.027# 4.84±0.46 I+M NaHS 0.268±0.033# 0.353±0.035## 4.54±0.33#I+H NaHS 0.307±0.036## 0.381±0.040## 4.17±0.43##I+PPG 0.178±0.021# 0.229±0.023# 6.61±0.72##
Tab.3 Effect of H2S on activities of mitochondria ATPase,SOD,GSH-Px in myocardium mitochondria in acute myocardial ischemia in rats(,n=8)
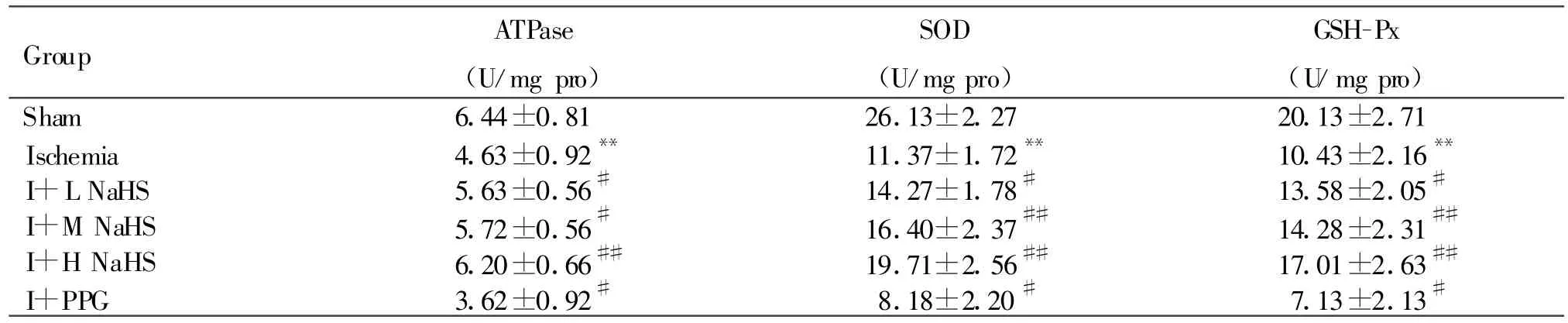
Tab.3 Effect of H2S on activities of mitochondria ATPase,SOD,GSH-Px in myocardium mitochondria in acute myocardial ischemia in rats(,n=8)
I+L NaHS:Ischemia+0.78mg/kg NaHS;I+M NaHS:Ischemia+1.56 mg/kg NaHS;I+H NaHS:Ischemia+3.12mg/kg NaHS;I+PPG:Ischemia+30mg/kg PPG**P<0.01 vs sham;#P<0.05,##P<0.01 vs ischemia
Group ATPase(U/mg pro)SOD(U/mg pro)GSH-Px(U/mg pro)Sham 6.44±0.81 26.13±2.27 20.13±2.71 Ischemia 4.63±0.92** 11.37±1.72** 10.43±2.16**I+L NaHS 5.63±0.56# 14.27±1.78# 13.58±2.05#I+M NaHS 5.72±0.56# 16.40±2.37## 14.28±2.31##I+H NaHS 6.20±0.66## 19.71±2.56## 17.01±2.63##I+PPG 3.62±0.92# 8.18±2.20# 7.13±2.13#
线粒体是真核生物细胞内的一种重要而独特的细胞器,是生物能量代谢的重要场所。心肌为高代谢组织,心肌细胞线粒体含量占细胞容积的30%以上,以适应其较高的能量需求。因此,心肌细胞线粒体的功能状态对心肌缺氧耐受性及缺氧后收缩功能恢复至关重要。
生理状态下,线粒体SOD,GSH-Px含量丰富,可及时清除代谢产生的氧自由基;而心肌缺血后产生大量的氧自由基,可造成线粒体SOD,GSH-Px消耗增多而活性降低,同时还可使线粒体内MDA含量升高,而MDA可与线粒体的膜脂、膜蛋白形成交联,使膜流动性降低[8],进而影响线粒体的电子传递和磷酸化过程,导致ATP酶活性下降,使ATP合成减少,影响细胞的功能。此外,氧自由基还可损伤线粒体膜,引起线粒体膜通透性改变,导致线粒体内Ca2+超载,而氧自由基、Ca2+超载等又能诱导线粒体膜通透性改变,形成恶性循环,加重损伤。缺血预处理可改善大鼠离体心脏缺血再灌注心肌线粒体的功能[9],可能通过激活线粒体KATP通道,保护线粒体的结构和功能,阻止过度的线粒体基质收缩,提高线粒体再灌注期间氧化磷酸化效能,减少缺血期高能磷酸化合物丢失,从而减轻缺血再灌注心肌的损伤[10]。本研究发现,急性心肌缺血后心肌线粒体膜肿胀,活力下降,MDA含量升高,而心肌线粒体ATP酶、SOD和GSH-Px的活性减弱,这表明急性心肌缺血后心肌线粒体能量供应受损。而给予NaHS后,减轻了心肌线粒体膜肿胀,使线粒体活力有所恢复,并且增强了心肌线粒体ATP酶、SOD和GSH-Px的活性,降低了线粒体脂质过氧化产物MDA水平,从而保证线粒体的正常氧化和产能功能,明显减轻心肌缺血损伤;而给予胱硫醚-γ-裂解酶抑制剂PPG后心肌线粒体膜肿胀加重,活力进一步下降,且线粒体中MDA含量升高,而ATP酶、SOD和GSH-Px的活性减弱,再次证明H2S对急性心肌缺血时心肌线粒体有保护作用。
总之,急性心肌缺血时大鼠心肌线粒体结构和功能受损,给予外源性H2S可增强心肌线粒体ATP酶、SOD、GSH-Px的活性,降低线粒体脂质过氧化水平,从而起到对急性心肌缺血大鼠心肌的保护作用。
[1]Wang R.Two's company,three's acrowd:can H2S be the third endogenousgaseous transmitter[J].FASEBJ,2002,16(13):1792-1798.
[2]汪 莉,徐 钢,季 永,等.硫氢化钠后处理对缺氧/复氧心肌细胞线粒体渗透性转换的影响[J].中国药理学通报,2008,24(12):1610-1614.
[3]王 平,张建新,李兰芳,等.硫化氢对大鼠内毒素性急性肺损伤的影响[J].中国药理学通报,2008,24(9):1232-1236.
[4]解丽君,张建新,李兰芳.异丙酚对离体大鼠心肌缺血/再灌注损伤后细胞凋亡及其机制研究[J].中国应用生理学杂志,2008,24(1):56-61.
[5]Hu X,Li T,Bi S,et al.Possible Role of HydrogenSulfide on the Preservation of Donor Rat Hearts[J].Transplantat Proc,2007,39(10):3024-3029.
[6]Zhu Y Z,Wang Z J,Ho P,et al.Hydrogen sulfide and its possible rolesinmyocardial ischemia inexperimental rats[J].J Appl Physiol,2007,102(1):261-268.
[7]徐 钢,季 永,汪 莉,等.内源性硫化氢参与缺血后处理减轻离体大鼠心脏缺血/再灌注损伤[J].中国药理学通报,2008,24(7):910-914.
[8]Oddis C V,Finkel M S.Cytokine-stimulated nitric oxide production inhibits mitochondrial activity in cardiac myocytes[J].Biochem Biophys Res Commun,1995,213(3):1002-1009.
[9]张 琼,喻 田,傅小云,等.缺血预处理对大鼠离体心脏心肌线粒体功能的影响[J].中华麻醉学杂志,2007,27(8):745-747.
[10]Korge P,Honda H M,Weiss J N.K+-dependent regulation of matrix volume improves mitochondrial function under conditions mimicking ischemia-reperfusion[J].Am J Physiol Heart Circ Physiol,2005,289(1):H66-77.

