肥厚型梗阻性心肌病围术期心律失常特点及治疗策略*
崔彬,许建屏,王巍,吕锋,王水云,熊辉
未经治疗的肥厚型梗阻性心肌病(HOCM)患者年死亡率1.7%~4%,多数为猝死,常见于恶性室性心律失常,自然预后差[1]。近年来,HOCM的外科治疗取得显著的进步,室间隔肥厚心肌切除术是缓解流出道梗阻可靠的治疗方法,但心律失常是常见的术后并发症。本文分析了在我院76例行外科手术治疗的HOCM患者,以期发现围术期心律失常特点及其防治策略。
1 对象与方法
对象:入选了1996-10至2009-12在我院外科住院行外科手术治疗的76例HOCM患者,男51例,女25例,平均年龄37.18±15.85(6~68)岁,平均体重60.37±13.56(27~94)kg。患者常常因活动后心悸气促或心前区不适就诊,大部分患者服用钙通道阻滞剂或β受体阻滞剂,但因症状不能控制而行手术治疗。
方法:术前患者行超声心动图、心电图(其中13例患者行动态心电图检查)、X线胸片、磁共振成像等常规检查。76例患者在全麻低温体外循环下行矫治术。经典Morrow技术室间隔切除范围:右侧在右冠窦中点右方2~3mm,向左冠窦方向10~12mm宽,长度45mm,为彻底消除二尖瓣前瓣收缩期前向运动(SAM)现象,一般切到二尖瓣乳头肌根部。改良Morrow技术较经典Morrow技术切除范围大,包括膜部下方的室间隔[2,3]。其中4例患者术中经食道超声心动图示左心室流出道狭窄解除不满意,二次转机行左心室流出道扩大室间隔肥厚肌束切除术。术毕常规留置心表临时起搏器。同期行冠状动脉旁路移植术7例,二尖瓣置换术14例,二尖瓣成形术12例,主动脉瓣置换5例,三尖瓣成形术3例,动脉导管切缝术2例,主动脉瓣下隔膜切除术1例,升主动脉及部分弓置换1例。
术后处理:严密监测心电图及血流动力学变化,13例严重心律失常患者行动态心电图检测;保证适当的心脏前负荷;清醒拔出气管插管后,术后早期根据心率(>90次/分)、血压变化服用小剂量β受体阻滞剂或钙通道阻滞剂,将心率控制到70次/分左右。出现房性或室性快速心律不齐时可静脉泵入小剂量乙胺碘肤酮[2~8 μg/(kg·min)]治疗,对顽固性心房颤动患者心律稳定后可继续服用乙胺碘肤酮维持治疗3~6月;术后如出现Ⅲ度房室传导阻滞,心率低于60次/分建议安装永久起搏器。
2 结果
全组平均体外循环时间90.62±48.53(25~290)min,主动脉阻断时间83.25±42.99(20~204)min,气管插管时间17.08±15.82(5~168)h,重症监护病房住院时间46.53±36.59(8~183)h,术后住院时间9.07±3.32(6~23)天。出院时超声心动图检查:与术前相比,左心房内径显著减小[术前(42.40±7.72)mm,术后(35.26±8.45)mm,P <0.01]、左心室内径显著减小[术前(42.74±6.75)mm,术后(40.41±5.79)mm,P<0.05]、左心室流出道压差显著下降[术前(99.73±38.61)mmHg(1mmHg=0.133 kPa),术后(23.55±16.53)mmHg,P <0.01]、室间隔厚度变薄[术前(26.23±5.24)mm,术后(18.33±4.74)mm,P<0.01]、左心室射血分数较术前有所下降(术前0.70±0.09,术后0.62±0.08,P <0.05),但仍在正常范围内。
心律失常类型及发生率:术前心电图异常表现呈多样性,无显著特异性;其中16例患者有阵发性晕厥症状(3例患者心电图示阵发性室性心动过速,3例患者示偶发室性早搏,7例患者示病理性Q波,另3例大致正常)。术后早期心电检测有16例患者出现阵发性或持续性心房颤动,在保证心脏前负荷的前提下,给予小剂量乙胺碘肤酮或β受体阻滞剂,其中9例患者转为窦性心律,1例患者出现顽固性室上性心律失常,快速心房颤动、心房扑动,合并低心排血量综合征,另6例仍为心房颤动。有4例患者术后因Ⅲ度房室传导阻滞且心率低于60次/分安装永久性起搏器,术后患者恢复良好。术后出院时心电图检查(其中15例患者行动态心电图检查)主要异常心律失常表现为传导系统异常(其中完全性左束支传导阻滞40例,室内传导阻滞8例,Ⅲ度房室传导阻滞7例。术前合并完全性右束支传导阻滞的5例患者,术后3例合并Ⅲ度房室传导阻滞,均安装起搏器)、心房颤动(7例)、偶发室性早搏(7例)、窦性心动过速(7例)。(表1)
全组死亡4例,死亡率5.3%(4/76)。死亡原因:顽固性心律失常、快速心房颤动、心房扑动合并低心排综合征1例;Ⅲ度房室传导阻滞合并低心排血量综合征1例;感染性休克合并急性肾功能不全1例;急性肾功能衰竭1例。
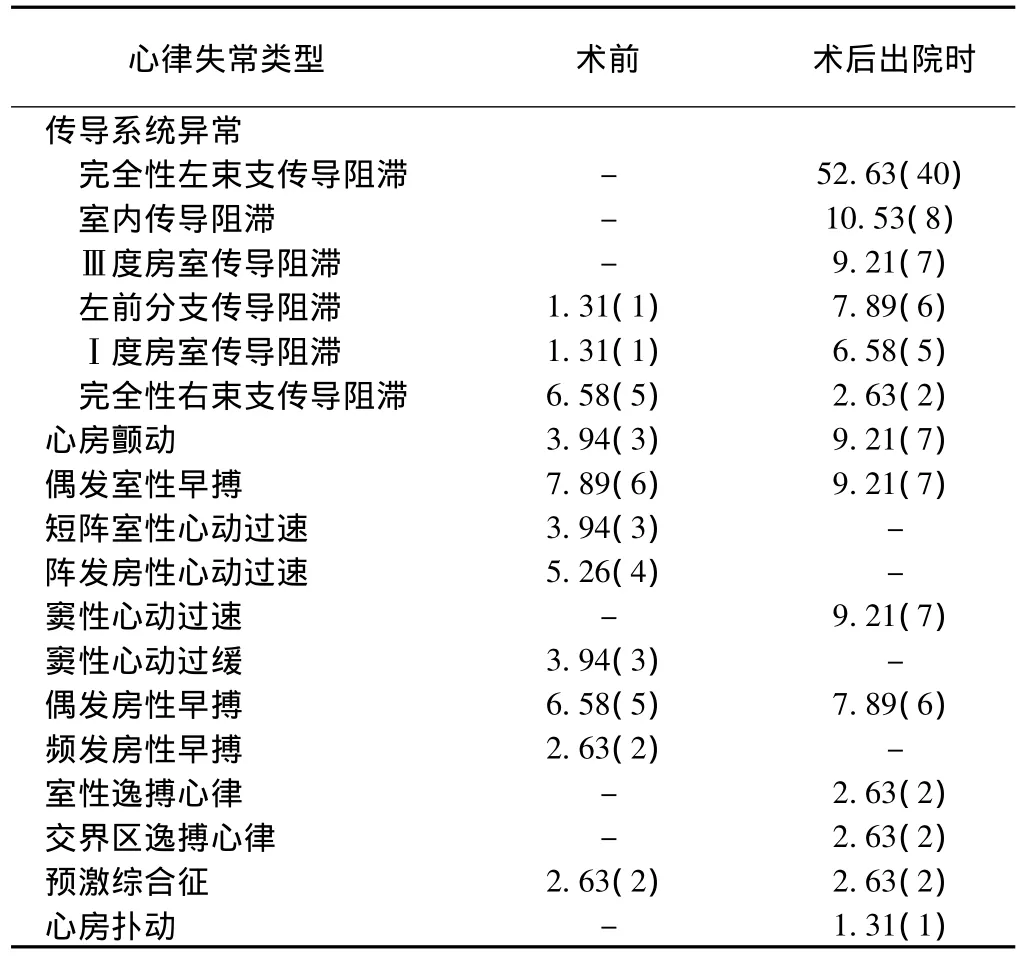
表1 术前及术后出院时心律失常类型及发生率[%(例)]
72例生存患者均痊愈出院,除5例失访外,余67例患者术后随访1月~13年,无远期死亡、并发症及再次手术,患者症状均明显减轻,纽约心功能分级(NYHA)Ⅰ~Ⅱ级,生活质量提高。超声心动图随访左心房较术前显著减小,左心室射血分数明显提高,室间隔无继发性肥厚。
3 讨论
心肌细胞肥大及其相互间连接的紊乱、微血管缺血、自主神经功能异常等HOCM典型的病理生理改变导致HOCM患者电生理特性的不稳定性,且肥厚心肌纤维排列紊乱易导致折返形成,常导致致命性心律失常。HOCM患者心电图异常表现呈多样性,无显著特异性。5% ~10%的HOCM患者表现为心房颤动,年龄大、左心房大、左心室舒张功能受损是HOCM患者心房颤动发生的重要危险因素,且HOCM患者对持续性心房颤动的耐受性较差,血栓发生率较高,是预测与心力衰竭相关的死亡、卒中和进行性心功能障碍的独立危险因素。少数患者表现为右束支或室内传导阻滞,左束支阻滞较少见。电生理检查窦房结功能异常和房室传导阻滞的发生率较正常人高[4,5]。
HOCM的药物治疗主要是阻断肾上腺素介导的心室收缩,提高心室收缩末容积,有助于心室充盈降低流出道梗阻的发生,主要有β受体阻滞剂和钙离子拮抗剂。但药物治疗对部分患者难以缓解症状,也不能预防心律失常性猝死的发生。HOCM患者如伴室性早搏或室性心动过速心脏骤停的危险性将显著增加,小剂量乙胺碘肤酮可明显降低室上性或室性心律失常的发生,降低猝死的危险性[6,7]。
室间隔肥厚心肌切除术仍是目前HOCM缓解流出道梗阻最可靠的治疗方法。术后室间隔厚度及左心室流出道压差明显下降,解除了左心室流出道梗阻,避免了突发性心源性死亡[2]。但约20% ~30%的患者术后可发生阵发性心房颤动,少数患者呈持续性心房颤动,HOCM患者心脏顺应性下降,舒张功能受损,左心房、左心室舒张末压升高,如合并持续性心房颤动或心房颤动的急性发作,将进一步加重左心舒张功能障碍,且心脏舒张期缩短,左心室充盈不足,心输出量下降,体循环血压下降,冠状动脉灌注不足,常常导致进行性的心功能不全,容易诱发心力衰竭。患者需要及时有效的药物治疗,在保证心脏前负荷的前提下,用乙胺碘肤酮或β受体阻滞剂,调节节律和心室率,将心室率控制在70次/分左右,可使难治性心房颤动转为窦性心律,至少可使心房颤动心律减慢[8-10]。本组有7例患者出院时仍存在心房颤动可能与术前即存在慢性心房颤动或合并重度瓣膜病变相关。也有的研究表明,对合并慢性或持续性心房颤动的HOCM患者,长期服用小剂量抗凝药物可明显减少血栓栓塞事件的发生率;在室间隔肥厚心肌切除术同时行心房颤动的射频消融术临床疗效满意[11,12]。
HOCM患者合并房室传导阻滞多与室间隔肥厚肌束纤维化或肥厚的室间隔肌束导致传导束缺血损伤有关;室间隔肥厚心肌切除术后房室传导阻滞发生率较高,其原因主要与传导束的走行及肥厚肌束切除范围有关。房室束通过膜部间隔的后下方,肌部间隔的上缘走行,左束支在肌部室间隔的左侧走行,如室间隔肥厚心肌切除范围较大,特别是在右冠瓣中点下方做切口时,向无冠瓣侧偏离过多,容易损伤传导束,严重时导致Ⅲ度房室传导阻滞。如术前合并完全右束支传导阻滞,则术后合并Ⅲ度房室传导阻滞的可能性较大,术前应足够重视,并与家属沟通。本组5例患者术前心电图提示完全右束支传导阻滞,术后3例均合并Ⅲ度房室传导阻滞,另2例合并室内传导阻滞或左前分支阻滞,如心率低于60次/分,患者需要安装永久性起搏器[13,14]。完全左束支传导阻滞术后发生率较高,本组占52.63%(40/76),但 Klein 等[15]研究结果表明,室间隔肥厚肌束切除术后发生完全左束支传导阻滞与无传导异常的患者相比,血流动力学并无显著差别。
[1]Elliott PM,Gimeno JR,Thaman R,et al.Historical trends in reported survival rates in patients with hypertrophic cardiomyopathy.Heart,2006,92:785-791.
[2]Maron BJ.Controversies in cardiovascular medicine.Surgical myectomy remains the primary treatment option for severely symptomatic patients with obstructive hypertrophic cardiomyopathy.Circulation,2007,116:196-206.
[3]Marrow AG.Hypertrophic subaortic stenosis.Operative methods utilized to relieve left ventricular outflow obstruction.J Thorac Cardiovac Surg,1978,76:423-430.
[4]Maron B.Ventricular arrhymias,sudden death and prevention in patients with hypertrophic cardiomyopathy.Curr Card Rep,2000,2:522-528.
[5]Olivotto I,Cecchi F,Casey S,et al.Impact of atrial fibrillation on the clinical course of hypertrophic cardiomyopathy.Circulation,2001,104:2517-2524.
[6]Maron B,Estes N,Maron M.Primary prevention of sudden death as a noval treatment strategy in hypertrophic cardiomyopathy.Circulation,2003,107:2872-2875.
[7]蒋文平.心房颤动药物治疗.中国循环杂志,2005,20(1):3-6.
[8]Robinson K,Frenneanx MP,Stockins B,et al.Atrial fibrillation in hypertrophic cardiomyopathy:a longitudinal study.J Am Coll Cardiol,1990,15:1279-1285.
[9]Toru K,Hiroaki K,Makoto O,et al.Clinical impact of atrial fibrillation in patients with hypertrophic cardiomyopathy:results from kochi RYOMA study.Circ J,2009,73:1599-1605.
[10]Higashikawa M,Nakamura Y,Yoshida M,et al.Incidence of ischemic strokes in hypertrophic cardiomyopathy is markedly increased if complicated by atrial fibrillation.Jpn Circ J,1997,61:673-681.
[11]Callans DJ.Ablation of atrial fibrillation in the setting of hypertrophic cardiomypathy.J Cardiovasc Electrophysiol,2008,19:1015-1016.
[12]Chen MS,McCarthy PM,Lever HM,et al.Effectiveness of atrial fibrillation surgery in patients with hypertrophic cardiomyopathy.Am J Cardiol,2004,93:373-375.
[13]Smedira NG,Lytle BW,Lever HM,et al.Current effectiveness and risks of isolated septal myectomy for hypertrophic obstructive cardiomyopathy.Ann Thorac Surg,2008,85:127-133.
[14]Qin JX,Shiota T,Lever HM,et al.Conduction system abnormalities in patients with obstructive hypertrophic cardiomyopathy following septal reduction interventions.Am J Cardiol,2004,93:171-175.
[15]Klein RM,Schwartzkopff B,Schulte HD,et al.Hemodynamic findings in patients with left bundle branch block after myectomy in hypertrophic obstructive cardiomyopathy(HOCM).Eur J Cardiothorac Surg,1993,7:528-532.

