胰岛素改善糖尿病小鼠骨髓内皮祖细胞动员障碍研究*
董莉,徐标,康丽娜,丁亮,陈琴,高玲
血管内皮功能异常、组织缺血后侧支血管形成障碍是糖尿病患者易患血管闭塞性疾病的重要机制。近年来的研究显示,缺血组织的血管新生及侧支血管形成不仅依赖于成熟血管内皮细胞的分裂增殖,循环中骨髓起源的内皮祖细胞(EPC)也积极参与了这一过程。内源性缺血损伤或者应用细胞因子及药物能够动员骨髓中的干细胞和EPC至外周血,进而参与内皮修复及血管新生[1,2]。血管内皮生长因子(VEGF)/蛋白激酶B/内皮型一氧化氮合酶以及间充质衍生因子1α(SDF-1α)/基质金属蛋白酶-9信号通路在EPC动员过程中发挥重要作用[3,4]。研究也发现糖尿病个体循环中EPC数量减少、治疗性血管新生呈现反应缺陷[5]。我们先前的研究显示糖尿病患者及糖尿病动物组织缺血后骨髓EPC向外周血动员明显减少[6],本研究的主要目的就是进一步探讨骨髓EPC动员障碍的可能机制,并观察胰岛素治疗能否改善这种障碍。
1 材料与方法
糖尿病模型的建立:2007-12至2009-05选取C57BL/6小鼠(南京大学模式动物研究所)8周龄,96只,体重(25.1±1.2)g。参照文献[6]腹腔注射链脲霉素(美国sigma公司)建立糖尿病模型。随机分为糖尿病组和糖尿病胰岛素治疗组(胰岛素组),胰岛素组术前及术后注射胰岛素以纠正高血糖[5]。另取非糖尿病组作对照(各组n=32)。
后肢缺血模型的建立:入组小鼠饲养2个月后,参照文献[6]行左侧股动脉及其大分支结扎离断术,术后通过血管造影及红四氮唑(南京国药集团)染色评估手术效果,确定单侧后肢缺血模型造模成功。
骨髓及外周血单个核细胞分离:于术前及术后不同时间(0、1、3、7 天)采血,利用 Histopaque-1083 密度梯度离心获取外周血单个核细胞。以外科手法暴露股骨及胫腓骨,定量冲洗骨髓,离心后分离上清及骨髓细胞。
外周血早期EPC检测:参照文献[6],重悬外周血单个核细胞,分别加入异硫氰酸荧光素标记的大鼠抗小鼠干细胞抗原1(Sca-1)单克隆抗体、藻红蛋白-花青苷5标记的大鼠抗小鼠干细胞因子受体(c-Kit)单克隆抗体、藻红蛋白标记的大鼠抗小鼠胎肝激酶1(Flk-1)单克隆抗体3种小鼠早期EPC表面标记抗体或同型对照(美国eBioscience公司),4℃避光孵育,孵育结束后采用美国BD公司FACS Calibur流式细胞仪检测,用 Cell Quest软件分析外周血单个核细胞中c-Kit+/Sca-1+/Flk-1+细胞比例,代表外周血早期EPC水平。
血浆及骨髓VEGF、SDF-1α水平测定:酶联免疫吸附法测定血浆及骨髓中VEGF、SDF-1α水平,操作按照检测试剂盒(美国R&D公司)说明书进行。
骨髓细胞VEGF、蛋白激酶B、内皮型一氧化氮合酶及基质金属蛋白酶-9蛋白及其磷酸化产物测定:参照文献[7],免疫印迹法测定骨髓细胞中上述蛋白表达水平[羊抗小鼠 VEGF多克隆抗体1:400(美国Santa Cruz公司),兔抗小鼠蛋白激酶B及其磷酸化单克隆抗体1:2000(美国Eptomics公司),小鼠抗小鼠内皮型一氧化氮合酶及其磷酸化单克隆抗体1:500(美国BD公司),兔抗小鼠基质金属蛋白酶-9多克隆抗体1:15000(英国Abcam公司),小鼠抗小鼠β-肌动蛋白单克隆抗体1:5000(美国BioVision公司)]。用Quantity One图象分析软件(美国BIO-RAD公司)分析,将待测蛋白条带与同一泳道β-肌动蛋白条带光密度比值作为结果。
骨髓基质金属蛋白酶-9酶活性测定:参照文献[7],明胶酶谱法测定骨髓上清基质金属蛋白酶-9酶活性。利用Quantity One图象分析软件分析酶水解条带反转后的光密度值,作为酶活性强度。
统计学分析:应用SPASS11.0软件进行统计学分析,计量数据用x表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,两两比较再用Bonferroni检验。两个连续变量之间的相关性分析采用Pearson线性相关。以P<0.05为差异有统计学意义。
2 结果
小鼠基本生理情况:试验前小鼠体重、血糖3组间比较差异均无统计学意义。体重:手术前糖尿病组较非糖尿病组减低(P<0.01),手术前胰岛素组较非糖尿病组减低(P<0.01);处死前糖尿病组较非糖尿病组减低,胰岛素组较糖尿病组升高(P<0.01),差异均有统计学意义。血糖:手术前糖尿病组较非糖尿病组升高(P<0.01),手术前胰岛素组较非糖尿病组升高(P<0.01);处死前糖尿病组较非糖尿病组升高(P<0.01),胰岛素组较糖尿病组下降(P< 0.01),差异均有统计学意义。(表1)
表1 3组小鼠基本生理情况比较(n=32, x)

表1 3组小鼠基本生理情况比较(n=32, x)
注:与非糖尿病组比较*P<0.01;与糖尿病组比较ΔP<0.01
体重(g)血糖(mmol/L)组别试验前 手术前 处死前非糖尿病组 25.0 ±1.1 31.5 ±2.5 29.6 ±2.0 6.7 ±0.9 6.7 ±1.6 6试验前 手术前 处死前.8 ±1.5糖尿病组 25.2 ±1.3 26.2 ±1.5* 23.3 ±2.3* 6.7 ±1.1 20.4 ±2.3* 20.5 ±2.8*胰岛素组 25.1 ±1.2 25.9 ±1.7* 26.9 ±1.8Δ 6.8 ±0.6 19.9 ±2.5* 7.9 ±1.9Δ
缺血后不同时间外周血EPC数量变化情况(6次实验结果):3组不同时间外周血EPC流式细胞仪检测,术后3天外周血 EPC水平在非糖尿病组为2.98%,糖尿病组为0.97%,胰岛素组为1.98%。由图1可见,与术后0天比较,非糖尿病组术后1、3天外周血EPC数量增加(P<0.01),胰岛素组术后3、7天外周血EPC数量增加(P<0.01),差异均有统计学意义。组间比较:术后0、1、3、7天糖尿病组与非糖尿病组比较外周血EPC数量减少(P<0.01),术后3、7天胰岛素组与糖尿病组比较外周血EPC数量增加(P<0.01),差异均有统计学意义。
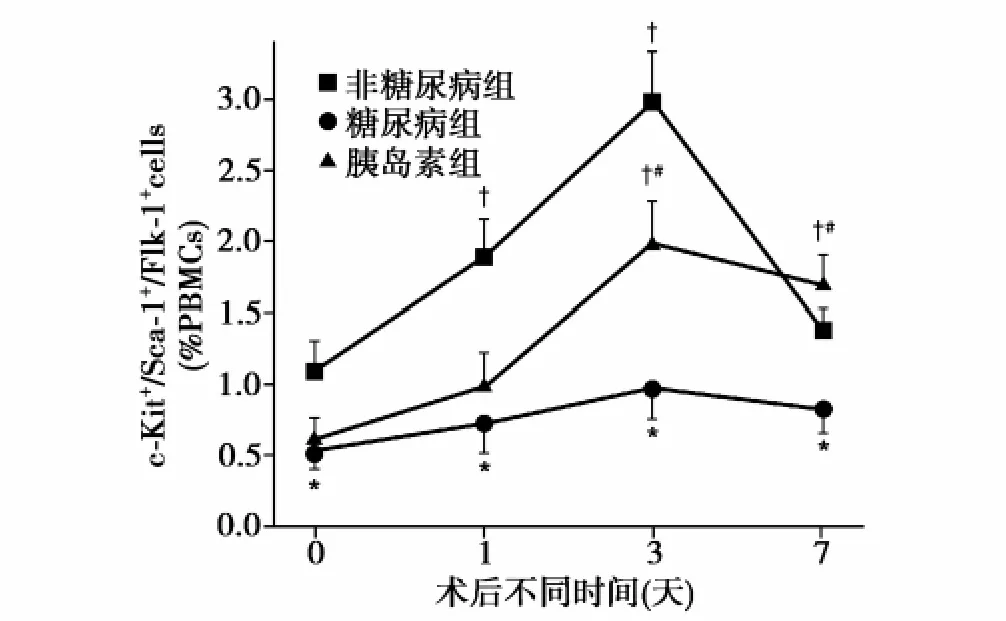
图1 术后不同时间各组外周血内皮细胞数量变化情况 与术后0天比较†P<0.01(n=6);与非糖尿病组比较*P<0.01;与糖尿病组比较#P<0.01。c-Kit:干细胞因子受体 Sca-1:干细胞抗原-1 Flk-1:胎肝激酶-1 PBMCs:外周血单个核细胞
胰岛素治疗改善糖尿病小鼠缺血诱导的血浆VEGF及SDF-1α释放抑制:与外周血骨髓EPC动员的变化趋势一致,高峰期糖尿病组血浆VEGF及SDF-1α释放水平较非糖尿病组明显减低[VEGF:(85±12)pg/ml比(164 ±15)pg/ml,P <0.01;SDF-1α:(731±26)pg/ml比(1267 ±87)pg/ml,P <0.01];胰岛素组血浆VEGF及SDF-1α释放水平较糖尿病组分别增加1.6及1.3倍[VEGF:(139±19)pg/ml比(85±12)pg/ml,P <0.01;SDF-1α:(972 ±40)pg/ml比(731 ±26)pg/ml,P <0.01],差异均有统计学意义。
胰岛素治疗改善糖尿病小鼠骨髓动员相关信号通路的活化障碍:术后3天时,糖尿病组缺血诱导的骨髓SDF-1α及VEGF释放水平较非糖尿病组明显减低[SDF-1α:(920±118)pg/ml比(1800±124)pg/ml,P <0.05;VEGF:(91 ±12)pg/ml比(223 ± 21)pg/ml,P <0.05];蛋白免疫印迹检测结果显示,糖尿病组缺血术后骨髓细胞VEGF上调受抑制,且蛋白激酶B及内皮型一氧化氮合酶磷酸化水平较非糖尿病组明显减弱[VEGF:(0.18 ±0.06)比(0.45 ±0.07),P <0.05;磷酸化蛋白激酶 B:(0.22 ±0.07)比(0.75 ±0.05),P <0.05;磷酸化内皮型一氧化氮合酶:(0.50 ±0.07)比(1.45 ±0.25),P <0.05];此外,糖尿病组缺血诱导的基质金属蛋白酶-9蛋白表达及其酶活性较非糖尿病组明显减低[基质金属蛋白酶-9 蛋白水平:(0.27 ±0.06)比(0.88 ±0.07),P<0.05;酶活性/μg蛋白:(260 ±24)比(480 ±52),P<0.05],差异均有统计学意义;单变量线性回归分析表明,糖尿病组骨髓基质金属蛋白酶-9酶活性受抑与其循环中 EPC水平减低相关(r=0.87,P<0.01)。胰岛素组缺血早期骨髓中SDF-1α及VEGF水平、骨髓细胞蛋白激酶B与内皮型一氧化氮合酶磷酸化水平及基质金属蛋白酶-9酶活性较糖尿病组明显增强(P<0.05),差异均有统计学意义。
3 讨论
循环中的EPC可通过动员归巢、分化增殖、迁移整合等机制参与各种生理及病理状态下的成体血管新生[1,2],因此,缺血损伤后骨髓EPC 向外周血动员障碍可能是阻碍糖尿病个体代偿性血管新生及侧支形成的重要原因。
然而影响糖尿病骨髓EPC动员的机制目前仍未清楚。本研究发现,糖尿病动物缺血早期SDF-1α及VEGF的上调显著受抑制,并伴随其骨髓组织下游信号分子活化障碍。组织缺血缺氧发生后,损伤部位缺氧诱导因子1α诱导VEGF及SDF-1α的表达与释放。在骨髓组织中,增多的VEGF与骨髓细胞表面受体结合后进一步激活磷脂酰肌醇3-激酶/蛋白激酶B/内皮型一氧化氮合酶/一氧化氮信号途径,导致一氧化氮合成与释放增加[3]。一氧化氮进而诱导活性基质金属蛋白酶-9释放,后者促进EPC在骨髓内募集并向外周血迁移[4]。SDF-1α亦可通过诱导蛋白激酶B/内皮型一氧化氮合酶/基质金属蛋白酶-9信号通路活化机制促进骨髓EPC动员、并归巢至损伤部位参与组织血管修复[4,9]。然而糖尿病时生成增加的氧化代谢毒物和高血糖本身可阻碍上述信号通路级联激活,导致一氧化氮生物利用度降低以及基质金属蛋白酶-9失活[8]。因此,糖尿病状态下缺血诱导的SDF-1α与VEGF信号通路活化受损可能是造成骨髓EPC向外周血动员障碍的重要机制之一。
Humpert等[9]报道,胰岛素治疗增加2型糖尿病患者循环中CD34+/133+内皮祖细胞水平,并且胰岛素的这种动员作用受到SDF-1调控。同样地,我们发现,胰岛素治疗有效促进糖尿病小鼠组织缺血后骨髓EPC动员;同时胰岛素明显提高实验动物缺血诱导的血管活性因子SDF-1α及VEGF释放水平、并促进骨髓动员相关信号通路级联活化。这些功能改善一方面可能源于胰岛素的直接诱导作用[10],另一方面可能通过降低高血糖、减轻氧化应激,从而恢复缺氧敏感系统活化。因此,我们认为胰岛素治疗可能通过恢复缺血诱导的SDF-1α/VEGF相关信号通路活化机制,从而改善糖尿病小鼠骨髓EPC动员障碍。
[1]Asahara T,Masuda H,Takahashi T,et al.Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization.Circ Res,1999,85:221-228.
[2]Hiasa SK,Ishibashi M,Ohtani K,et al.Gene transfer of stromal cellderived factor-1α enhances ischemic vasculogenesis and angiogenesis via vascularendothelialgrowth factor/endothelialnitric oxide synthase-related pathway.Circulation,2004,109:2454-2461.
[3]Aicher A,Heeschen C,Mildner-Rihm C,et al.Essential role of endothelial nitric oxide synthase for mobilization of stem and progenitor cells.Nature Medicine,2003,9:1370-1376.
[4]Heissig B,Hattori K,Dias S,et al.Recruitment of stem and progenitor cells from the bone marrow niche requiresmmP-9 mediated release of kit-ligand.Cell,2002,109:625-637.
[5]Fadini GP,Sartore S,Schiavon M,et al.Diabetes impairs progenitor cell mobilisation after hindlimb ischaemia-reperfusion injury in rats.Diabetologia,2006,49:3075-3084.
[6]Kang LN,Chen Q,Wang L,et al.Decreasedmobilizationof endothelial progenitor cells contributes to impaired neovascularization in diabetes.Clin Exp Pharmacol Physiol,2009,36:e47-e56.
[7]Thum T,Fraccarollo D,Galuppo P,et al.Bone marrow molecular alterations after myocardial infarction:Impact on endothelial progenitor cells.Cardiovascular Research,2006,70:50-60.
[8]Krankel N,Adams V,Linke A,et al.Hyperglycemia reduces survival and impairs function of circulating blood-derived progenitor cells.Arterioscler Thromb Vasc Biol,2005,25:698-703.
[9]Humpert PE,Neuwirth R,Battista MJ,et al.SDF-1Genotype Influences Insulin-Dependent Mobilization of Adult Progenitor Cells in Type 2 Diabetes.Diabetes Care,2005,28:934-936
[10]He ZH,Opland DM,Way KJ,et al.Regulation of Vascular Endothelial Growth Factor Expression and Vascularization in the Myocardium by Insulin Receptor and PI3K/Akt Pathways in Insulin Resistance and Ischemia.Arteriosclerosis,Thrombosis,and Vascular Biology,2006,26:787-792.

