13C1-DDT的合成及结构表征
吴航宇,柳洪岩,李 蕾,陈大舟
(1.北京化工大学理学院,北京 100029;2.中国计量科学研究院 化学计量与分析科学研究所,北京 100013)
滴滴涕(2,2-bis(p-Chlorophenyl)-1,1,1-trichloroethane,DDT)具有良好的杀虫作用,曾广泛用作农用杀虫剂。由于DDT在自然界难以降解,且易在生物体内通过食物链富集,导致鱼类和鸟类死亡,对人类的健康造成威胁,目前DDT已被禁用[1]。近年来,DDT对海洋环境、土壤、水资源、食品的污染日益引起全球的关注[2-3],各国纷纷建立了相应的分析检测方法,13C1-DDT是分析检测过程必不可少的同位素标准物质,由于进口的13C1-DDT价格昂贵,因此本工作拟采用13C-乙醇和氯苯合成13C1-DDT。
乙醇氯化生成三氯乙醛的传统合成路线是采用光照的自由基取代反应[4],但当光照不充足时得到的产物通常为含一氯、二氯和三氯取代的混合物[4-5],尤其在三氯取代过程中由于空间阻碍难以得到高纯度三氯代产物,并且反应后需要繁琐的提纯。考虑到13C-乙醇价格昂贵,本工作拟采用稀硫酸作为催化剂取代光照。并对产物进行结构鉴定。
1 主要试剂与仪器
傅立叶BRUKER VECTDR22型红外光谱仪(KBr压片):美国PE公司产品;AV 600核磁共振仪(溶剂为CDCl3):德国Bruker公司产品;PYRISI型差示扫描量热仪(DCS,N2保护):美国PE公司产品;MAT 900XL型双聚焦高分辨质谱仪,电子轰击(EI)离子源:美国 Finnigan公司产品。
13C-乙醇(2-13C同位素丰度99%,含水量<6%):美国 Cambridge Isotope Laboratories公司产品;浓硫酸、浓盐酸、二氧化锰、氯苯等为市售分析纯:北京西中化工厂产品;水合三氯乙醛(99%):日本东京化成工业株式会社产品。
2 实验方法
2.1 13C1-DDT的合成
13C1-DDT的合成路线[4]示于图1。
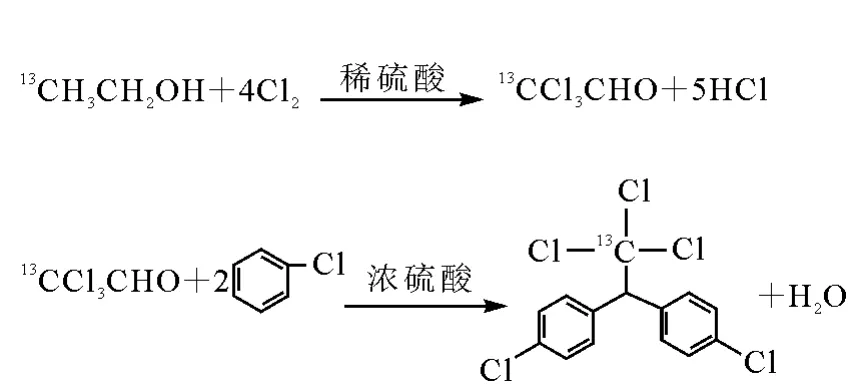
图1 13 C1-DDT的合成路线
2.1.1 由13CH 3CH 2OH制备13CCl3CHO
采用乙醇氯化法制备三氯乙醛。称取50 g二氧化锰,放入250 mL三口烧瓶中,恒压滴液漏斗中加入140 mL浓盐酸,用加热套70℃加热三口烧瓶,调节盐酸滴出的速度约每滴10~20 s,使之均匀产生氯气并通入装有2 g13CH3 CH 2 OH的 30 mL梨形瓶中,其中加入0.1 g稀硫酸(质量分数为10%)作催化剂,加入量为乙醇质量的3%~5%,调节油浴温度加热,回流冷凝。反应分为三个阶段:52~62℃反应2 h,72~85℃反应3 h,92~98℃反应12 h。反应完成后,所得产物为清亮淡黄色透明液体。
2.1.2 由13CCl3CHO制备13C1-DDT
本实验先通过水合三氯乙醛和氯苯对实验过程进行模拟探索,分别研究温度、催化剂用量、反应时间和洗涤次数对DDT产率的影响,探索最佳反应条件。此后将原料替换成13C同位素产品在最佳条件下合成13C1-DDT。
2.1.1 节所得液体冷却后,加入4 mL氯苯和40 mL浓硫酸,15℃恒温电磁搅拌反应5 h。反应完成后,倒入去离子水中静置16 h。抽滤,用Na2CO3中和过多的酸,再用无水乙醇洗涤3次,烘干,称重,计算产率。
2.2 结构表征方法及条件
采用差示扫描量热仪(DSC)分析13C1-DDT的熔点和纯度,质谱(MS)、核磁共振法和傅立叶红外光谱(FT-IR)对产物进行表征。
DSC分析条件:升温范围40~120℃,升温速率 10 ℃/min,载气(N2)流速 1.2 mL/min。质谱法分析条件:电子轰击(EI)离子源,电子能量 70 eV,传输线温度 275℃,离子源温度200℃,激活电压1.5 V,质量扫描范围m/z 35~700。核磁检测法分析条件:液体高分辨NMR 600 MHz,优质核磁管(φ5 mm:0.6 mL或4 cm),CDCl3溶剂。FT-IR检测法分析条件:KBr压片,测定波长 500~3 000 cm-1,参比物为空气,扫描次数32或16。
3 结果与讨论
3.1 合成条件优化
3.1.1 反应温度
反应温度对DDT产率的影响示于图2。由图2可知,反应温度为15℃时,DDT产率最高。该反应为放热反应,反应温度低有利于反应正向进行,但温度太低会使反应速率变慢,产率变低;随着温度升高反应速率加快,但当温度高于25℃时,平衡向反方向移动,产率下降,因此确定反应温度为15℃。
3.1.2 反应时间
理论上,反应时间越长,产率越接近平衡产率。反应时间对DDT产率的影响示于图3。由图3可见,反应到5 h和8 h时产率变化已不明显,从节省时间的角度确定最适宜反应时间为5 h。
3.1.3 浓硫酸用量
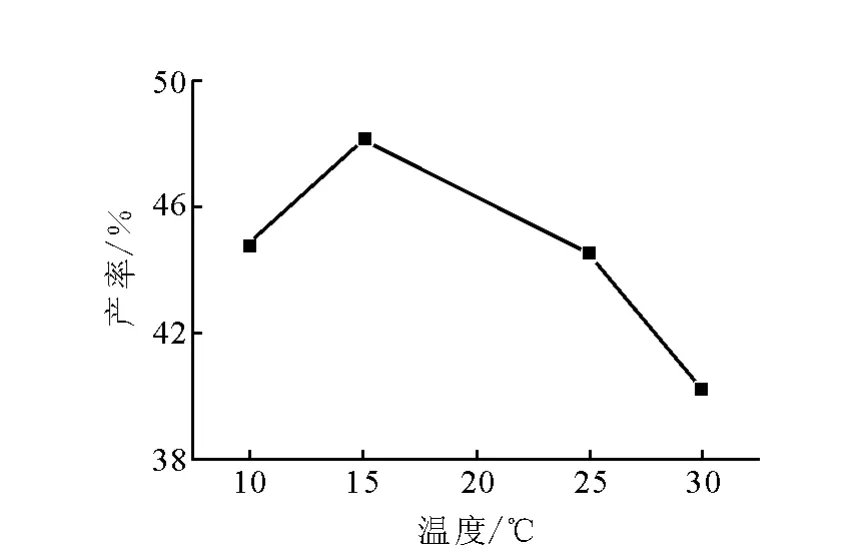
图2 反应温度对DDT产率的影响
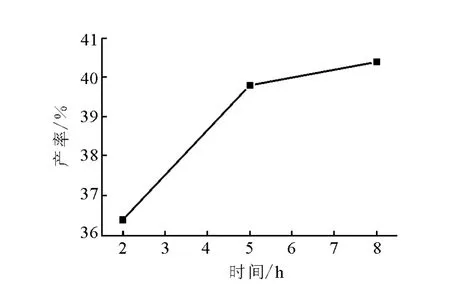
图3 反应时间对DDT产率的影响
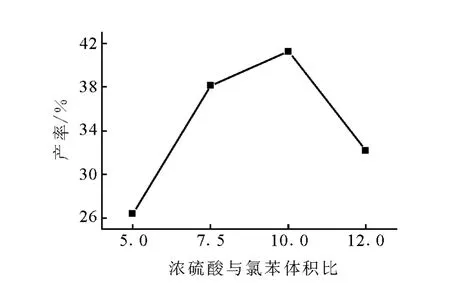
图4 浓硫酸与氯苯体积比对DDT产率的影响
浓硫酸与氯苯的体积比对产率的影响示于图4。浓硫酸用量太少,不能提供足够(H+有助于生成中间体钖盐,使反应更容易进行);浓硫酸用量过多,会使反应原料碳化,影响反应产率。由图4可见,浓硫酸与氯苯体积比为10∶1时,DDT的产率最高,因此选择浓硫酸与氯苯的体积比为10∶1。
3.1.4 洗涤次数
洗涤次数对DDT产率和纯度的影响示于图5。由图5可知,用无水乙醇进行洗涤提纯1~2次时,产率较高但纯度太低,而洗涤4次时,纯度很高但产率大幅降低,因此在兼顾产率和纯度后选择洗涤次数为3次。
综上所述,DDT的最适宜合成条件为:反应温度15℃,反应时间5 h,浓硫酸与氯苯体积比为10∶1,洗涤次数为3次,最适宜条件下合成的DDT产率为51%。
3.2 结构表征
3.2.1 FT-IR分析
合成产物和DDT标准品的FT-IR谱示于图6。
比较图6中合成的产物与DDT标准品的红外谱图可知,合成的DDT与标准品的主要特征峰均吻合。其中,低于3 000 cm-1的吸收峰是饱和C-H键的伸缩振动;1 587 cm-1、1 488 cm-1、1 406 cm-1为苯环的骨架振动;837 cm-1为苯环上的对位二取代;1 093 cm-1为DDT本身的CH 3的氢原子被电负性大的氯原子取代后形成的 CCl3的骨架振动;759~500 cm-1为C-Cl的对称伸缩振动。此结果初步说明产物为DDT。
3.2.2 核磁共振(1H NMR,13C NMR)分析
合成的13C1-DDT和 DDT标准品物的1H NMR谱数据列于表1。
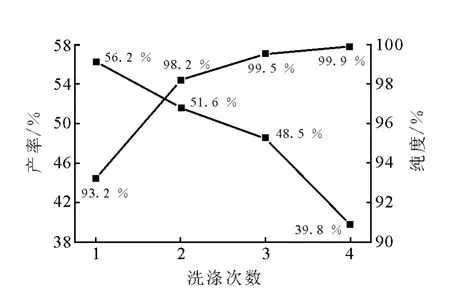
图5 洗涤次数对DDT产率与纯度的影响
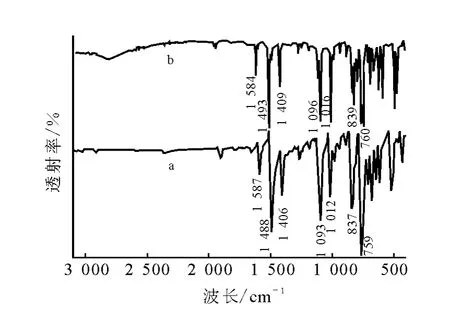
图6 合成产物与DDT标准品的FT-IR谱图a——合成产物;b——DDT 标准品

表1 13 C1-DDT和DDT标准物的1 H NMR结果对比
由表1可知,化合物含有三种类型的氢,且峰面积比约为4∶4∶1,说明三种H的个数比为4∶4∶1。δ7~8中出现的对称四重峰证实了苯环上的对位取代,δ5.03对应于连接两苯环的CH中 H的化学位移,因为受到了相邻基团13CCl3中13C的影响,13C与1H均为磁性核,因而相互之间发生了耦合而裂分成双重峰,且耦合常数为6.71 Hz。上述结果说明,连接三个Cl原子的C原子为13C,合成产物为13C1-DDT。
合成的13C1-DDT和 DDT标准品的13C NMR谱数据列于表2。
由表 2 可知,δ128.64、131.30、134.22和136.17分别归属于对位二取代的苯环上的6个碳原子,δ69.58的碳原子由原来的单峰裂分成双峰,是因为相邻的13CCl中的13C对Ce原子产生耦合,且耦合常数为39.92 Hz。此结果进一步说明合成产物为13C1-DDT。
3.2.3 MS分析
合成的13C1-DDT和DDT标准品的MS分析数据列于表3。

表2 13C1-DDT和 DDT标准品的13 CNMR
由表3可见,13C1-DDT分子离子峰m/z 355,断裂两个Cl原子后则形成m/z 283碎片离子峰,相比非标记 DDT m/z 354和282,两者m/z相差1,这是因为13C同位素的存在。当断裂掉13CCl时,13C1-DDT与非标记DDT形成的碎片离子峰的m/z则相同,可见合成的标记产物为13C1-DDT。由质谱峰相对强度m/z 352为56%,m/z 353为0.3%,可计算得13C的同位素丰度为1-m/z 353/(m/z 353+m/z 352)=99.50%,可满足同位素内标物的需求。
3.2.4 熔点测定
合成产物和DDT标准品的DSC谱图示于图7。DSC法测定纯度是根据熔点的下降来确定杂质的含量[6]。
由图7可知,合成的产物熔点为108.41℃,DDT标准品的熔点为109.85℃,均在DDT熔点范围108~110℃内[7],进一步说明合成产物为 DDT,根据图 7计算产物的化学纯度为99.81%。

表3 13 C1-DDT和DDT标准品的MS部分裂解碎片离子对比

图7 合成产物与DDT标准品的DSC谱图a——合成产物;b——DDT标准品
4 结 论
以13C-乙醇和氯苯为原料,用浓硫酸做催化剂,经过两步反应制备得到了13C1-DDT。产物经过 DSC 、FT-IR、1H NMR、13C NMR、MS 分析表征,结果表明,产物化学纯度>99%,同位素丰度>99%,产率为51%。
[1] 李勇,孙士铸.滴滴涕(DDT)的环境化学行为[J].化学教育,2000,12(5):21-22.
[2] Yugo Nomum,Satoshi Nakai,Masaaki Hosomi.Elucidation of degradation mechanism of Dioxins during mechano-chemical treatment[J].Environ Sci Technol,2005,39:3 799-3 804.
[3] 韩宝华.环境化学[M].北京:中央广播电视大学出版社,2004:26-27.
[4] 李蕾,柳洪岩.碳-13标记DDT的合成与纯化方法:中国,CN200910083619.2[P].2009-05-07.
[5] 王光华.催化氯化法生产三氯乙醛新工艺:中国,01114498.X[P].2003-01-01.
[6] 朱永法,宗瑞隆,姚文清.材料分析化学[M].北京:化学工业出版社,2009:344-345.
[7] Hall AK,Harrowfield JM,Hart RJ.M echanochemical reaction of DDT with calcium oxide[J].Environ Sci Technol,2001,30:3 401-3 407.

