动脉粥样硬化模型小鼠血管平滑肌细胞原代培养及鉴定
刘晶,马坤岭,倪杰,黄文瑾,刘必成,陈压西,阮雄中
(1.东南大学附属中大医院肾内科,江苏 南京 210009;2.重庆医科大学教育部感染性疾病分子生物学重点实验室脂质研究中心,重庆 400016)
血管平滑肌细胞(VSMC)是血管中膜的主要细胞,其舒缩调节着血流和血压,病理情况下VSMC参与动脉粥样硬化、血管再狭窄等的发生、发展[1]。体外培养原代VSMC是近年来一些实验室常用的技术,成为平滑肌细胞功能研究的前提。之前的研究多是从大鼠、兔等动物中分离VSMC。近年来,尽管小鼠作为模式生物在生物医学研究中的优势越来越明显,但分离小鼠原代主动脉平滑肌细胞的报道不多[2]。采用酶消化法获得的原代细胞所需时间短、耗材少,但消化酶受温度和时间的影响大,不如传统的组织贴块法培养稳定。本实验采用组织贴块法成功培养了动脉粥样硬化模型小鼠主动脉VSMC,并对其进行了鉴定。
1 材料与方法
1.1 材料
1.1.1 动物来源 载脂蛋白E基因敲除(ApoE-/-)小鼠,遗传背景为C57BL/6小鼠,是经典的动脉粥样硬化模型小鼠,由重庆医科大学实验动物中心提供,鼠龄8周以上。
1.1.2 主要试剂及配制 水合氯醛(国药集团化学试剂有限公司),磷酸盐平衡液(PBS,武汉博士德公司),DMEM/F12培养基(Gibco公司),青链霉素(Hyclone公司),谷氨酰胺(Sigma公司),胎牛血清(FBS,Gibco公司),重组胎牛成纤维细胞生长因子(R&D公司),0.25% 胰酶(Hyclone公司),肌动蛋白(α-SMA,Abcam公司),免疫组化试剂盒、DAB染色试剂盒(福州迈新公司),Alex488羊抗兔二抗(Invitrogen公司),100%乙醇(上海久亿化学试剂有限公司)。
75%乙醇:取75 ml乙醇至量筒中,加蒸馏水至100 ml。10%水合氯醛:10 g水合氯醛溶于100 ml蒸馏水中,置37℃水浴锅中至完全溶解。20%FBS DMEM/F12培养基:160 ml DMEM/F12中加入40 ml FBS;加100 μl青、链霉素至终浓度分别为 100 U·ml-1和 100 μg·ml-1;加2 mlL-谷氨酰胺至终浓度 2 mmol·L-1;加 8 μl成纤维细胞生长因子至终浓度1 ng·ml-1。
1.2 实验方法
1.2.1 原代细胞培养 10%水合氯醛2 ml腹腔注射麻醉小鼠,浸泡在75%乙醇中。在无菌条件下打开胸、腹腔,暴露心脏;1 ml注射器穿刺右心室,抽出循环中血液,10 ml注射器抽取无菌PBS约8 ml,连接在穿刺左心室的头皮针上,冲洗主动脉;依次剪去胸腹腔器官直至暴露主动脉,完整分离主动脉,放入35 mm无菌平皿中,加入1 ml无菌PBS(pH 7.2),迅速转移至超净台。用镊子小心剥离主动脉外的脂肪组织,至血管光滑透明,PBS缓冲液中漂洗2次。将剥离的血管转入另一个装有3 ml含20%FBS DMEM/F12培养液的35 mm无菌平皿中,用眼科剪剪碎,碎片大小1 mm×1 mm左右。将组织块均匀种植于培养瓶底,翻转培养瓶,加入2 ml含20%FBS的新鲜DMEM/F12培养基;6 h后待组织块牢固贴附于细胞瓶底,再轻轻翻转培养瓶,使组织块完全浸没于培养液中。放入含5%CO2的37℃培养箱,静止培养3 d,观察后换液。
1.2.2 细胞的生长和传代 细胞接种3 d后,贴壁的细胞呈放射性伸展,部分区域已融合生长,立即更换新鲜培养基,弃去没有贴壁的细胞及破碎细胞。当单层细胞铺满近培养瓶底的80%以上时即可进行传代。传代时,弃去旧的培养液,加PBS缓冲液并翻转清洗细胞面,重复3次;加入适量的0.25%胰酶,放入培养箱中消化2~3 min;当显微镜下观察到细胞成片地收缩变圆时,立即加入含血清的培养基终止消化,将细胞自瓶壁上吹打下来,第1次原瓶培养,补足培养液,放入培养箱。5 d后可再传代。
1.3 细胞鉴定
1.3.1 相差显微镜检查 按常规方法观察细胞形态。
1.3.2 α-SMA免疫组化染色 将细胞用胰酶消化、离心,种植在放有载玻片的24孔板中培养。待细胞生长良好,弃培养液,加PBS放于摇床上洗涤3次,每次5 min;弃 PBS,每孔加入 500 μl 4%的多聚甲醛固定30 min;用 PBS洗涤5 min×3次;加入0.25%Triton X-100室温15 min以便抗体更好地进入细胞;用PBS洗涤5 min×3次;用10%山羊血清37℃封闭非特异性抗体30 min,勿洗;加兔抗鼠 α-SMA一抗(1∶100稀释),4℃过夜;PBS洗涤5 min×3次;生物素标记二抗,室温孵育30 min;PBS洗涤5 min×3次;链霉菌抗生物素蛋白-过氧化酶,室温孵育20 min;PBS洗涤5 min×3次;DAB显色剂显色5~10 min,在显微镜下观察,待细胞着色而背景颜色较淡时马上吸去显色液,PBS充分冲洗,苏木素复染1 min,PBS充分清洗后置于普通光镜下观察。
1.3.3 α-SMA免疫荧光染色 将细胞用胰酶消化、离心,种植在放有载玻片的24孔板中培养。待细胞生长良好,弃培养液,加PBS放于摇床上洗涤5 min×3次;弃PBS,每孔加入500 μl 4%的多聚甲醛固定30 min;用 PBS洗涤5 min×3次;加入 0.25%Triton X-100室温15 min以便抗体更好地进入细胞;用PBS洗涤5 min×3次;加入10%山羊血清37℃封闭非特异性抗体60 min;继而加入兔抗鼠 α-SMA一抗(1∶100稀释),4℃过夜;PBS洗涤5 min×3次;荧光标记羊抗兔二抗(1∶1 000稀释)37℃避光孵育2 h;PBS洗涤5 min×3次;加入 DAPI染核,室温避光10 min;PBS洗涤5 min 1次;然后用10%的甘油封片,在荧光显微镜下观察。
2 结 果
细胞接种3 d后可见培养瓶底少数细胞自组织块周围游离出来;5 d后细胞生长迅速,呈典型的峰谷样生长,细胞形体多呈长梭形、核大,可见明显的肌丝纤维(图 1)。免疫组化结果显示,超过98%的 VSMCs α-SMA表达呈阳性,即细胞质内呈现棕黄色反应,胞核呈紫色(图2);免疫荧光结果亦显示,超过98%的VSMCs α-SMA表达呈阳性,即细胞质内呈现绿色,胞核呈蓝色(图3)。
3 讨 论
动脉VSMC是动脉中膜的主要细胞成分,高血压、动脉粥样硬化、肺动脉高压等心血管系统疾病均以VSMC的异常增生和迁移为特征,因此建立简单高效、切实可行的原代VSMC分离培养方法,是研究VSMC在各种因素作用下生物学特性必不可少的环节[3]。

图1 分离培养的原代主动脉平滑肌细胞 ×200Fig 1 Morphology of primary cultured artery VSMCs(×200)

图2 α-SMA免疫组化染色 ×400Fig 2 Immunohistochemistry staining of α-SMA expression in VSMCs(×400)
一直以来,原代平滑肌细胞培养都采用组织贴块培养法和酶消化法,两者各有所长。酶消化法虽然耗时短,获得细胞数目多,但消化酶的选择则因动物种属而异,消化的时间、温度要求较为严格,而且一些胶原酶价格昂贵,实验成本高。组织贴块法是常用的、简便易行和成功率较高的原代培养方法,可避免酶消化法的上述弊端[4]。
在本实验中,我们发现以下几点与实验成功率、分离的细胞数量及纯度密切相关:(1)在解剖镜下撕掉外膜。黑色破布状外膜要撕干净,否则会直接影响分离细胞的纯度,因为外膜的成纤维细胞生长快且能和VSMC竞争营养,这一步需要细致进行。(2)小鼠主动脉细小壁薄,内皮细胞数量少,内膜无须刮除,在传代2次后基本可以排挤掉。(3)由于小鼠的主动脉组织有限,应选择瓶底面积为12.5 cm2的培养瓶,否则细胞密度过低会直接影响细胞的生长速度,导致老化,因为VSMC生长过程中分泌的一些细胞因子会促进自身的生长。
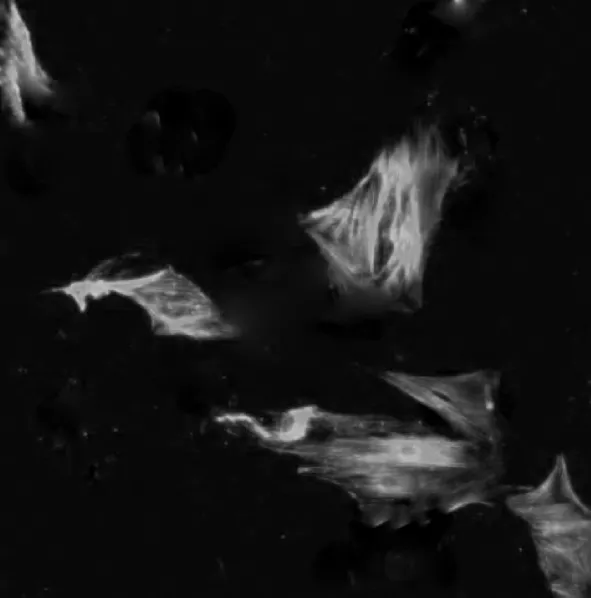
图3 α-SMA免疫荧光染色 ×400Fig 3 Immunofluorescence staining of α-SMA expression in VSMCs(×400)
VSMC 有许多标记分子[1],如 α-SMA[5-6]、心肌肌凝蛋白多肽(SM-MHC)[6]、平滑肌 22α(SM22α)等,常被用以鉴定原代VSMC的纯度和分化状态,而α-SMA为鉴定平滑肌细胞的传统标志物[7-8]。因此我们选择α-SMA对原代培养VSMC进行鉴定。VSMC并非一种终末分化的细胞,在特定的条件下可以发生“表型转换”[1]。体外培养条件下,原代VSMC传代后分化状态是否会改变,可能会直接影响VSMC的体外功能。在应用大鼠的原代VSMC的研究中,应用第3~15代大鼠肺动脉 VSMC[9]或第 11 ~15 代大鼠 VSMC[10]均有报道。而小鼠的VSMC研究中,有采用第3~8代小鼠主动脉VSMC进行研究的报道[5],也有谨慎的学者在分离主动脉VSMC后仅使用第3~5代进行研究[6]。在本实验中,我们应用α-SMA的免疫组化和免疫荧光染色鉴定分离培养的第6代VSMC,98%的细胞都表达α-SMA分子,证明其分化状态没有改变,可用于体外研究。
总之,我们采用的VSMC的原代细胞组织贴块培养法操作简单,结果稳定,纯度较高,重复性好,可作为研究和防治心血管疾病的细胞模型。
[1]OWEN G K,KUMAR M S,WAMHOFF B R.Molecular regulation of vascular smooth muscle cell differentiation development and disease[J].Physiol Rev,2004,84(3):767-801.
[2]张鹏,林福玉,张迎梅,等.小鼠主动脉血管平滑肌原代细胞的分离培养及鉴定[J].生物技术通讯,2010,21(1):54-57.
[3]任立群,张秀云,孙波,等.大鼠胸主动脉平滑肌细胞的组织贴块法培养及鉴[J].吉林大学学报:医学版,2002,28(2):135-136.
[4]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版西安公司,1999:68-73.
[5]CARTA L,SMALDONE S,ZILBERBERG L,et al.p38 MAPK is an early determinant of promiscuous Smad2/3 signaling in the aortas of fibrillin-1(Fbn1)null-mice[J].J Biol Chem,2009,284(9):5630-5636.
[6]LIAO Y B,REGAN C P,MANABE I,et al.Smooth muscle targeted knockout of connexin 43 enhances neointimal formation in response to vascular injury[J].Arterioscler Thromb Vasc Biol,2007,27(5):1037-1042.
[7]RAY J L,LEACH R,HERBERT J M,et al.Isolation of vascular smooth muscle cells from a single murine aorta[J].Methods Cell Sci,2001,23(4):185-188.
[8]XU S W,FU J J,CHEN J W,et al.Development of an optimized protocol for primary culture of smooth muscle cells from rat thoracic aortas[J].Cytotechnology,2009,61(1-2):65-72.
[9] DEATON R A,SU C,VALENCIA T G,et al.Transforming growth factor 1 induced expression of smooth muscle marker genes involves activation of PKN and p38 MAPK[J].J Biol Chem,2005,80(35):31172-31181.
[10]WAMHOFF B R,BOWLES D K,MCDONALD O G,et al.L type voltage gated Ca2channels modulate expression of smooth muscle differentiation marker genes via a Rho Kinase/Myocardin/SRF-dependent mechanism[J].Circ Res,2004,95(4):406-414.

