近红外荧光分子标记的ox-LDL靶向小鼠动脉粥样硬化模型的成像研究
王圆圆,姚玉宇,张毅,文颂,郭静,顾月清
(1.东南大学附属中大医院放射科,江苏 南京 210009;2.中国药科大学生命科学与技术学院,江苏南京 210009)
关于动脉粥样硬化(atherosclerosis,AS)的形成机制,最被广泛接受的是“损伤后反应”学说[1],即内皮细胞损伤引起血管炎症,继而形成泡沫细胞和发生增殖反应。对AS疾病,了解、探讨其发生发展过程及可能机制具有重大意义。本实验通过体外合成近红外荧光分子标记的ox-LDL分子,进行体外巨噬细胞吞噬实验,并采用高脂喂食动脉内皮损伤后的Apo E-/-小鼠,成功建立颈总动脉AS模型,并通过活体7 T MRI、近红外成像及病理组织学对照研究,观察近红外荧光分子探针对小鼠颈总动脉AS的评估价值。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 小鼠RAW 264.7细胞株(上海中国科学院细胞库),ox-LDL(2 mg·ml-1,广州奕源生物科技有限公司),碳青花染料ICG-Der-02(中国药科大学生命科学与技术学院),高糖DMEM培养液(Hyclone公司,美国),胎牛血清(四季青公司),EDTA-胰蛋白酶(Sigma公司,美国),MTT(南京晚晴化学制剂公司)。
1.1.2 动物与饲料 实验动物:Apo E-/-鼠10只[8周龄,雄性,北京大学医学部实验动物科学部,许可证号:SCXK(京)2006-0008],高脂饲料(Western Diet:21%脂肪,0.15%胆固醇,南京协同生物有限公司)。
1.1.3 仪器及药品 CO2培养箱(Herabus,德国),倒置相差显微镜(Zeiss Axiovert25 CFL,德国),紫外分光光度计(Bedkmen,美国),净化工作台(吴江市生化净化设备厂),7 T MRI设备(Bruker,PharmaScan,德国,孔径大小89 mm,射频线圈直径25 mm),近红外成像仪(CRI Maestro系统),异氟烷(山东科源制药有限公司),戊巴比妥钠(南京晚晴化学制剂公司)。
1.2 方法
1.2.1 ox-LDL-ICG-Der-02探针合成 ICG-Der-02是一种吲哚菁绿的衍生物,首先在常温下将其溶解在DMSO溶液中,然后与催化剂EDC/NHS(GL生化有限公司,上海)混合 4 h,(摩尔比值 ICG-Der-02∶EDC∶NHS=1∶1.5∶1.5),缓慢滴入 5 ml ox-LDL 溶液,4 ℃下避光搅拌12 h,在4℃下离心(800×g,5 min),取上清液用PBS透析(分子筛10 kDa)直到游离染料完全透析掉,0.22 μm 过滤器滤过后 4 ℃避光保存[2]。
1.2.2 考马斯亮蓝G-250法测定探针蛋白含量 用标准蛋白浓度(mg·ml-1)为横坐标,用吸光度(A)值为纵坐标,绘出标准曲线,查出样品蛋白质含量。
1.2.3 Raw 264.7细胞吞噬实验 用含10%胎牛血清的高糖DMEM培养液,置入5%CO2、37℃培养箱,当细胞铺满培养瓶底时用含EDTA的0.25%胰酶消化,用含血清的培养液终止消化后离心,倒掉上清,用培养液将细胞稀释至浓度为106个·ml-1,各取2 ml置入6 孔板中,取5 孔分别加入10、20、40、60、80 μl近红外探针,孵育6 h后用PBS冲洗3遍,用近红外仪检测荧光信号强度。
1.2.4 MTT细胞活力检测 收集对数期细胞至96孔板中,调整细胞悬液浓度至103~104个·孔-1,至细胞单层铺满孔底时,分别取细胞对照组、小剂量组及大剂量组,各设5个复孔,小剂量组及大剂量组分别加入10、100 μl·ml-1剂量的探针,5%CO2、37 ℃ 孵育 6 h,倒掉培养液,用PBS冲洗3遍后,加入150 μl培养液进行MTT检测,记录每孔A值,连续60 h,绘制细胞对照组、小剂量组及大剂量组的细胞生长曲线。
1.2.5 颈总动脉粥样硬化模型的建立 8周龄大小Apo E-/-鼠10 只,戊巴比妥钠按 60 mg·kg-1腹腔麻醉后,分离一侧颈总、颈外动脉,从颈外动脉将细金属丝伸至颈总动脉内约15 mm,来回牵拉损伤颈总动脉内膜3次,结扎颈外动脉并缝合创口。
1.2.6 7 T MR扫描 使用小鼠专用床及线圈,采用T2及质子成像序列,进行小鼠颈总动脉斑块的成像。成像参数:MSME-PD-T2WI,TR 2 400 ms,TE 13/65 ms;FOV 2.5 cm,矩阵 256 ×256;分辨率 117 μm ×117 μm ×700 μm,平均激励次数为 4 次,扫描使用压脂技术减少伪影,层厚均为 0.6 mm,层间距为0.7 mm,每序列扫描16层。
1.2.7 体内近红外成像 扫描前用戊巴比妥钠按60 mg·kg-1剂 量 进 行 腹 腔 麻 醉,近 红 外 探 针 按2 μl·g-1剂量进行尾静脉注射,15、30 min 及 1、2、24 h分别进行红外荧光检测。
1.2.8 病理学观察 所有动物在接受近红外扫描后即刻被处死,处死前先暴露游离两侧颈动脉(方法同模型建立),剪开右心房,经左心室注入4%多聚甲醛10 ml,然后注入生理盐水40 ml直至血管冲洗干净,将两侧颈动脉取出,放置在4%多聚甲醛溶液中,血管横断面作冰冻切片,HE染色。
1.2.9 统计学处理 用统计软件 SPSS 15.0处理所有实验数据,求出各组各观察指标的均值和标准差,t检验比较各组各定量指标,P<0.05为差异有统计学意义。
2 结 果
2.1 考马斯亮蓝G-250法测定探针蛋白含量
见图1。
经测算标准函数为:Y=2.579X+0.438(R=0.980,P=0.001),因此测得探针的蛋白浓度为 1.085 mg·ml-1。
2.2 细胞吞噬实验及体外近红外成像结果
2.2.1 细胞形态变化 细胞对照组即未标记探针的细胞呈边缘光整且伪足较少的圆形单核形态,该细胞分裂增殖较快,且细胞活力较强。标记10与20 μl探针后的细胞形态未见明显改变,仍呈圆形(见图2a)。而与标记80 μl探针后的细胞形态比较,发现部分细胞由单核形态转变为多形性巨噬细胞形态,细胞体积增大,伪足较多,且细胞数目亦有所减少(图2b)。
2.2.2 近红外荧光强度结果 见图3。

图1 蛋白质标准曲线

图2 细胞形态 ×400
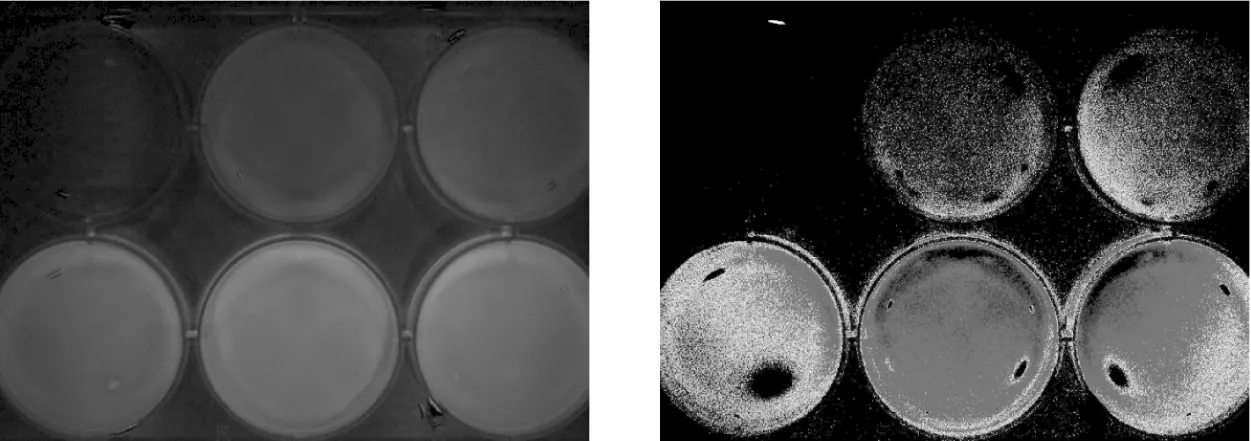
图3 体外细胞近红外荧光成像 从左上至右下分别加入探针 0、0.01、0.02、0.04、0.06、0.08 ml,在剂量为 0.01 ~ 0.06 ml·(2 ml)-1时荧光强度随浓度递增而增加,而剂量为0.08 ml·(2 ml)-1时荧光强度较前有所降低
不同剂量探针孵育细胞后测定其近红外荧光强度,荧光信号亦随之改变,在探针剂量为 0.01~0.06 ml·(2 ml)-1内近似线性关系,而在 0.08 ml·(2 ml)-1剂量时荧光强度有所减弱,见表1。
表1 不同剂量探针孵育细胞后近红外荧光强度(±s)

表1 不同剂量探针孵育细胞后近红外荧光强度(±s)
0.01 0.02 0.04 0.06 0.08 5.041 ±0.763 13.275 ±1.274 29.159 ±0.840 54.2细胞对照 不同探针剂量[ml·(2 ml)-1]下荧光强度24 ±1.614 90.710 ±3.376 82.402 ±2.831
2.3 MTT检测细胞活力结果
将未标记细胞组、小剂量探针标记细胞组及大剂量探针标记细胞组分别进行活力检测,作出两者的生长曲线,可见小剂量的探针对细胞活力没有影响,而大剂量的探针对细胞活力有一定的影响(图4)。
2.4 7 T MR扫描及近红外荧光扫描
采用金属丝拉伤小鼠颈总动脉内膜模型,经7 T MR扫描后,可见术后周围水肿较明显,2周后水肿基本吸收,患侧血管表现为血管腔狭窄,血管壁增厚(图5)。此时进行活体近红外成像,可见患侧有近红外荧光逐渐聚集,1~2 h可见较明显聚集,24 h后较多信号已衰减(见图6)。
2.5 HE 染色结果
模型鼠2周后进行颈总动脉取材及HE染色,在病理组织学切片上,可见患侧血管管壁不规则增厚,新内膜增生(见图7)。
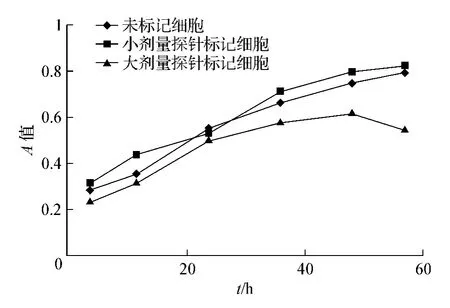
图4 MTT法绘制细胞生长曲线 未标记细胞生长速度较快,在一定时间内且呈线性增殖,小剂量探针标记后并未对细胞增殖的影响没有统计学意义(P>0.05),大剂量探针标记细胞一定时间后对其增殖的影响有统计学意义(P<0.05),甚至可能阻滞细胞生长
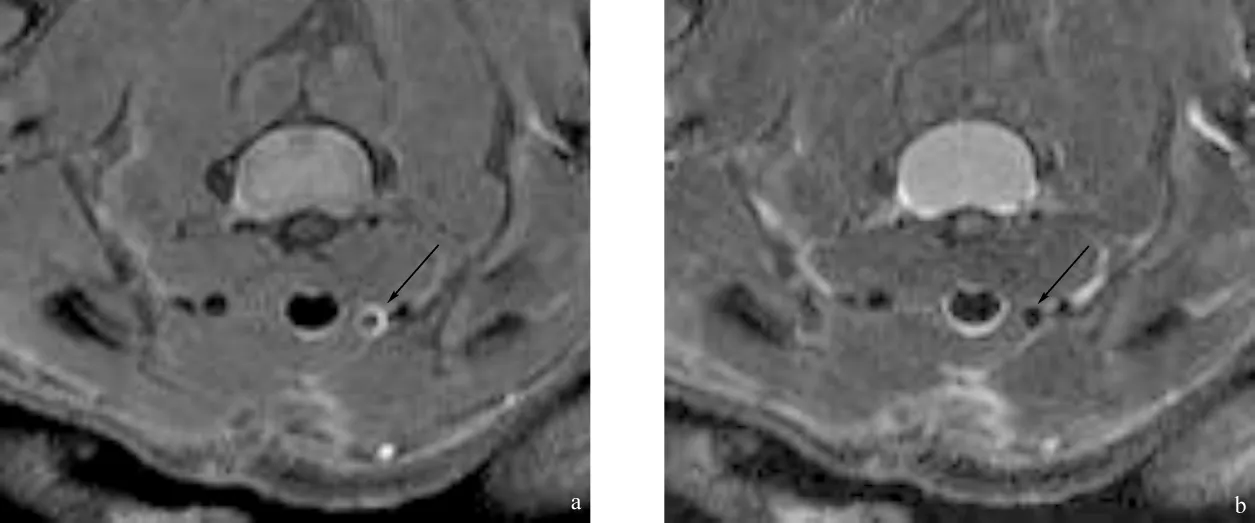
图5 小鼠颈部磁共振成像 a、b为同一层面。a.质子加权像;b.T2加权像。可见右侧颈总动脉管壁增厚,且管腔较对侧狭窄,周围炎症基本吸收
3 讨 论
关于小鼠血管内膜损伤模型,实验证明多种方法均能成功建立。其中,在颈部进行金属丝损伤法操作较为简便易行。选择在高脂喂养的基础上利用金属丝拉伤建立早期AS模型,成功率较高且稳定可靠[3]。

图6 不同时间点小鼠颈部近红外荧光分布图 a.明场图;b、c、d、e、f依次为15 min、30 min、1 h、2 h、24 h近红外荧光扫描图。右侧颈总动脉为患侧,15 min及30 min时可见周围腺体近红外荧光的非特异性聚集,右侧颈总动脉已可见荧光聚集,1 h时可见右侧颈总动脉走形区呈条状近红外荧光聚集,24 h后荧光信号明显减少;切口周围亦可见非特异性荧光聚集

图7 模型鼠颈总动脉管壁切片 HE×200
近红外荧光分子探针由于其极其敏感、无创、无放射性、宏观微观显影、良好的组织对比、实时显像、价格相对便宜的优点,越来越多地被用于动物实验。目前近红外探针已被用于检测肿瘤、细胞凋亡及炎症成像等[4]。由于近红外荧光分子本身具有高敏感性及组织对比性,且颈总动脉距体表的距离不超过近红外荧光分子的成像限度。采用切开颈部皮肤及分离软组织后近红外成像,更能减少伪影,避免因腺体、肌肉等炎症发生非特异性成像,可操作性较强。
AS斑块中的巨噬细胞有吞噬、参与炎症、免疫及增殖反应,破裂的AS斑块与非破裂的斑块相比,其纤维帽中含有更多的巨噬细胞。因此,如果能早期观察到巨噬细胞异常聚集,可能为易损斑块的早期发现提供线索。在AS疾病模型中,可见大量的泡沫细胞,一般认为,这些泡沫细胞是由于巨噬细胞通过清道夫受体大量吞噬ox-LDL形成。实验表明,巨噬细胞对脂质的摄取可经如清道夫受体等受体途径,也可经巨噬细胞的胞饮途径[5-8]。
体外细胞吞噬实验验证了近红外标记的ox-LDL可被巨噬细胞吞噬,且摄取量与探针浓度具有相关性。同时发现:小剂量的探针对小鼠单核巨噬细胞的生长、形态及活力没有明显影响,而探针剂量较大时可发现较多单核细胞转变为伪足较多的巨噬细胞,细胞活力有所下降,这与巨噬细胞吞噬ox-LDL形成泡沫细胞后的改变可能有所关联,此时细胞近红外成像示荧光强度有所减低,这证明了只有在巨噬细胞大量聚集处才可能吞噬较多的近红外探针。
小鼠颈总动脉损伤后2周,进行MR扫描可见患侧颈总动脉管壁增厚,HE染色证实新生内膜增生。且此时患侧颈部周围炎性渗出已基本吸收,颈总动脉局部管腔较窄,血流动力学发生改变,有利于近红外探针的局部聚集及摄取。通过近红外成像证实,在以不影响细胞形态发生明显改变的前提下,即在探针浓度的允许范围内,可以很好地进行荧光成像。患侧颈部近红外荧光信号聚集,且在颈总动脉分叉处信号聚集明显,与AS好发部位相一致,表明在患侧颈总动脉内可能存在较多可以吞噬近红外荧光分子的巨噬细胞,这可能为易损斑块的早期发现提供线索。应用水溶性的荧光分子,较多经过肾脏排泄,可在膀胱内见到较多的荧光聚集。近红外标记的ox-LDL在体外测量的峰值约800 nm,在活体内约820 nm,证明在体内发生了红移现象,但总体改变不大,仍可较好显示病变。颈部病变较为局限,但由于光的散射原理,可能存在较多伪影,且凡是存在炎症的部位均可引起非特异性聚集,这就减低了其特异性。
每个LDL分子中含有1个apoB-100,后者含有丰富的胺基,可与近红外荧光分子染料如碳青花类染料的羧基相结合,经过分离纯化后可被用于肿瘤、炎症等近红外的成像,连接成功率为100%,有学者等则利用HDL作为载体,实现了Gd、荧光分子及HDL模拟肽探针的合成[2,9-10]。虽然apoB含有一定数量的胺基,但在连接过程中,无法得知apoB-100与多少个荧光分子相连,因此剂量问题需要进一步探索。
总而言之,近红外荧光分子标记的ox-LDL是一种新型的分子探针,该探针对AS的早期诊断及易损斑块的研究可能具有良好前景。
[1]HURLIMANN D,RUSCHITAZKA F,LUSCHER T F.The relationship between the endothelium and the vessel wall[J].Eur Heart J Suppl,2002,4(Suppl A):A1-A7.
[2]CHEN X Y,DENG D W,GU Y Q,et al.In vivotumor imaging in mice with near-infrared-low density lipoprotein conjugates[J].SPIE,2009,7519:01-14.
[3]陈骏,贾振宇,马占龙,等.超高场强小动物磁共振成像活体观察小鼠颈动脉内膜损伤后的动态变化[J].中华老年医学杂志,2010,29(6):513-517.
[4] LEINNOEN M,SAIKKSU P.Infections and atherosclerosis[J].Scand Cardiovasc J,2000,34:12-20.
[5]MOORE K J,KUNJATHOOR V V,KOEHN S L,et al.Loss of receptor-mediated lipid uptake via scavenger receptor A or CD36 pathways does not ameliorate atherosclerosis in hyperlipidemic mice[J].J Clin Invest,2005,115(8):2192-2201.
[6]YAO W Q,LI K,LIAO K.Macropinocytosis contributes to the macrophage foam cell formation in RAW264.7 cells[J].Acta Biochim Biophys Sin,2009,41(9):773-780.
[7]KRUTH H S,JONES N L,HUANG W,et al.Macropinocytosis is the endocytic pathway that mediates macrophage foam cell formation with native low density lipoprotein[J].J Biol Chem,2005,280(3):2352-2360.
[8]LUND-KATZ S,IBDAH J A,LETIZIA J Y,et al.A13C NMR characterization of lysine residues in apolipoprotein B and their role in binding to the low density lipoprotein receptor[J].J Biol Chem,1988,263(27):13831-13838.
[9]CORMODE D P,CHANDRASEKAR R,DELSHAD A,et al.Comparison of synthetic high density lipoprotein(HDL)contrast agents for MR imaging of atherosclerosis[J].Bioconjugate Chem,2009,20:937-943.
[10]FRIAS J C,WILLIAMS K V,FISHER E A,et al.Recombinant HDL-like nanoparticles:a specific contrast agent for MRI of atherosclerotic plaques[J].J Am Chem Soc,2004,126:16316-16317.

