伴发迟发性运动障碍的精神分裂症患者血清脑源性神经营养因子水平的对照研究
陈大春修梅红张保华卞清涛李占江张向阳
·论 著·
伴发迟发性运动障碍的精神分裂症患者血清脑源性神经营养因子水平的对照研究
陈大春*△修梅红△张保华△卞清涛△李占江*张向阳△
目的 探讨外周血清脑源性神经营养因子(brain derived neurotrophic factor,BDNF)浓度与精神分裂症伴发的迟发性运动障碍(tadrive dyskinesia,TD)的关系。方法 收集精神分裂症伴发TD患者61例、不伴发TD的患者78例,以及正常对照102名。用酶联免疫吸附法检测BDNF水平,采用不自主运动量表(abnormal involuntary movement scale,AIMS)评估TD的严重程度,阳性和阴性症状量表 (positive and negative symptom scale,PANSS)评估患者精神症状。结果 TD组、非TD组和对照组的BDNF水平分别为 (9.35±1.60)μg/L、(10.12±2.03)μg/L、(12.27±2.7)μg/L,3组的差异有统计学意义(F=37.8,P<0.01);两两比较显示,TD组和非TD组均低于对照组(P<0.01),而TD组又低于非TD组(P<0.05)。使用典型和非典型抗精神病药物患者之间的BDNF水平差异无统计学意义(P>0.05)。TD组BDNF水平与AIMS总分、年龄、总病程负相关(r分别为-0.24、-0.32、-0.22,P均小于0.05),而在非TD组BDNF水平与上述因素均无相关(P>0.05)。结论 精神分裂症伴发TD患者外周BDNF浓度下降,且其水平与异常运动严重程度相关,提示BDNF可能在TD的病理生理中发挥作用。
精神分裂症 脑源性神经营养因子 迟发性运动障碍
迟发性运动障碍(tadrive dyskinesia,TD)是由于长期服用抗精神病药物所引起的一种特殊而持久异常的不自主运动综合症。国内报道发生率在21.7%[1],国外报道为13%[2]。目前TD病理机制尚不十分清楚,近年来包括自由基和神经毒性学说在内的神经元变性假说日益受到人们的重视[3]。在长期服药的慢性精神分裂症患者中,由于自由基产生过多或抗氧化酶的活性降低造成自由基对某些脑区损伤被认为是形成 TD原因之一[4]。而脑源性神经营养因子 (brain derived neurotrophic factor,BDNF)在神经元生长、分化、突触连接及神经元存活与修复等过程中起着重要作用[5]。研究证实精神分裂症患者BDNF水平低于正常对照且与精神症状相关[6-7],BDNF不足或功能失调可能导致患者的受损神经细胞无法及时修复,因此认为BDNF亦可能参与了TD的病理机制。但国内外目前对于TD与BDNF关系的研究仍较少[8]。故本研究通过比较精神分裂症伴发和不伴发TD患者和正常人群血清BDNF水平以及BDNF水平与TD严重程度的相关性,探讨TD可能发病机制。
1 对象和方法
1.1 研究对象 TD组和非TD组均来自2008年5~9月北京回龙观医院的精神分裂症住院患者。TD组纳入标准:①符合DSM-Ⅳ精神分裂症诊断;②年龄>18岁;③病程超过5年,服用稳定剂量抗精神病药物至少1个月;④异常不自主运动量表(abnormal involuntary movement scale,AIMS)总分≥3。排除中枢神经系统疾病、各种躯体疾病及精神活性物质使用。符合入组标准的86例患者中61例有完整临床资料和血标本,故本研究对此61例有完整临床资料患者进行分析,其中男52例,女9例,年龄30~63岁,平均(51.5±6.6)岁,受教育年限 5~15年,平均(9.4±2.1)年,总病程 9~40年,平均(27.6±8.3)年,首次住院年龄(24.1± 7.7)岁,住院次数(3.7±2.5)次。使用药物:服利培酮15例,氯氮平25例,典型抗精神病药物21例,折合成氯丙嗪等效剂量为(444.2±246.3)mg/d。阳性和阴性症状量表(positive and negative symptom scale,PANSS)阳性症状分(13.1±5.4)分,阴性症状分(23.6±6.4)分,PANSS总分(63.7±14.0)分。
非TD组入组标准:①②③同TD组,④Simpson迟发性运动专用量表总分为0。共78例,男64例,女14例,年龄32~65岁,平均 (50.5±5.8)岁,受教育年限3~15年,平均(9.6±3.1)年,总病程 9~51年,平均(26.6±8.8)年,首次住院年龄(23.5±7.2)岁,住院次数(3.2±2.1)次。使用药物:利培酮23例,氯氮平35例,典型抗精神病药物20例,折合成氯丙嗪等效剂量为(440.2±239.3)mg/d。PANSS阳性症状分(11.6±5.0)分,阴性症状分(21.7 ±6.8)分,PANSS总分(59.2±13.0)分。
正常对照组来自北京某社区的健康居民。排除:①中枢神经系统疾病及各种躯体疾病;②精神病阳性家族史;③酒精依赖及其它精神活性物质使用。共102名,男77名,女25名,年龄30~65岁,平均(51.9±8.7)岁,受教育年限6~12年,平均(8.9±3.4)年。
3组的性别(χ2=5.5,P>0.05)、年龄及受教育年限差异均无统计学意义 (F=2.4,1.8,P>0.05)。TD组与非TD组之间总病程(t=-0.6,P>0.05)、首次住院年龄(t=-1.2,P>0.05)、住院次数 (t=-1.4,P>0.05)、抗精神病药物剂量 (t=0.3,P>0.05)及PANSS评分(t=-1.8,P>0.05)的差异均无统计学意义。本研究获得北京回龙观医院伦理委员的批准,研究对象或家属对本研究均签署知情同意书。
1.2 方法
1.2.1 临床资料的收集 评定工具:依据Schooler等[9]的TD研究诊断标准,先用Simpson迟发性运动专用量表进行筛选,用AIMS评定TD的严重性。对研究对象详细记录一般资料,采用PANSS对精神分裂症患者的精神状况进行评定。研究开始前对研究人员进行量表一致性培训,使组内相关系数(intraclass correlation coefficient,ICC)≥0.8。
1.2.2 血清脑源性神经营养因子检测 患者经10~12 h禁食,于晨6:30~7:00取空腹静脉血5 mL置4℃冰箱保存4 h,充分凝固后离心 (3000 g,10 min),分离血清,并于-20℃冰箱保存待测。用酶联免疫吸附法(ELSIA)检测BDNF,每一样本进行双点测定,取平均值;所有样本由同一人测定,批内、批间差异分别为5%、7%。试剂盒由南京建成生物工程研究所提供,测定过程严格按说明书进行操作。
1.3 统计学处理 所有资料用Epidata 3.0输入,采用SPSS 11.5软件进行分析,正态分布的资料使用χ2检验、方差分析、Pearson相关分析。检验水准ɑ=0.05,双侧检验。
2 结果
2.1 TD组、非TD组及正常对照BDNF水平比较
TD组、非TD组和对照组的BDNF水平分别为(9.35±1.60)μg/L、(10.12±2.03)μg/L、(12.27± 2.7)μg/L,3组的差异有统计学意义(F=37.8,P<0.01);两两比较显示,TD组和非TD组均低于对照组 (P<0.01),而TD组又低于非TD组 (P<0.05)。以年龄及病程为协变量进行方差分析,进一步比较TD组与非TD组BDNF水平,差异仍有统计学意义(F=4.86,P<0.05)。
2.2 TD组患者BDNF水平与AIMS及临床特征的相关性 86例TD患者中,BDNF水平与临床特征作单因素相关分析,TD组BDNF水平与AIMS总分、年龄、总病程负相关(r分别为-0.24、-0.32、-0.22,P均小于 0.05),而在非 TD组 BDNF水平与上述因素均无相关(r分别为-0.03,-0.12,-0.12,P均大于0.05)。
2.3 不同类型抗精神病药物对BDNF的影响 将全部患者所用抗精神病药物分为典型和非典型药物使用组,2组的 BDNF水平无明显差异 (t=-0.88,P>0.05)。进一步分析,也未在TD组和非TD组中发现两类药物对BDNF水平有影响 (t=-0.48,P>0.05;t=-1.19,P>0.05)。见表1。无论是所有患者、TD患者还是非TD患者BDNF水平与抗精神病药物剂量(r分别为0.01、0.06、0.04,P均大于0.05)、治疗时间均不相关 (r分别为0.04、0.18、0.18,P均大于0.05)。
表1 典型与非典型抗精神病药患者BDNF水平比较(μg/L,±s)
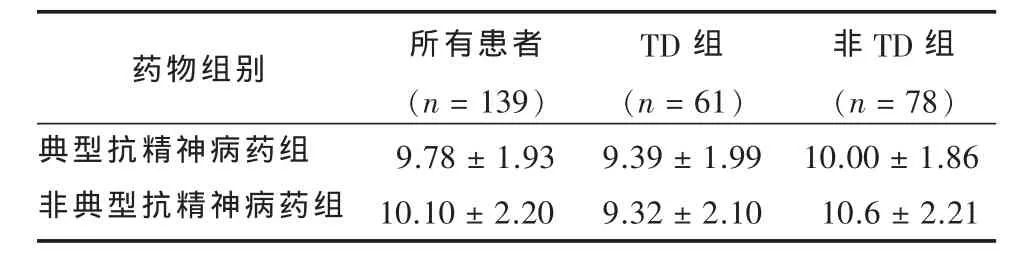
表1 典型与非典型抗精神病药患者BDNF水平比较(μg/L,±s)
药物组别典型抗精神病药组非典型抗精神病药组所有患者(n=139)9.78±1.93 10.10±2.20 TD组(n=61)9.39±1.99 9.32±2.10非TD组(n=78)10.00±1.86 10.6±2.21
3 讨论
迟发性运动障碍是在长期使用抗精神病药尤其是典型抗精神病药后所出现的一种较严重的锥体外系反应,致残率高,预后差,严重影响患者的社会功能。目前关于TD发生的原因并不十分清楚,主要有多巴胺受体超敏假说及神经元变性假说。但前者近年来受到质疑,在应用多巴胺受体激动剂时并没有使TD病人的原有症状加重。动物实验发现,在长期使用抗精神病药出现运动障碍的大鼠中,其纹状体的多巴胺代谢产物会明显下降,神经生化研究亦未揭示多巴胺受体上调同TD存在相关性[10]。所以,纹状体突触后的多巴胺受体活动过度同TD的长期持续存在没有明确的相关性。而神经变性学说越来越受到人们的重视,包括自由基神经毒性及BDNF营养机制[7,11]。研究证实多巴胺神经元生长及功能受到BDNF调节。
本研究结果表明,伴有TD精神分裂症、非TD精神分裂症患者BDNF水平显著低于正常对照组。这一结果与目前国内外研究一致[8,12-13],支持精神分裂症神经发育异常假说。本研究结果还显示,伴有TD的精神分裂症患者组BDNF水平显著低于非TD患者组,并且BDNF水平与AIMS总分负相关。这与谭云龙等[8]的研究结果部分一致。他们比较了慢性精神分裂症住院患者中TD组与非TD组的BDNF水平,结果显示二者均低于正常对照组,但TD组与非TD组无差异;同时他们的研究也显示BDNF水平与AIMS总分正相关。他们与本研究结果有些差异的原因可能与入组标准、研究对象病情不同有关。与谭云龙等[8]比较,本研究的样本量大些,而患者的平均年龄、总病程及AIMS评分也均高些,这些意味着TD组的BDNF水平可能更低,从而使本研究可发现TD组和非TD组的差异。神经营养因子的下调即低水平BDNF会导致神经元变性进一步加重,那么更可能产生TD。因此,本研究结果对TD病理机制的阐述更合理一些。此外,Park等[14]报道在精神分裂症患者中BDNF基因多态性与糖原合成激酶-3β基因共存与是否产生TD密切相关。这些研究结果均验证了BDNF在TD病理机制中发挥重要作用,支持TD神经变性学说,即由于精神分裂症总体BDNF水平低下导致多巴胺代谢异常,异常多巴胺通过自身氧化或单胺氧化酶形成自由基损伤黑质纹状体系统的神经元产生TD。除上述观察到的研究结果之外,本研究中伴有TD精神分裂症患者BDNF水平还与年龄、总病程显著负相关,即TD患者BDNF含量随着年龄、病程延长而逐渐下降,提示伴有TD的精神分裂神经元变性在进行性加重,也进一步证实TD是一种进展性、不可逆性损伤。
本研究另一结果是无论所有患者还是TD、非TD患者中,典型与非典型抗精神病药物组的BDNF水平差异不显著,BDNF水平与所用抗精神病药物剂量、治疗时间无相关性。国内陈大春等[15]报道未服药首发精神分裂症经12周利培酮治疗,患者BDNF没有显著性变化。动物试验也表明,长时间予以大鼠注射典型与非典型抗精神病药,大鼠下丘脑的BDNF和神经营养因子水平并没有明显差异[16]。这些提示无论是单纯精神分裂症还是伴发TD精神分裂症其低水平BDNF可能独立于抗精神病药物治疗,反映疾病本身的病理生理过程。
本研究仅仅是一横断面研究,且患者病程较长,既往的用药情况也较复杂,因此尚难明确抗精神病药物与TD、BDNF之间的确切关系。精神分裂症罹患TD原因较复杂,非单一因素的作用,可能涉及到基因、自由基神经毒性、BDNF及抗精神病药物共同作用的结果。BDNF与TD危险因素如氧化应激、抗精神病药物、基因的易感性等之间关系尚需要进一步研究。
[1] 谢帆,王定省,宋立升,等.慢性精神分裂症住院病人迟发性运动障碍研究[J].中国神经精神疾病杂志,2002,28(1):27-29.
[2]Modestin J,Wehrli MV,Stephan PL,et al.Evolution of neuroleptic-induced extrapyramidalsyndromes underlong-term neuroleptic treatment[J].Schizophr Res,2008,100(1-3):97-107.
[3]Lohr JB,Kuczenski R,Niculescu AB.Oxidative mechanisms and tardive dyskinesia[J].CNS Drugs,2003,17(1):47-62.
[4]Zhang WF,Tan YL,Zhang XY,et al.Extract of ginkgo biloba treatment for tardive dyskinesia in schizophrenia: a randomized,double-blind,placebo-controlled trial[J].J of Clinical Psychiatry,2011,72(5):615-621.
[5]Karege F,Schwald M,Cisse M.Postnatal developmental profile of brain-derived neurotrophic factor in rat brain and platelets[J].Neurosci Lett,2002,328(3):261-264.
[6]Rizos EN,Rontos I,Laskos E,et al.Investigation of serum BDNF levels in drug-naive patients with schizophrenia[J].Prog Neuro-Psychopharmacol Biol Psychiatry,2008,32(5):1308-1311.
[7]Wang ZR,Zhou DF,Cao LY,et al.Brain-derived neurotrophic factor polymorphisms and smoking in schizophrenia[J].Schizophrenia Res,2007,97(3):299-301.
[8] 谭云龙,周东丰,邹义壮,等.精神分裂症迟发性运动障碍患者血清脑源性神经营养因子水平对照研究[J].中国神经精神疾病杂志,2004,30(5):332-334.
[9]Schooler N R,Kane JM.Research diagnoses for tardive dyskinesia[J].Arch Gen Psychiatry,1982,39(4):486-487.
[10]Fachinetto R,Villarinho JG,Wagner C,et al.Valeriana officinalis does not alter the orofacial dyskinesia induced by haloperidol in rats:role of dopamine transporter[J].Prog Neuro-psychopharmacol Biol Psychiatry,2007,31(7):1478-1486.
[11]Thaakur SR, Jyothi B.Effect of spirulina maxima on the haloperidol induced tardive dyskinesia and oxidative stress in rats[J].J Neural Transm,2007,114(9):1217-1225.
[12]Rizos EN,Rontos I,Laskos E,et al.Investigation of serum BDNF levels in drug-naive patients with schizophrenia[J].Progress in Neuro-Psychopharmacology Biol Psychiatry,2008,32(5):1308-1311.
[13]陈大春,修梅红,王宁,等.精神分裂症首次发病患者血脑源性神经营养因子与临床特征及认知功能关系对照研究[J].中华精神科杂志,2009,42(4):255.
[14]Park SW,Lee JG,Kong BG,et al.Genetic association of BDNF val66met and GSK-3b-50T/C polymorphisms with tardive dyskinesia[J].Psychiatry and Clin Neurosci,2009,63(4):433-439.
[15]陈大春,修梅红,王宁,等.利培酮治疗首发精神分裂症患者脑源性神经营养因子的变化及其与临床疗效和认知功能的关系[J].中国神经精神疾病杂志,2010,36(9):529-532.
[16]Shalev I,Lerer E,Israel S,et al.BDNF Val66Met polymorphism is associated with HPA axis reactivity to psychological stress characterized by genotype and gender interactions[J].Psychoneuroendocrinology,2009,34(3):382-388.
Comparative study on serum levels of brain-derived neurotrophic factors between schizophrenic patients with tardive dyskinesia and those without tardive dyskinesia.
CHEN Dachun, XIU Meihong, ZHANG Baohua,BIAN Qingtao,LI Zhanjiang,ZHANG Xiangyang.The First Clinical Department of Beijing Huilongguan Hospital,Beijing 100096,China.Tel:010-62715511.
Objective To explore relationship between serum levels of brain-derived neurotrophic factors(BDNF)and tardive dyskinesia(TD)in schizophrenic patients with TD and those without TD.Methods All patients satisfied DSM-IV criteria for schizophrenia.The serum BDNF levels were examined by using enzyme linked immunosorbent assay in patients with TD(n=61)and patients without TD(n=78)and controls(n=102).The severity of TD and psychopathology were assessed using the abnormal involuntary movement scale(AIMS)and positive and negative symptom scale(PANSS),respectively.Results The patients with TD[(9.35±1.60)μg/L]and those without TD[(10.12 ±2.03)μg/L]had lower serum BDNF levels than normal controls[(12.27±2.7)μg/L](F=37.8,P<0.01).The patients with TD had markedly lower serum BDNF levels than those without TD (P=0.04).The serum BDNF levels of patients with TD was inversely correlated with AIMS total score,age and duration of illness.In all patients,no significantly differences in serum BDNF levels was noted between atypical and typical antipsychotic treatment[(9.78±1.93)μg/L vs(10.10±2.20)μg/L,t=-0.88,P>0.05].Conclusion The BDNF levels of schizophrenia with TD was decreased significantly.There may be a relationship between decreased BDNF levels and dyskinetic movements.BDNF may play an important role in the pathophysiology of TD.
Schizophrenia Brain-derived neurotrophic factors Tardive dyskinesia
R749.3
A
2011-06-23)
(责任编辑:曹莉萍)
* 首都医科大学附属北京安定医院精神病学系(北京 100088)
(E-mail:lizhj8@ccmu.edu.cn,zhangxy9@gmail.com)
△ 北京回龙观医院

