尿酸对阿尔茨海默病大鼠学习记忆能力的影响及其机制
宋彦索爱琴丁旭萌王天虎杨国东贾兰梅
·论 著·
尿酸对阿尔茨海默病大鼠学习记忆能力的影响及其机制
宋彦*索爱琴△丁旭萌*王天虎*杨国东*贾兰梅*
目的 观察尿酸对阿尔茨海默病(Alzheimer disease,AD)大鼠学习记忆能力的影响,并探讨作用机制。方法 Morris水迷宫实验筛选出90只大鼠,随机分为空白对照组,模型对照组,尿酸处理组(1~4组),每组15只。Aβ1-42海马注射制作AD模型,用Morris水迷宫实验观察干预前后大鼠空间学习记忆能力的变化,丙二醛(malondialdehyde,MDA)试剂盒测定海马区MDA的含量;免疫组化染色测定半胱氨酸天冬氨酸蛋白酶-3(caspase-3)的表达。结果 与空白对照组比较,模型对照组大鼠空间学习记忆能力下降(P<0.01),海马区MDA含量和caspase-3明显增高(P<0.01);与模型对照组比较,2种剂量尿酸处理组大鼠的学习记忆能力明显改善(P<0.01),海马区MDA和caspase-3的表达减少(P<0.01)。结论 尿酸具有改善AD大鼠空间学习记忆作用,可能与抗氧化应激作用及抑制海马中caspase-3表达有关。
尿酸 阿尔茨海默病 学习记忆 丙二醛 半胱氨酸天冬氨酸蛋白酶-3
阿尔茨海默病(Alzheimer disease,AD)好发于中老年人的一种常见中枢神经系统变性疾病,氧化应激学说在AD发病中起重要作用[1]。尿酸是一种重要的生理性的天然抗氧化剂,具有抗氧化应激和保护神经元的作用。本实验探讨尿酸(uric acid,UA)对AD模型大鼠学习记忆能力的影响及其机制,为研究AD的发病机制及临床应用UA治疗AD提供理论和实验依据。
1 材料与方法
1.1 实验动物及试剂 郑州大学实验动物中心提供的90只Sprauge-Dawley(SD)大鼠,雄性、健康、体质量(280±12)g。Aβ1-42(美国Sigma公司),500 μg Aβ1-42溶于125 μL灭菌生理盐水中,制成4 μg/μL浓度,置于-70℃超低温冰箱中保存,用前置于37℃细胞培养箱中孵育1周,使其成为凝聚态Aβ1-42。尿酸、兔抗鼠caspase-3单抗为美国Sigma公司;尿酸检测试剂盒(南京建成);SP免疫组化染色试剂盒、丙二醛(MDA)氧化应激检测试剂盒、DAB显色试剂盒(北京中杉金桥)。
1.2 大鼠尿酸水平测定 SD大鼠尾静脉采血约1 mL于抗凝管内,在离心机内离心15 min,转速5000 r/min,离心后取200 μL上清液于EP管,检测尿酸水平。
1.3 动物的分组与模型的制备 测定大鼠的血尿酸水平[2]在(1±0.1)mg/kg生理范围内,经Morris水迷宫实验筛选出90只大鼠,随机分为空白对照组,模型对照组,尿酸处理组(尿酸处理1~4组),每组15只。10%水合氯醛(300 mg/kg)腹腔注射麻醉SD大鼠,将其固定于立体向仪上,使前后囟位于同一水平面上。参照《大鼠脑立体定位图谱》[1],定位于前囟后3.0 mm、正中矢状缝左右旁开3.0 mm、颅骨表面下3.5 mm为双侧海马背侧注射点。用10 μL微量注射器10 min内缓慢将Aβ1-42注入模型对照组和尿酸处理组,空白对照组注射等容积的生理盐水,所有大鼠海马内注射Aβ1-42每侧均为2.5 μL(4 μg/μL),留针10 min,然后缓慢退出,缝合皮肤。造模成功后第1~21 d尿酸处理1~4组分别腹腔注射1、5、10、20 mg/(kg·d)的尿酸,空白对照组与模型对照分别腹腔注射等剂量生理盐水。 在治疗的21 d期间中,模型对照组、尿酸处理2、4组各死亡1只大鼠,余下87只是合格的。大鼠行为学的变化可以证实造模成功,即Aβ1-42海马区注射是成功的。
1.4 空间记忆能力检测 造模后第22 d采用Morris水迷宫实验进行空间记忆能力的测定。测定程序为定位航行试验:每天上午各训练2次,共训练16次,将大鼠面向池壁分别从4个点放入水中,记录其在3 min内寻找到并爬上平台的时间和路程,即逃避潜伏期。空间探索实验:在定位航行实验后去除平台,然后任选一个入水点,将大鼠放入水池中,记录其在3 min内跨越原平台的次数。
1.5 取材 行为学检测结束后即造模后第23 d,腹腔内注射10%水合氯醛(300 mg/kg),将大鼠仰卧位固定于手术板上,暴露心脏,经主动脉灌注后用剪刀快速由颈部剪下大鼠头颅,将脑组织从颅腔内移出置于4%多聚甲醛固定2~4 h,然后置于30%蔗糖溶液,待沉底后取出大脑,沿中线离断两侧大脑半球,用竹刀沿海马的包膜分离出两侧完整的海马,冰生理盐水充分冲洗,滤纸吸干,称重,置于液氮中保存。每组中取7只大鼠的双侧海马制作切片,常规脱水、二甲苯透明、石蜡包埋、连续冠状切片,片厚5 μm。
1.6 MDA测定 每组中取8只大鼠海马用组织匀浆器制成组织匀浆,以12000 r/min低温离心15 min,取上清液,MDA检测试剂盒测定MDA的含量。
1.7 caspase-3免疫组化染色 免疫组化染色用SP法,按说明书进行操作,DAB显色系统,镜下观察显色情况。阴性对照组以PBS代替一抗进行孵育。每只动物选取相似平面的切片各5张,运用网格目镜测试,于40×10倍光镜下分别计数海马CA1区单位面积内caspase-3阳性细胞数目,每张切片分别选取双侧海马视野各2个,取其均数作为阳性细胞的数目。
1.8 统计学方法 采用SPSS 13.0进行统计学处理。数据以表示。组间比较采用单因素方差分析,组内采用最小有意义的t检验。检验水准α=0.05。
2 结果
2.1 大鼠学习记忆能力测定 各组之间潜伏期、搜索路径长度、跨越原平台次数不等或不全相等(分别 F=12.345,P<0.01;F=35.40,P<0.01;F=11.20,P<0.01)。与 空白对照组组比较,模型对照组和尿酸处理1~4组学习记忆能力明显下降(P<0.01);与模型对照组比较,尿酸处理2、3组学习记忆能力增强(P<0.01),模型对照组和尿酸处理1、4组之间比较差异无统计学意义(P>0.01);尿酸处理1~4组之间比较差异有统计学意义(P<0.01),尿酸处理2、3组学习记忆能力增强(见表1)。
2.2 MDA含量检测 各组之间MDA含量不等或不全相等 (F=7.18,P<0.01)。与空白对照组比较,模型对照组和尿酸处理1~4组MDA含量增加(P<0.01);与模型对照组比较,尿酸处理2、3组MDA含量减少(P<0.01),尿酸处理 1、4组与模型对照组之间比较无统计学意义 (P>0.01);尿酸处理1~4组之间比较差异有统计学意义(P<0.01),尿酸处理2、3组MDA含量减少(见表2)。
2.3 各组caspase-3免疫组化染色阳性细胞数 各组之间caspase-3阳性细胞数不等或不全相等(F=35.78,P<0.01)。与空白对照组比较,模型对照组和尿酸处理1~4组caspase-3阳性细胞数明显增多,差异有统计学意义(P<0.01);与模型对照组比较,尿酸处理2组、尿酸处理3组caspase-3阳性细胞数明显减少(P<0.01),尿酸处理1、4组与模型对照组之间比较差异无统计学意义(P>0.01);尿酸处理4组之间比较差异有统计学意义 (P<0.01),尿酸处理2组、尿酸处理3组caspase-3阳性细胞数减少(见表3、图1)。
表1 各组大鼠学习记忆能力成绩(±s)
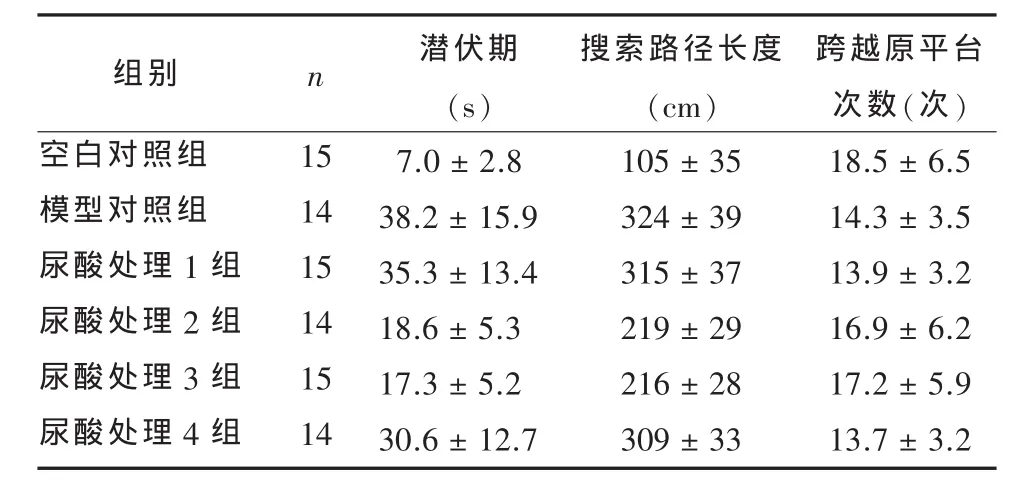
表1 各组大鼠学习记忆能力成绩(±s)
组别空白对照组模型对照组尿酸处理1组尿酸处理2组尿酸处理3组尿酸处理4组n 15 14 15 14 15 14潜伏期(s)7.0±2.8 38.2±15.9 35.3±13.4 18.6±5.3 17.3±5.2 30.6±12.7搜索路径长度(cm)105±35 324±39 315±37 219±29 216±28 309±33跨越原平台次数(次)18.5±6.5 14.3±3.5 13.9±3.2 16.9±6.2 17.2±5.9 13.7±3.2

表2 各组大鼠海马区MDA含量

表3 各组大鼠caspase-3阳性细胞数计数(1个400倍视野)
3 讨论
到目前为止,AD的病因及发病机制仍不十分清楚,近年来研究发现氧化应激[2]在AD的发病中起重要作用。氧化应激可造成大量活性氧的产生,表现为血清中MDA含量升高和SOD活力、GSH-PX活力降低,导致机体脂质代谢失衡,并继发细胞损伤,导致细胞凋亡[3]。Butterfield等[4]的实验表明,AD模型鼠脑内脂质过氧化反应增强。林玉坤等[5]研究表明轻微认知障碍患者脑中即可发现蛋白质的氧化和脂质的过氧化。Caspase-3是细胞凋亡的敏感指标,是细胞凋亡蛋白酶级联反应的最终通路[6]。尿酸是嘌呤的代谢终产物,是一种重要的生理性的天然抗氧化剂、铁螯合剂、自由基清除剂,能通过多种途径抑制一系列继发性损伤和神经细胞凋亡,具有抗氧化应激和保护神经元的作用[7],这在AD动物模型中也得到了证实[8]。相反,也有研究报道尿酸水平过高,反而会增加氧化损伤[9]。
尚秀丽等[10]测定32例AD患者显示较低血尿酸水平,国外Polidori等[11]和Kim等[12]研究证实AD和轻度认知障碍患者血尿酸也处于较低水平。最新研究结果发现,较高血浆浓度水平的尿酸能够降AD的发病率,改善AD患者的认知功能障碍及AD患者的预后[13]。但Schretlen等[14]对共住一处有96例AD患者进行研究表明高于正常水平尿酸的人员也存在记忆和认知功能的减退。
基于尿酸具有抗氧化的作用和AD血清中低尿酸水平特点,我们用不同剂量的尿酸腹腔注射治疗AD模型大鼠,结果表明:5、10 mg/(kg·d)两种剂量尿酸处理组大鼠的潜伏期和搜索路径较模型组明显缩短(P<0.01),跨越平台次数较模型组增加(P<0.01),认知功能明显改善(P<0.01);模型组大鼠海马区的MDA含量和凋亡因子caspase-3表达显著增强,而5、10 mg/(kg·d)两种剂量尿酸处理组大鼠海马组织中MDA含量和caspase-3表达明显下降(P<0.01),差异具有明显的统计学差异。可见,尿酸具有抗氧化作用,抑制了大鼠海马组织Caspase-3的表达,从而减轻海马组织的损害,改善了大鼠的认知功能。

图1 免疫组化染色SABC法检测各组大鼠海马CA1区caspase-3阳性细胞。标尺10 μm A:空白对照组,caspase-3阳性神经元少;B:模型对照组,caspase-3阳性神经元增多;C:5 mg/(kg·d)尿酸干预组,caspase-3阳性神经元较多
该研究表明尿酸改善AD大鼠的学习记忆能力存在量效关系,5、10 mg/(kg·d)组改善学习记忆能力最佳,超过此剂量范围保护作用降低甚至消失,其机制可能是尿酸在一定范围内具有抗氧化应激能力,保护海马神经元,从不同途径影响到大脑皮质功能最终改善认知功能,表明对尿酸水平的调控,对于改善AD认知功能、延缓病情进展,提高疗效具有重要的意义。实验的不足之处是没有设置高尿酸血症大鼠作为对照组。虽然我们在动物实验中尿酸治疗AD动物模型取得了明显效果,但尿酸应用于AD患者还有一段距离,尚需进行进一步的研究。
[1] 包新民,舒斯云.大鼠脑立体定位图谱 [M].人民出版社,1991.
[2]Kim TS,Lim HK,Lee JK,et al.Changes in the levels of plasma soluble fractalkine in patients with mild cognitive impairement and Alzheimer's disease[J].Neurosci lett,2008,436(2):196-200.
[3]Butterfield DA,Reed T,Newman SF,Sultana R.Roles of amyloid β-peptide-associated oxidative stress and brain protein modification in the pathogenesis of Alzheimer's disease and Mild cognitive impairment[J].Free Radic Biol Med,2007,43:658-677.
[4] 吴月娥,宋成成,李婷婷,等.阿尔茨海默病治疗进展[J].承德医学院学报,2009,26(1):100-101.
[5] 林玉坤,曾园山,屈泽强,等.氧化应激与阿尔茨海默病[J].解剖学研究,2009,31(1):67-68.
[6]HuiMT,Wen WW,Yan QG.Progress in programmed cell death pathways[J].Chinese Journal of CellBiology,2008,30:563-568.
[7]Weisskopf MG,O'Reilly E,Chen H,et al.Plasma urate and risk of Parkinson's disease[J].Am J Epidemiol,2007,166(5):561-567.
[8]Duan RS, Chen MO, et al.Decreased fractalkine and increased IP-10 expression in aged brain of APP transgenic mice[J].Neurochem Res,2008,33(6):1085-1089.
[9] 商秀丽,张凤英,孟令慧,等.阿尔茨海默病患者血尿酸水平的检测及意义[J].中国医科大学学报,2009,38(5):333-334.
[10]Polidori MC,Mattioli P,Aldred S,et al.Plasma antioxidant status, immunoglobulin g oxidation and lipid peroxidation in demented patients: relevance to Alzheimer disease and vascular dementia.Dement Geriatr Cogn Disord,2004,18:265-270.
[11]Kim TS,Pae CU,Yoon SJ,et al.Decreased plasma antioxidants in patients with Alzheimer's disease.Int J Geriatr Psychiatry,2006,21:344-348.
[12]Michael C,Irizarry,Rema Raman,Michael A.Schwarzschild,et al.Plasma urate and progression of mild cognitive impairment[J].Neurodegener Dis,2009,6(1-2):23-28.
[13]Schretlen DJ,Inscore AB,Jinnah HA,et al.Serum uric acid and cognitive function in community-dwelling older adults[J].Neuropsychology,2007,21(1):136-140.
The effects of uric acid on learning-memory ability in the rat model of Alzheimer disease.
SONG Yan,SUO Aiqin,DING Xumeng,WANG Tianhu,YANG Guodong,JIA Lanmei.Department of Neurology,the Second People's Hospitol of Nanyang,Nanyang 473012;Department of Neurology,People’s hospital,Henan Province,Zhengzhou 450014,China.Tel:0377-61609105.
Objective To investigate the effects of uric acid on learning-memory ability in the rat model of Alzheimer disease induced by Aβ1-42.Methods SD rats were divided into blank control group,AD group,uric acid treatment group(group 1-4)(n=15).AD animal model was established by injecting Aβ1-42 into the hippocampus;In the first 1-21 day,uric acid group 1,2,3 and 4 were intraperitoneally injected with 1、5、10、20 mg/(kg·d)uric acid,respectively.The blank control group and AD group were intraperitoneally injected with equal dose of saline.All animals were evaluated using Morris water-maze test.Malondialdehyde (MDA) content in_the hippocampus was measured by using MDA reagent box and Caspase-3-positive neurons in the hippocampus were identified by using immunohistochemistry.Results Compared with the blank control group,the learning-memory ability was significantly declined and MDA content and the expression of Caspase-3-positive cell in the hippocampus was significantly increased at AD group, uric acid group 1,2,3 and 4(P<0.01).The improvements in learning-memory,the reduced MDA content and the less caspase-3 expression were observed in rats treated with two doses of uric acid (P<0.01).Conclusions Appropriate doses of uric acid can improve the learning-memory ability by reducing the oxidative stress and inhibiting the expression of caspase-3 in the hippocampus in the rat model of Alzheimer disease.
Eyk uric acid Alzheimer disease Learning-memory Malondialdehyde Caspase-3
R742
A
2011-12-10)
(责任编辑:李 立)
* 河南省南阳市第二人民医院神经内科 (南阳 473012)
(E-mail:1136811893@qq.com)
△ 河南省人民医院神经内科 (郑州 450014)

