去乙酰酶抑制剂SAHA增强顺铂抗肝癌细胞活性研究
张海元,张 静 (长江大学医学院,湖北荆州434023)
刘康兵 (石首市中医医院肿瘤科,湖北石首434400)
药物SAHA(suberoylanilide hydroxamic acid)是广谱型组蛋白去乙酰化酶抑制剂 (HDACI),对组蛋白去乙酰化酶 (HDAC)有明显的抑制作用,能通过细胞周期阻滞、诱导分化和凋亡等机制抑制肝癌细胞生长。顺铂 (cisplatin,DDP)是临床应用最为广泛的一种抗癌药物,铂类药物的主要作用机制是通过损伤DNA,使细胞进入G1期生长抑制,并诱导损伤严重的细胞进入凋亡状态[1]。但顺铂副作用较大,顺铂用量增大容易引起骨髓抑制及肾功能严重损害,另外顺铂使用剂量趋近于亚致死剂量时易引起耐药性,使得顺铂应用于肝细胞癌的治疗效果并不理想,故减少顺铂的使用剂量、增强顺铂抗肿瘤细胞活性显得十分重要。通过本项目的组蛋白去乙酰化酶抑制剂药物SAHA与低剂量顺铂联合应用对增强肝癌细胞HepG2凋亡作用及机制的探讨,有望获得全新的联合抗肝癌的药物治疗方案。
1 材料与方法
1.1 材料
肝癌细胞HepG2由武汉大学馈赠,细胞接种于含10%新鲜牛血清和抗生素的DMEM培养基中传代培养,DMEM培养液及二甲亚砜 (DMSO)购自美国GIBCO公司。DDP购于锦州九泰药业公司,去组蛋白乙酰酶抑制剂SAHA由英国阿斯利康公司提供。
1.2 方法
1.2.1 HepG2细胞培养 将肝癌细胞HepG2接种于含10%新生牛血清和抗生素的DMEM培养基中,置于5%CO2及饱和湿度的37℃培养箱中培养。利用0.125%的胰蛋白酶消化传代,1~2d换液一次。
1.2.2 显微镜观察细胞形态 将细胞HepG2接种于12孔细胞培养板,设对照组、SAHA(2.5μ mol/L)组、DDP(6.25μ g/ml)组及SAHA+DDP联合治疗组。待细胞贴壁后分别加药处理,每相隔6h,利用相差倒置显微镜观察各组培养孔内细胞贴壁生长及形态的变化情况。
1.2.3 MT T法检测肝癌细胞 HepG2的增殖情况 将细胞接种于 96孔板,设对照组、SAHA(2.5μ mol/L)组、DDP(6.25μ g/ml)组及 SAHA+DDP联合治疗组,每孔加入 MTT 液 20μ l,于37℃CO2培养箱培养4h,弃培养液,各孔加200μ l二甲基亚枫,用酶联仪在570nm波长下检测每孔的吸光值,每组重复3板,计算细胞生长抑制率。细胞生长抑制率 (%)=[(1—实验组OD值)/对照组OD值]×100%。
1.2.4 FCM检测肝癌细胞 HepG2的细胞周期和细胞凋亡情况 HepG2细胞经单纯加入 DDP(6.25 μ g/ml)或SAHA(2.5μ mol/L)后48h及SAHA与DDP联合应用后48h,收集所有贴壁和悬浮细胞,用10mmol/L PBS(pH 7.4)洗涤两次,通过流式细胞仪分析细胞周期和细胞凋亡情况。
1.3 统计学分析
2 结 果
2.1 细胞形态学改变
利用相差倒置显微镜观察显示,对照组中HepG2细胞呈梭形,扁平上皮细胞样,贴壁紧密生长,胞体大,增殖旺盛;DDP组细胞数减少,贴壁能力下降,部分细胞呈现肿大的坏死形状特征;SAHA组细胞皱缩为圆形,细胞数减少,贴壁能力下降;联合治疗组细胞数明显减少,部分细胞皱缩为圆形,贴壁能力明显下降,细胞间距变大,大多数细胞漂浮于培养液中。
2.2 肝癌细胞HepG2的生长抑制率
检测结果显示,2.5μ mol/L SAHA与6.25μ g/ml DDP联合应用120h后,HepG2细胞增殖抑制率达(95.47±2.38)%,显著高于仅用SAHA组 (49.36±1.73)及DDP组 (42.52±1.35)%(均P<0.05),见表1。

表1 各组药物对HepG2细胞增殖的抑制作用 %
2.3 HepG2细胞周期和细胞凋亡率变化
2.5μ mol/L SAHA可导致HepG2细胞S期减少、G2/M 期阻滞,而 SAHA与6.25μ g/ml DDP联用后,对HepG2细胞的S期减少、G2/M 期阻滞更明显。当2.5μ mol/L SAHA与 6.25μ g/ml DDP联用60h后,HepG2细胞凋亡率达 (16.26±1.29)%,明显高于单用SAHA组 (9.25±0.81)%和DDP组 (5.48±0.19)%(均 P<0.05),见表 2。
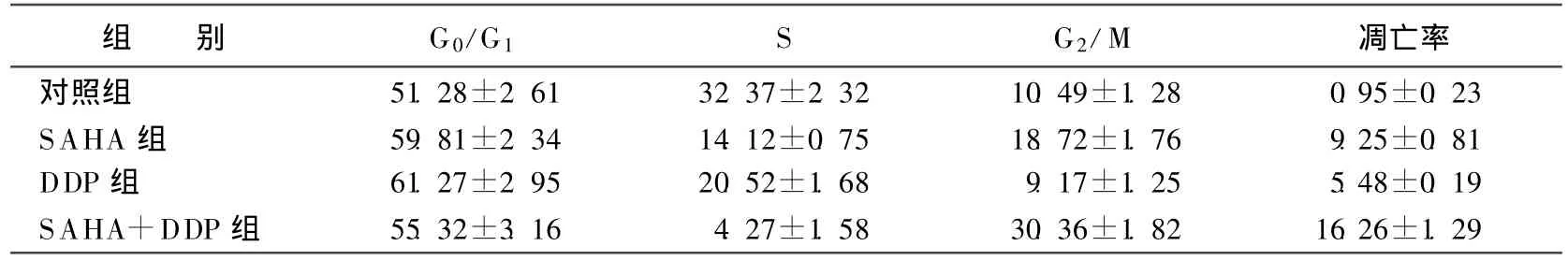
表2 各组药物对HLE细胞周期及凋亡的影响 %
3 讨 论
肝细胞癌是常见的消化道恶性肿瘤,肝细胞癌的发生、发展不仅存在细胞增殖与分化的异常,也与细胞凋亡异常密切相关[2]。近年来,抑制组蛋白去乙酰化酶成为抗肿瘤细胞活性的一种方法,大量研究证明HDAC抑制剂有诱导肿瘤细胞增殖阻滞、分化和凋亡以及选择性地作用肿瘤细胞等抗癌活性[3]。HDAC抑制剂通过抑制HDACs并增强特定蛋白的乙酰化而逆转变异细胞表型,为恶性肿瘤的治疗开拓了新的思路。目前已有多种HDAC抑制剂进入了临床Ⅰ期和Ⅱ期试验,包括MS-275、SAHA、TSA等,已被证实对白血病和实体瘤表现出良好的疗效,不良反应的发生率及发生程度均极低,这说明与传统的化疗药物相比HDACI具有较大的优势[4]。但鉴于HDACI抗肿瘤活性具有可逆性,另外HDACI在治疗肿瘤时毒副作用尚可接受,但长期应用应考虑其毒副作用,故建立HDACI与化疗药物联合治疗有望增加疗效。组蛋白去乙酰化酶抑制剂SAHA是一种新型的广谱类药物,能使HDAC1和HDAC2底物的组蛋白H3乙酰化明显增强,对HDAC有明显的抑制作用。SAHA通过抑制HDAC活性,诱导靶细胞中组蛋白高度乙酰化,从而改变组蛋白与DNA链间结合状态,有利于转录因子与DNA链结合,启动特异性基因表达,从而达到阻断肿瘤细胞生长的作用[5]。组蛋白去乙酰化酶抑制剂药物SAHA在体外能有效抑制肿瘤细胞的增殖,在体内可以抑制实体瘤的生长,并能有效抑制肿瘤血管的形成[6]。SAHA能特异性杀伤肿瘤细胞,对正常细胞影响较小[7]。据报道,Suzuki等[8]应用SAHA联合顺铂治疗口腔鳞状细胞癌,发现SAHA明显增强了顺铂的细胞毒性作用,促进肿瘤细胞凋亡。
本实验通过MTT和流式细胞术检测到了SAHA与化疗药物DDP单用或联合应用时对肝癌细胞HepG2增殖的抑制作用。MT T检查结果显示,2.5μ mol/L SAHA与6.25μ g/ml DDP联合应用后5d,HepG2细胞增殖抑制率达 (95.47±2.38)%,显著高于单用SAHA组的 (49.36±1.73)%和DDP组的 (42.52±1.35)%(均P<0.05),说明苯酰胺类组蛋白去乙酰酶抑制剂SAHA与低剂量化疗药物顺铂联合应用后,能明显诱导肝癌细胞增殖抑制。FCM结果显示,SAHA与DDP联合应用明显导致细胞S期减少,G2/M期阻滞;SAHA联合DDP组细胞凋亡率为 (16.26±1.29)%,显著高于单用SAHA组的 (9.25±0.81)%和DDP组的 (5.48±0.19)%(均P<0.05),说明SAHA与顺铂联合应用,可能通过上调p21基因表达,阻止肿瘤细胞进入S期,使其停滞于G1期,同时发生G2/M期阻滞,肿瘤细胞凋亡率明显增强。由本实验推测,SAHA与DDP联合应用时其抑制肿瘤细胞增殖的机制可能与细胞周期阻滞及上调凋亡作用有关。因此,SAHA与化疗药物DDP在肝细胞癌的治疗上有一定的互补作用,能提高抗肝细胞癌的疗效,并通过降低化疗药物的用量,减少其毒副作用及耐药性。
HDACIs类药物和化疗药物合用已经成为最近肿瘤治疗界的研究热点,该研究的方向是通过HDACIs类药物增加肿瘤细胞对化疗药物顺铂的敏感性起到增效的目的。通过本实验发现SAHA与顺铂联合应用明显优于单独用药组,其作用机制除了通过增强促进HepG2细胞周期阻滞和凋亡作用外,可能还与HDACIs类药物本身特性有关。HDACIs类药物能导致组蛋白乙酰化,使染色质处在一种开放的构象上,会促使顺铂等以DNA为作用靶点的化疗药物更易接近核小体之间的DNA连接区,从而更易发挥作用[9]。本实验联合应用SAHA及化疗药物顺铂处理肝癌细胞,为肝细胞癌的治疗提供新的靶点和全新的联合用药方案。
[1]Siddik Z H.Cisplatin:mode of cytotoxic action and molecular basis of resistance[J].Lung Cancer,2002,38:217.
[2]Haurie V,Mé nard L,Nicou A,et al.Adenosine triphosphatase pontin is overexpressed in hepatocellular carcinoma and co regulated with reptin through a new posttranslational mechanism[J].Hepatology,2009,50(6):1871-1883.
[3]Vigushin D M,Coombes R C.Targeted histone deacetylase inhibition for cancer therapy[J].Curr Cancer Drug Targets,2004,4(2):205-218.
[4]Somech R,Izraeli S,Simon A.Histone deacetylase inhibitors——a new tool to treat cancer[J].Cancer Treat Rev,2004,30(5):461-472.
[5]Zhou Q,Dalgard CL,Wynder C,et al.Histone deacetylase inhibitors SAHA and sodium butyrate block G1-to-S cell cy cle progression in neurosphere formation by adult subventricular cells[J].BMC Neurosci,2011,12(1):50.
[6]T ong A,Zhang H,Li Z,et al.Proteomic analysis of liver cancer cells treated with suberony lanilide hydroxamic acid[J].Cancer Chemother Pharmacol,2008,61(5):791-802.
[7]Noro R,Miyanaga A,Minegishi Y,et al.Histone deacetylase inhibitor enhances sensitivity of non-small-cell lung cancer cells to 5-FU/S-1 via down-regulation of thymidy late synthase ex pression and up-regulation of p21(waf1/cip1)expression[J].Cancer Sci,2010,101(6):1424-1430.
[8]Suzuki M,Endo M,Shinohara F,et al.Enhancement of cisplatin cytotoxicity by SAHA involves endoplasmic reticulum stress-mediated apoptosis in oral squamous cell carcinoma cells[J].Cancer Chemother Pharmacol,2009,64(6):1115-1122.
[9]Johnstone R W.Histone-deacetylase inhibitors:novel drugs for the treatment of cancer[J].Nat Rev Cancer,2002,1(4):287-299.

