KAI-1转移抑制基因在裸鼠肾癌转移中的意义
杜宁克 潘东亮 晋连超 那彦群
(1.北京市门头沟区中医院外科,北京102300;2.北京大学吴阶平泌尿外科医学中心,北京大学首钢医院泌尿外科,北京100144)
KAI-1基因是一个具有2.4kb的肿瘤转移抑制基因,编码白细胞表面糖蛋白,主要参与调控细胞粘附,通过使肿瘤细胞不易脱离原发灶而抑制转移。它在人类多种正常组织中表达,特别以前列腺、肾、肝、肺、骨髓和胎盘表达最高,而且研究显示KAI-1低表达与前列腺癌转移关系密切[1]。本课题组已通过回顾性分析发现T1-3aN0M0肾癌术后转移的发生与KAI-1表达缺失显著相关,提示KAI-1基因缺失可能参与了T1-3aN0M0肾癌术后转移[2]。本课题组于2010年6月~2011年1月通过动物实验进一步验证KAI-1在抑制肾癌转移方面的作用。
1 资料与方法
1.1 肾癌标本和实验动物
1例手术所取的新鲜肾癌标本,通过免疫组织化学和多聚酶链反应(PCR)方法证实为KAI-1表达阴性。BALB/nu裸鼠80只由中国医学科学院实验动物所提供,鼠龄4~5周,体重19~22g,雌雄兼用(饲养和接种在SPF条件下的超净层流架中)。
1.2 主要试剂
培养基MEM(Gibico公司)、CMF-Hanks BSS、胎牛血清、AMV逆转录酶、随机引物、Taq酶、dNTP、RNA酶抑制剂、逆转录缓冲液、PCR缓冲液、质粒和脂质体均购自Promega公司。KAI-1一抗(sc-17752,鼠抗人)购自美国Santa Cruz公司,二抗(PV6002,山羊抗鼠)购自美国PowerVision公司。RNA提取试剂盒购自德国Qiagen公司。RPMI-1640和胎牛血清购自北京中山试剂公司。
1.3 免疫组织化学方法(IHC)和多聚酶链反应(PCR)验证肾癌组织KAI-1的表达
1.3.1 IHC采用Powe r Vision二步法检测KAI-1的表达
将石蜡包埋的组织块切片,厚度为4μm;微波、0.1%胰酶各修复10min;滴加一抗过夜;滴加二抗15min;DAB显色;二甲苯透明,中性树胶封片;光镜观察。结果判断标准:用已知阳性片作阳性对照,用缓冲液代替一抗作阴性对照。以细胞浆、膜出现棕黄色颗粒为KAI-1阳性染色的判断标准。高倍镜(×400)下选择10个有代表性的视野,每个视野计数100个肿瘤细胞,计算阳性细胞百分比。肿瘤细胞相应部位不着色或阳性细胞数<5%为阴性(0);5%~50%为弱阳性(1+);>50%为强阳性(2+)。
1.3.2 PCR步骤 自Genbank查出KAI-1 cDNA序列,设计引物,扩增片断自cDNA的第168位碱基至300位,片断长度为798bp。引物序列如下:正义5'CAAGATCTATGGGCTCAGCCTGTATCAAAGTCACC3',反义5'CCAAGCTTTCAGTACTTGGGGACCTTGCTGTAGTC3';设计β-actin内参照引物1对,扩增片断长度为776bp,引物序列如下:正义5'CTATTGGCAACGAGCGGTTC 3';反义5'CTTAGGAGTGGGGGTGGCTT3',以上引物均由美国Santa Cruz公司提供。组织总RNA抽提按RNA抽提试剂盒的说明进行。凝胶电泳鉴定RNA质量,紫外分光光度计测定RNA含量。逆转录合成cDNA,PCR扩增与电泳,紫外灯下观察记录照相。
1.4 肾癌细胞悬液制备
将所取肾癌组织用PBS洗涤;在培养皿内将肾癌组织用刀切成1~2mm3的小块,用CMF-Hanks BSS洗涤;将组织小块转移到离心试管中,加入CMF-Hanks BSS,晃动10min;吸去CMF-Hanks BSS后,加入0.25%胰酶消化液。封管后置37℃下消化45min;收集细胞悬液,置4℃冰箱内冷却,在所余组织上再一次加入胰酶,重复上述的消化过程,将收集的细胞悬液与已冷却的细胞悬液混合,重复此步骤10次;将细胞悬液用不锈钢网筛过滤,收集滤过液;对滤过液离心,转速1000r/min,离心10min;弃去上清液,将细胞沉淀用少量培养液重新悬浮;用血细胞计数板计数细胞密度,调整细胞密度为1×106个/mL;待接种。
1.5 脂质体介导KAI-1质粒转染KAI-1阴性肾癌细胞
将上述KAI-1阴性肾癌细胞传代培养稳定后,通过脂质体介导KAI-1质粒转染KAI-1阴性肾癌细胞以及转染成功后KAI-1阳性细胞培养传代。调整细胞密度为1×106个/mL;待接种。
1.6 裸鼠皮下成瘤接种实验
将裸鼠分成两组,各40只。每只裸鼠右后肢皮下接种0.2mL含106个细胞的悬液。一组接种肾癌KAI-1表达阳性细胞悬液;另一组接种肾癌KAI-1表达阴性细胞悬液。观察裸鼠接种肿瘤生长情况,1~6周每周测量瘤体长径(a)和短径(b),计算肿瘤体积(V),V=a×b2/2和肿瘤生长率(tumor growth rate,TGR),TGR=(V(第n+1周)/V(第n周))×100%。接种后6周处死裸鼠,取皮下实体肿瘤和肺脏,并将皮下肿瘤称重。
1.7 肺部转移瘤计数
取鼠肺脏,在显微镜下(×40)计数肺表面结节数量。
1.8 IHC和PCR检测原肾癌标本、鼠皮下接种瘤和肺转移瘤KAI-1表达
以上述方法3中的IHC和PCR步骤检测每只裸鼠皮下接种瘤和肺转移瘤及其原肾癌标本的KAI-1表达,比较KAI-1在接种、成瘤和转移过程中的稳定性。
1.9 统计学处理
应用SPSS11.5统计软件进行统计分析;计量资料用均数±标准差(±s)的形式表示,采用t检验,计数资料用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 裸鼠皮下成瘤实验
80只裸鼠接种成瘤均获成活,近1周末时均在接种部位可触及皮下肿瘤。所有裸鼠肿瘤增长迅速,以接种后2~3周最为明显。6周时扪及直径1~2cm大小的块状实性肿物。每周接种瘤平均数据见表1。6周末处死裸鼠,解剖发现裸鼠体内成瘤率均为100%。
表1 裸鼠皮下接种瘤生长速度及体积(±s)
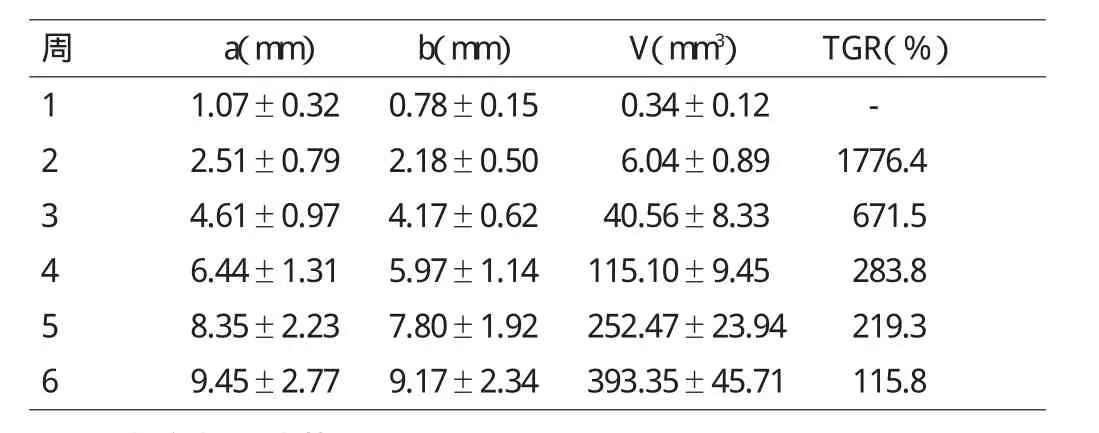
表1 裸鼠皮下接种瘤生长速度及体积(±s)
周a(mm) b(mm) V(mm3) TGR(%)1 1.07±0.32 0.78±0.15 0.34±0.12 -2 2.51±0.79 2.18±0.50 6.04±0.89 1776.4 3 4.61±0.97 4.17±0.62 40.56±8.33 671.5 4 6.44±1.31 5.97±1.14 115.10±9.45 283.8 5 8.35±2.23 7.80±1.92 252.47±23.94 219.3 6 9.45±2.77 9.17±2.34 393.35±45.71 115.8
2.2 肺脏表面结节数量
KAI-1表达阳性组:成瘤肿物1.58~2.53g,平均2.16g。38只裸鼠肺脏表面可见直径1~2mm灰红色米粒状结节,40只裸鼠结节数量0~11个,平均6个。KAI-1表达阴性组:成瘤肿物1.34~2.79g,平均2.32g。39只裸鼠肺脏表面可见直径1~2mm灰红色米粒状结节,40只裸鼠结节数量0~57个,平均31个。经统计学处理,两组肺脏结节数量比较χ2=5.01,P<0.05。
2.3 IHC和PCR对接种瘤、肺转移瘤和原肾癌标本的检测
镜下见皮下接种瘤和肺转移瘤呈实性结构,瘤细胞分布密集、杂乱,大小不一,核分裂相多见,胞浆呈透明状。经IHC(图1)和PCR(图2)检测,每只裸鼠接种瘤和肺转移瘤的KAI-1表达均与原肾癌标本一致。

图1 KAI-1表达阳性肾细胞癌肺转移瘤KAI-1免疫组织化学染色(2+)(×200)

图2 RT-PCR检测肾癌中KAI-1基因阳性表达:表现为约800bp处特异核酸片断条带
3 讨论
尽管有关肾癌转移研究成果的报道不断增多,但其转移机理仍未明确。例如,VHL肿瘤抑制基因的失活可导致肿瘤血管内皮生长因子过度生成,促进肿瘤血管形成和肾癌的转移[3];VHL基因的丢失通过低氧诱导因子途经转导CUB域包含蛋白1信号给PKCδ,激活并增加肾癌细胞的转移[4]。其他研究显示,CD151高表达与肾透明细胞癌的高期高核级别相关[5];Forkhead转录因子1与肾癌细胞级别和Ki67表达相关[6];Glutathione S转化酶是一种高度特异性的预测肾癌进展和预后的标记物[7]。VHL肿瘤抑制基因、MET原癌基因、TFE3转录因子癌蛋白等多种因素及途径共同参与了肾癌的进展[8]。男性肾癌具有更高的临床分期和诊断时更高的转移发生率、更低的肿瘤特异性存活率,但是性别仍不是独立的预后指标[9]。这进一步丰富了肾癌转移机理,但是仍不能为临床工作提供直接、确切、实用的标记物。
KAI-1氨基酸序列的保守性可使鼠实验结果对人类具有高度提示意义。KAI-1基因翻译出的蛋白质与已发现的CD82结构相同,是TM4SF(transmembrane 4 superfamily)或TST(tetra spans transmembrane)家族成员。CD82的氨基酸序列在人、猴、狗、兔、牛与大、小鼠中相当保守[10]。因此,在裸鼠体内研究所得KAI-1转移抑制基因表达与肾癌转移关系的结果对人类也具有重要的提示意义。本研究选用的两种肾癌细胞株具有同一来源,基因组中仅有KAI-1全或无的差别;而且在实验中反复通过免疫组织化学和PCR方法进行测试排除了KAI-1发生突变的可能性,所以保证了实验结果的科学性和可靠性。
KAI-1表达缺失组裸鼠肺脏表面转移灶数量增多。本实验中KAI-1表达阳性组裸鼠肺脏表面的转移瘤数量为0~11个,平均6个;KAI-1表达阴性组转移瘤数量为0~57个,平均31个;两者数量比较具有统计学意义,证实了KAI-1表达缺失促进了肾癌细胞的转移,为临床检测KAI-1表达预测肾癌转移提供了可靠的实验依据。另外本实验发现,在裸鼠皮下的成瘤实验6周内中出现了肺脏转移瘤,提示肾癌转移发生的时间可能较早,只是最早发生转移的时间以及与原发瘤大小的关系尚缺乏研究。本实验还显示,即使KAI-1表达阳性组肾癌也有转移瘤,只是与KAI-1表达阴性组相比数量较少,说明KAI-1基因不是决定肾癌转移的唯一因素。
[1]Dong JT,Lamb PW,Rinker-Schaeffer CW,et al.KAI1,a metastasis suppressor gene for prostate cancer on human chromosome 11p11.2[J]. Science,1995,268(5212):884-886.
[2]潘东亮,严秋哲,杨勇.KAI-1、Ki-67和HER-2/neu表达在T1-3N0M0肾癌术后转移中的意义[J].中国癌症杂志,2007,17(3):248-251.
[3]Hutson TE,Sonpavde G,Galsky MD.Targeting growth factor and antiangiogenic pathways in clear-cell renal cell carcinoma:rational and ongoing trials[J].Clin Genitourin Cancer,2006,5(1):S31-S39.
[4]Razorenova OV,Finger EC,Colavitti R,et al.VHL loss in renal cell carcinoma leads to up-regulation of CUB domain-containing protein 1 to stimulate PKC(delt)-driven migration[J].Proc Natl Acad Sci USA,2011,108(5):1931-1936.
[5]Yoo SH,Lee K,Chae JY,et al.CD151 expression can predict cancer progression in clear cell renal cell carcinoma[J].Histopathology,2011,58(2):191-197.
[6]Toma MI,Weber T,Meinhardt M,et al.Expression of the Forkhead transcription factor FOXP1 is associated with tumor grade and Ki67 expression in clear cell renal cell carcinoma[J].Cancer Invest,2011,29(2):123-129.
[7]Searchfield L,Price SA,Betton G,et al.Glutathione S-transferases as molecular markers of tumour progression and prognosis in renal cell carcinoma[J].Histopathology,2011,58(2):180-190.
[8]Nagi FM,Omar AA,Mostafa MG,et al.The Expression Pattern of Von Hippel-Lindau Tumor Suppressor Protein,MET Proto-oncogene,and TFE3 Transcription Factor Oncoprotein in Renal Cell Carcinoma in Upper Egypt[J].Ultrastruct Pathol,2011,35(2):79-86.
[9]Waalkes S,Rott H,Herrmann TR,et al.Does male sex influence the prognosis of patients with renal cancer[J].Onkologie,2011,34(1-2):24-28.
[10]Dong JT,Issacs WB,Barret JC,et al.Genomic organization of the human KAI-1 metastasis suppressor gene[J].Genomics,1997,41(1): 25-32.

