G250基因沉默对肾癌 786-0细胞增殖和细胞周期的影响
赵俊峰 郑少斌 姜耀东 杨旭凯 肖耀军
(河南省中医院 河南中医学院第二附属医院泌尿外科,河南 郑州 450002)
肾癌发生发展的分子机制研究中,G250是公认的肾透明细胞癌肿瘤相关抗原,但 G250基因在肾透明细胞癌发病中的作用尚不明确,多数研究结果显示G250基因可能是一种癌基因〔1〕,并且参与了肾肿瘤细胞的生长与转移〔2〕。为进一步了解该基因在肾癌发生、发展中的作用,本实验利用RNA干扰技术阻断 G250基因表达,观察了沉默 G250基因对肾癌 786-0细胞体外增殖及细胞周期的影响。
1 材料与方法
1.1 材料与试剂 人肾透明细胞癌 786-0细胞株(以下称肾癌 786-0细胞)及大肠杆菌(DH5α)由南方医科大学南方医院泌尿外科保存。胎牛血清及 RPMI1640培养基(美国GIBCO公司),0.25%胰蛋白酶、碘化丙锭(PI)、噻唑蓝(MTT)、二甲基亚砜(DMSO)、磷酸盐缓冲液(PBS)(美国 Sigma公司),二甲苯、多聚甲醛、柠檬酸钠、苏木素(成都化学试剂厂)。Biol-Rad酶联免疫检测仪(德国 BioRad公司),ELITE流式细胞仪(美国BECKMAN-COULTER公司)。
1.2 方法
1.2.1 重组质粒的构建及siRNA转染 G250 mRNA的全长序列从 NCBI基因库(登录号:AJ010588)检索得出。应用Primer express软件按照siRNA设计原则寻找含 21个碱基的特异性序列,根据p RNAT-U6.1/Neo质粒的结构,设计出特异性干扰片段的核苷酸序列,并构建重组质粒(命名为pshRNA-G250)。在前期实验的基础上,选择二条最有效的G250的siRNA片段,靶位点 970-990和 293-313。肾癌 786-0细胞培养时培养基为含 10%胎牛血清的 RPMI1640,置 37℃,95%饱和湿度,体积分数为 5%的 CO2培养箱中培养。转染前 24 h,传代至 24孔板,每孔 1.5×105个细胞。依说明书用 LipofectamineTM2000转染。转染后 6 h换成完全培养基继续培养。
1.2.2 转染后肾癌 786-0细胞体外增殖实验 将转染后的 4组细胞(si-G250-a、si-G250-b、转染阴性对照和空质粒,分别命名为 786-0/si-G250-a、786-0/si-G250-b、786-0/si-G250-n和 786-0/si-G250-0),用 0.25%胰蛋白酶消化后用含 10%胎牛血清培养液配成单个细胞悬液,调整细胞浓度为 50 000个细胞/ml,以每孔 100μl接种到 96孔板,同时设置空白孔调零,以只加培养液不加细胞做比色对照。培养 12 h后,每孔加培养液补齐至100μl。终止培养前 4 h,每孔加 20μl 5 mg/ml的四氮唑蓝盐(MTT)溶液,在磁力搅拌器上混匀 30 min,继续孵育 4 h,整个培养板上离心机,配平后开始低速离心 3 000 r/min,10 min后取下,小心吸弃孔内培养上清液。每孔加 100μl DMSO,室温孵育 10min,微振荡器振荡 15 min,使结晶物充分溶解,用 Biol-Rad酶联免疫检测仪在 570 nm测光密度值(OD值)。每组设 3个重复孔,取平均值,以时间为横坐标,OD值为纵坐标绘制重组质粒转染 786-0细胞 1~7d后的细胞生长增殖曲线。
1.2.3 流式细胞术分析细胞周期 取生长状态良好的转染72 h后的转染空质粒及 pshRNA-G250-b(干扰效率最高)肾癌786-0细胞(分别命名为 786-0/si-G250-0和 786-0/si-G250-b细胞),待细胞密度达 80%~90%时,0.25%胰酶室温消化,台盼蓝拒染法计数细胞,使收集细胞总数约 1×106,1 000 r/min,离心 10min,用冷 PBS洗两次,缓慢加入 -20℃预冷的 70%乙醇1.5ml固定细胞,充分震荡,使细胞分散,4℃保存待测。上机测定前离心去乙醇,用 PBS洗两次,加 100μg/ml RNase 200μl,37℃消化 30 min。 PI 50μg/ml染色 30min,ELITE.流式细胞仪 488 nm激发波长、功率 15mW测定,用美国 PHEONIX公司的 Multicycle软件分析细胞周期的分布,最后计算出细胞各期的百分数。
1.3 统计学分析 应用SPSS13.0统计软件进行处理,数据均以±s表示,细胞周期变化两组均数间的比较用两独立样本 t检验,细胞体外增殖实验采用重复测量数据的方差分析。
2 结 果
2.1 G250基因表达沉默对肾癌 786-0细胞体外增殖能力的影响 经重复测量数据的方差分析,四组之间差异显著(F=360.170,P=0.000),多重比较得出四组细胞两两之间的差异除空白组和阴性组比较无统计学意义(P=0.263),其余各组均有统计学意义。这些结果说明 G250表达水平降低后,肾癌786-0细胞的体外增殖能力受到抑制。见图 1。
2.2 流式细胞术分析细胞周期 Multicycle软件分析 786-0/si-G250-0和 786-0/si-G250-b细胞流式细胞仪检测细胞周期的分布,转染干扰载体的 786-0/si-G250-b细胞较转染空质粒的786-0/si-G250-0细胞的细胞周期分布发生较大变化,其主要改变表现为 G250基因表达降低后 G0/G1期细胞增多,而 S期、G2/M期细胞则减少。说明 G250基因表达降低后肾癌 786-0细胞出现了细胞周期的 G0/G1期阻滞。见表 1,图 2。

图1 实验各组细胞体外MTT法增殖能力比较(OD值)
表1 流式细胞术分析 786-0/si-G 250-0和786-0/si-G 250-b细胞周期(±s,n=3,%)
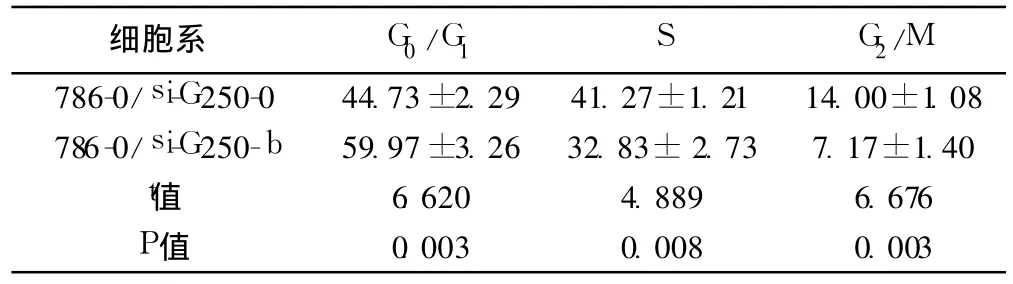
表1 流式细胞术分析 786-0/si-G 250-0和786-0/si-G 250-b细胞周期(±s,n=3,%)
细胞系 G0/G1 S G2/M 786-0/si-G250-0 44.73±2.29 41.27±1.21 14.00±1.08 786-0/si-G250-b 59.97±3.26 32.83±2.73 7.17±1.40 t值 6.620 4.889 6.676 P值 0.003 0.008 0.003

图2 流式细胞术分析 786-0/si-G250-0和786-0/si-G 250-b细胞周期分布
3 讨 论
本实验研究表明 G250基因表达沉默后,肾癌 786-0细胞体外增殖能力明显减低,提示G250基因在促进细胞增殖、转化方面有重要的作用〔1,3〕。体外细胞的增殖实验发现 G250基因表达沉默后,不仅肾癌786-0细胞体外增殖能力下降,而且随着时间的延长表现出与对照组细胞体外增殖能力差异的加大,说明选择 pRNAT-U6.1/Neo质粒作为载体构建siRNA重组体的干扰效果稳定。
资料显示,恶性肿瘤细胞的基因表达和功能异常往往伴随着广泛的细胞周期调节失控,导致细胞分化受阻,使肿瘤细胞呈过度增殖状态〔4〕。在细胞周期中,有 G0/G1、G1/S和 G2/M 3个调控点影响细胞周期,尤其是 G1→S期、G2→M期转化过程,可使细胞周期停止,抑制细胞增殖,进入细胞周期的细胞也可发生凋亡而离开细胞周期。其中 G1调控点的存在可防止用损伤的DNA作为模板进行DNA复制,允许损伤的DNA在关键的细胞功能发生改变之前修复,可增加细胞存活时间,限制带有可遗传的基因损伤的细胞增殖〔5〕。因此凡是影响肿瘤细胞增殖的作用都存在细胞周期的变化。本实验发现,G250基因表达降低后 G0/G1期细胞增多,而 S期、G2/M期细胞减少。说明G250基因表达沉默可以导致肾癌 786-0细胞G0/G1期阻滞,降低肾癌 786-0细胞 DNA的合成,从而抑制细胞生长和增殖,提示 G250基因与肾癌细胞的生长和增殖呈正相关。
多项研究发现在细胞周期的调控体系中,有多种因子参与,其中细胞周期蛋白的周期特异性、时相特异性积累与分解是确保周期有序变更的基础〔6〕,包括 cyclin D1和 cyclin E1在G0/G1至 S期转换中都起主要作用〔7,8〕,它们在 G1期进入 S期时高表达,与肿瘤细胞侵袭力、转移密切相关〔9〕。因此可以推断 G250基因表达沉默影响细胞周期阻滞在G1期的主要机制可能是下调 cyclin D1的表达,从而阻滞肾癌 786-0细胞 G0/G1期至S期的进程,抑制了细胞增殖。而很早以前的研究就已经发现 G250的cDNA转染到小鼠的 NIH3T3成纤维细胞中可使细胞周期缩短,DNA合成增多〔10〕。所以真正的机制还有待进一步探讨。
1 Zavada J,Zavadova Z,Pastorek J,et al.Human tumor-associated cell adhesion protein MN/CA IX:identification of M75epitope and of theregion mediating cell adhesion〔J〕.Br J Cancer,2000;82(11):1808-13.
2 Cho M,Uemura H,Kim SC,et al.Hypomethylation of the MN/CA9 promoter and upregulated MN/CA9 expression in human renal cell carcinoma〔J〕.Br JCancer,2001;85(4):563-7.
3 Mc Kiernan JM,Buttyan R,Bander NH,et al.Expression of the tumor-associated gene MN:a potential biomarker for human renal cell carcinoma〔J〕.Cancer Res,1997;57(12):2362-5.
4 刘秉文,陈俊杰.医学分子生物学〔M〕.北京:中国协和医科大学出版社,2000:221-37.
5 Zhang J,Hua ZC.Targeted gene silencing by small interfering RNA-based knock-down technology〔J〕.Curr Pharm Biotechnol,2004;5(1):1-7.
6 Bahnassy AA,Zekri AR,Alam El-Din HM,et al.The role of cyclins and cyclins inhibitors in the multistep process of HPV-associated cervical car-cinoma〔J〕.J Egypt Natl Canc Inst,2006;18(4):292-302.
7 Stacey DW.Cyclin D1 serves as a cell cycle regulatory switch in actively proliferating cells〔J〕.Curr Opin Cell Biol,2003;15(2):158-63.
8 Shariat SF,Ashfaq R,Sagalowsky AI,et al.Association of cyclin D1and E1expression with disease progression and biomarkers in patients with non-muscle-invasive urothelial cell carcinoma of the bladder〔J〕.Urol Oncol,2007;25(6):468-75.
9 Nauman A,Turowska O,Poplawski P,et al.Elevated cyclin Elevel in human clear cell renal cell carcinoma:possible causes and consequences〔J〕.Acta Biochem Pol,2007;54(3):595-602.
10 Pastorek J,Pastorekova S,Callebaut I,et al.Cloning and characterization of MN,a human tumor-associated protein with a domain homologous to carbonic anhydrase and a putative helix-loop-helix DNA binding segment〔J〕.Oncogene,1994;9(10):2877-88.

