Let-7a-1前体和 K-ras在食管癌中的表达及意义
汪林宝 赵 松 (郑州大学第一附属医院,河南 郑州 450052)
MicroRNA(miRNA)是近年来被发现的在自然界生物体中广泛存在的大小 21~23 nt的一类非编码小分子 RNA〔1,2〕,在转录后水平对编码蛋白的 mRNA进行调控,抑制基因表达〔3〕。尽管 miRNA的生物学作用及调控的目标基因还没有完全清楚,但它在细胞分化、增殖、死亡等复杂的生物学过程中的调控作用已经得到证实〔4〕。特别是 miRNA家族中的 let-7在人类肺癌、结肠癌、胃癌、乳腺癌中低表达表明它作为抑癌miRNA参与肿瘤的发生发展,并且在某些肿瘤中抑制癌基因 Ras和c-myc的表达〔5~9〕。
目前对miRNA进行检测的主要方法有RT-PCR、Northern印迹、cDNA arrays,它们有各自的优缺点,miRNA前体同miRNA成熟体的表达水平基本上是一致的〔10〕。本研究采用RTPCR法对let-7a-1前体和 K-ras在食管癌及正常食管黏膜中进行半定量检测,初步探讨其在食管癌发生、发展过程中的作用,为食管癌的诊断、基因治疗提供理论依据。
1 材料与方法
1.1 标本收集及处理 收集 2010年 7月郑州大学第一附属医院胸外科手术切除的新鲜食管癌标本 20例,标本离体30min内分离切端正常食管黏膜(距肿块边缘>5cm)及癌组织,置入冻存管中液氮迅速冷冻后,放入 -80℃冰箱中保存。经病理证实 20例癌组织中 17例为鳞癌,3例为腺癌。所有食管癌患者术前均未接受化疗、放疗。其中男 13例,女 7例;年龄 47~83〔平均(63.30±8.66)〕岁;中分化 16例,高分化 4例;有淋巴结转移 7例,无淋巴结转移 13例;肿瘤分期(食管癌国际 TNM分期标准第 7版):Ⅰ期 1例,Ⅱ期 14例,Ⅲ期 5例。
1.2 方法
1.2.1 RNA提取 每份标本取约 0.1 g,充分研磨后,加入 Trizol试剂(Invitrogen公司)和三氯甲烷提取 RNA,异丙醇沉淀,75%乙醇洗涤,干燥后溶入 20~30μl焦碳酸二乙酯水溶液中,所得的总 RNA用分光光度计测定其浓度和纯度。
1.2.2 cDNA合成 根据 RevertAidTM第一链 cDNA合成试剂盒(MBI Fermentas公司)使用说明,其中总 RNA约 1μg,Oligo(dt)18引物 1μl,逆转录酶 M-MuLV 1μl,总反应体系为20μl,在 42℃,60 min逆转录完毕后,70℃加热 10 min结束反应,-70℃冷冻保存或置于冰上进行后续试验。
1.2.3 PCR扩增反应 2×Taq PCR MasterMix试剂盒(北京天根生化科技有限公司)的产品组成:1 U/10μl Taq Polymerase,500μmol/L dNTP,3 mmol/L MgCl2,20 mmol/L Tris-HCl,100mmol/L KCl,其他稳定剂和增强剂。引物由上海生工生物工程有限公司合成,引物序列见表 1。25μl反应总体系含12.5μl 2×MasterMix,7μl dd H2O,let-7a-1前体和 K-ras上下游引物各 1μl,β-actin上下游引物各 1μl,1.5μl cDNA。let-7a-1前体 PCR反应循环的设置:94℃预变性 3 min,94℃ 30 s,57℃ 30 s,72℃ 1 min,进行 30个循环后 72℃ 延伸 5 min。K-ras PCR反应循环的设置:94℃预变性 3 min,94℃ 30 s,60℃30 s,72℃ 1min,进行 30个循环后 72℃延伸 5min。

表1 let-7a-1前体、K-ras和 β-actin引物序列及其片段大小
1.2.4 PCR产物半定量分析 反应完毕后,取 5μl PCR扩增产物进行 1.5%琼脂糖凝胶电泳,并在凝胶紫外成像仪(英国Syn-gene公司)上成像和 GeneTools分析软件上测定分析,以目的基因和内参条带的比值作为目的基因的相对含量。
1.3 统计学分析 使用SPSS16.0统计学分析软件,计量数据以±s表示,组间比较采用独立样本配对 t检验,相关性分析采用 Pearson相关性分析。
2 结 果
2.1 Let-7a-1前体和 K-ras在食管癌及其配对癌旁组织中的表达 在琼脂糖凝胶上可见 105 bp、390 bp和 696bp的条带分别为 let-7a-1前体、k-ras和 β-actin。与正常食管黏膜相比,癌组织中 let-7a-1前体表达显著降低(>2倍)占 40%。癌组织中K-ras表达显著增高(>2倍)占 30%。经 lg转化后 Let-7a-1前体 mRNA和K-ras mRNA的相对含量均符合正态分布,经统计分析,let-7a-1前体在食管癌组织及配对正常黏膜组织中表达量差异有统计学意义,let-7a-1前体 mRNA在食管癌组织中表达下调;而K-ras在食管癌组织及配对正常黏膜组织中表达量差异无统计学意义。Let-7a-1前体和 K-ras在食管癌中的表达无相关性(P>0.05)。见图 1,图 2,表 2。
表2 食管癌及正常食管黏膜中let-7a-1前体和K-ras的表达(±s)

表2 食管癌及正常食管黏膜中let-7a-1前体和K-ras的表达(±s)
与正常黏膜组比较:1)P<0.05
组别 n Let-7a-1前体 K-ras食管癌组 20 0.288±0.4391) 0.238±0.775正常黏膜组 20 0.650±0.704 -0.050±0.943
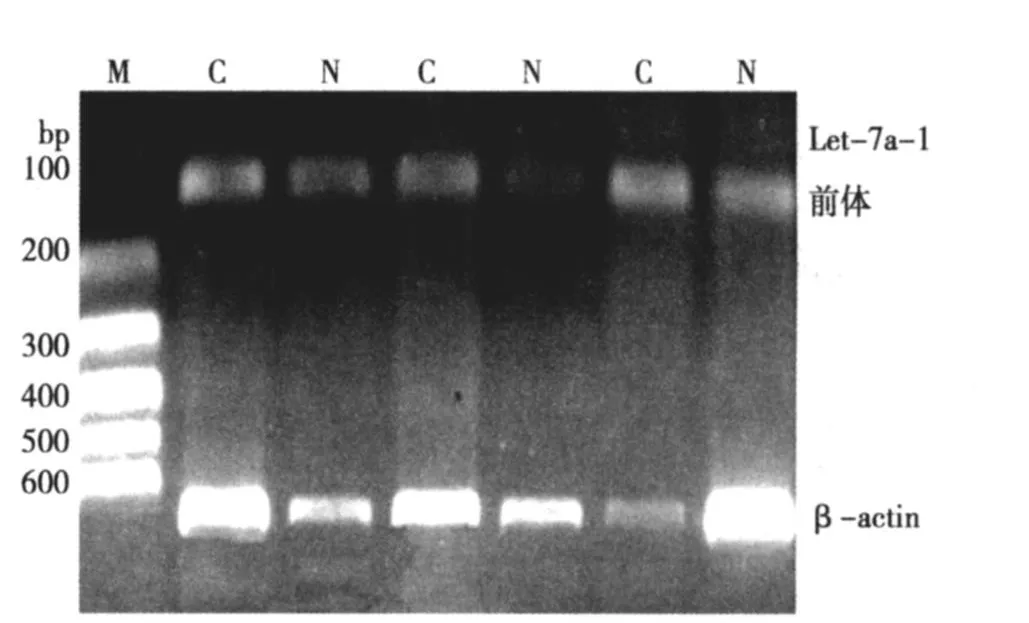
图1 let-7a-1前体PCR扩增的结果
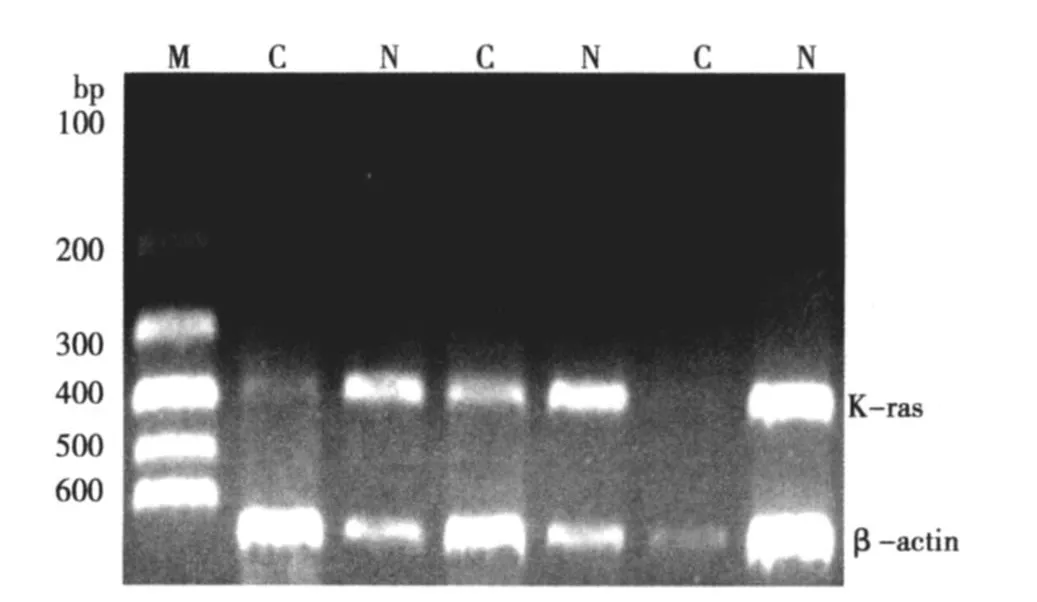
图2 K-ras PCR扩增的结果
2.2 Let-7a-1前体和 K-ras在食管癌中的表达与主要临床病理特征的关系 Let-7a-1前体和K-ras的表达量与性别、年龄、肿瘤分化、淋巴结转移、病理类型及 TNM分期无明显相关性(P>0.05)。见表 3。

表3 let-7a-1前体和 K-ras表达与食管癌临床病理特征的关系
3 讨 论
近年来,一个与细胞分化、增殖、死亡等密切相关的 miRNA逐渐进入了肿瘤研究领域,miRNA作为类似癌基因和抑癌基因参与细胞增殖、凋亡和分化的调控,在肿瘤的发生发展过程中发挥着重要的生物学功能。miRNA家族中研究较多的let-7最先在秀丽隐杆线虫中被发现,是一个 21核苷酸的 RNA分子,主要作用是促进幼虫向成虫转变〔11〕。它有 14个亚型,通常每个亚型位于不同的染色体,let-7a-1位于 9q22.3。let-7与肺癌、结肠癌、胃癌、乳腺癌的发生密切相关,但 let-7在食管癌中的表达及其与临床生物病理学特征的联系几乎还未见报道。
本实验通过 RT-PCR法对 20例食管癌患者的食管组织中let-7a-1前体及K-ras进行半定量检测,结果显示食管癌组织中let-7a-1前体显著降低,表明它可能作为抑癌基因参与食管癌的发病过程,但与其余生物病理学特征无相关性,可能是样本量不足造成的;K-ras在食管癌与正常食管黏膜中的表达差异无统计学意义,表明它在食管癌的发生过程不具有重要意义,这与 Jian等〔12〕研究结果相似。统计学显示 let-7a-1前体与K-ras的表达不具有相关性,表明K-ras在食管癌中不是 let-7a-1的靶基因,而 2005年 Johnson等〔13〕发现人类的 3个 RAS癌基因(H-ras,K-ras,N-ras)的 3′端非翻译区含有 Let-7的互补配对位点,使 Let-7能够调节其表达。这可能是由于 miRNA与靶基因的复杂关系造成的,即不同miRNA可作用于同一靶基因,而不同的 miRNA在不同组织或细胞中的靶基因有可能不同。
对食管癌相关基因的检测有助于食管癌的诊断、预后评估及治疗。对同一肿瘤不同 miRNA的定量分析可以对肿瘤进行分期,预测患者预后〔14〕,也为肿瘤的靶向治疗提供了可能。目前应用 miRNA治疗肿瘤主要有两个策略,一是针对肿瘤中下调的 miRNA转染 miRNA前体以纠正 miRNA的表达,如应用let-7前体可以抑制肺癌细胞株 A549的增殖〔5,15〕,二是应用反义核苷酸抑制上调的 miRNA,如针对miRNA-122的小分子核苷酸链能使小鼠血清中胆固醇的水平降低〔16,17〕。本研究初步证实let-7a-1前体在食管癌中低表达,而如何安全有效地将let-7a前体导入到食管癌肿瘤细胞内,以及导入到癌细胞内的let-7a前体对食管癌发展产生何种影响都亟待进一步研究。
综上所述,let-7a-1在食管癌中低表达引起其下游调控基因表达失调,因而参与食管癌的发生、发展过程。本实验仅对食管癌中的 let-7a-1进行半定量检测,因此还需要高效率的检测方法,例如基因芯片技术,以发现更多参与食管癌发生、发展的相关 miRNA。相信随着 miRNA研究的飞速进展,必将为食管癌的诊断和治疗带来新的希望。
1 Ambros V.MicroRNAs:tiny regulators with great potential〔J〕.Cell,2001;107(7):823-6.
2 Ambros V.MicroRNA pathways in flies and worms:growth,death,fat,stress,and timing〔J〕.Cell,2003;113(6):673-6.
3 Ambros V.The functions of animal microRNAs〔J〕.Nature,2004;431(7006):350-5.
4 Krutzfeldt J,Poy MN,Stoffel M.Strategies to determine the biological function of microRNAs〔J〕.Nat Genet,2006;38:14-9.
5 Takamizawa J,Konishi H,Yanagisawa K,et al.Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival〔J〕.Cancer Res,2004;64(11):3753-6.
6 Akao Y,Nakagawa Y,Naoe T.Let-7 microRNA functions as a potential growth suppressor in human colon cancer cells〔J〕.Biol Pharm Bull,2006;29(5)903-6.
7 Zhang HH,Wang XJ,Guo XL,et al.Detection of let-7a microRNA by real-time PCR in gastric carcinoma〔J〕.World J Gastroenterol,2007;13(20):2883-8.
8 He XY,Chen JX,Zhang Z,et al.The let-7a microRNA protects from growth of lung carcinoma by suppression of k-Ras and c-Myc in nude mice〔J〕.J Cancer Res Clin Oncol,2010;136(7):1023-8.
9 Yan F,Yao YH,Zhu P,et al.Let-7 regulates self renewal and tumorigenicity of breast cancer Cells〔J〕.Cell,2007;131(6):1109-23.
10 Jiang J,Lee EL,Gusev Y,et al.Real-time expression profiling of microRNA precursors in human cancer cell lines〔J〕.Nucleic Acids Res,2005;33(17):5394-403.
11 Reinhart BJ,Slack FJ,Basson M,et al.The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans〔J〕.Nature,2000;403(2772):901-7.
12 Li J,Feng CW,Zhao ZG.A preliminary study on ras protein expression in human esophageal cancer and precancerous lesions〔J〕.World J Gastroenterol,2000;6(2):278-80.
13 Johnson SM,Grosshans H,Shingara J,et al.RAS is regulated by the let-7 microRNA family〔J〕.Cell,2005;120:(5)635-47.
14 Yanaihara N,Caplen N,Bowman E,et al.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis〔J〕.Cancer Cell,2006;9(3):189-98.
15 Cheng AM,Byrom MW,Shelton J,et al.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis〔J〕.Nucleic Acids Res,2005;33(4):1290-7.
16 Weiler J,Hunziker J,Hall J.Anti-miRNA oligonucleotides(AMOs):ammunition to target miRNAs implicated in human disease〔J〕?Gene Ther,2006;13(6):4962-502.
17 Esau CC,Monia BP.Therapeutic potential for microRNAs〔J〕.Adr Drug Deliv Rev,2007;59(2-3):101-14.〔2010-05-10收稿 2010-07-20修回〕

