茭白黑粉菌脉冲电泳分析方法
王晓清,张敬泽,褚福强,张艳丽,郭得平
(浙江大学农业与生物技术学院,杭州,310058)
茭白黑粉菌脉冲电泳分析方法
王晓清,张敬泽,褚福强,张艳丽,郭得平
(浙江大学农业与生物技术学院,杭州,310058)
采用脉冲电泳法对茭白黑粉菌染色体进行核型分析。分析结果表明,茭白黑粉菌脉冲电泳样品处理方法包括原生质体的制备、电泳参数的设置等,对试验结果有一定影响,在制备电泳样品时,包埋的原生质体或孢子的浓度不能太低,蛋白酶K的浓度不能过高,低熔点琼脂糖的浓度不能太低,此外还应确保电泳槽水平,并且电泳结束后及时取出凝胶。
茭白黑粉菌;原生质体;脉冲电泳;核型分析
在茭白(Zizania latifoliaTurcz.)生长期间,茭白黑粉菌(Ustilago esculentaP.Henn.)与茭白植株共生,并在茭白植株体内分泌代谢产物刺激茭白茎基部膨大形成肉质茎[1]。茭白黑粉菌诱导茭白茎膨大的机制目前还不清楚,主要与茭白黑粉菌和植株互作的分子机制研究缺少有关,因此,深入研究其分子生物学特性亟待进行。
核型是指动物、植物、真菌等真核生物的某一个体或某一分类群的细胞内染色体组中染色体的数目、大小和形态[2]。明确基因组染色体数目和大小是基因组分析的基础工作,对搞清基因组DNA的全部核苷酸顺序结构,识别所有基因的编码,测定基因的位置及它们的功能有重要意义,是分子生物学乃至整个生命科学领域一项十分重要的基础性工作[3]。
由于真菌染色体较小以及可能获得的遗传标记较少,因此难以用传统的染色体技术和光学显微镜观察或通过基因间建立遗传学连锁关系的方法对其进行测定。脉冲电泳技术可分离大分子量的DNA的极限为10 Mb,为真菌染色体的研究提供了技术平台[4]。脉冲电泳广泛用于真菌的核型分析,通过它可以直接得到真菌染色体的数目,每条染色体分子量以及染色体总量。本方法参考了多位前人脉冲电泳的方法,采用改进的脉冲电泳法对茭白黑粉菌染色体组进行核型分析。
1 材料与方法
1.1 材料准备
取已分离、纯化的茭白黑粉菌单孢菌落,接种于液体培养基中,在28℃,180 r/min条件下摇瓶。培养 48 h后,将培养基倒入 50 mL离心管中,10 000 r/min离心10 min,收集孢子。
液体培养基:蔗糖10 g,葡萄糖10 g,L-Asp 2 g,马铃薯200 g,水1 000 mL。按照各物质使用浓度要求加入青霉素、链霉素、维生素B1。
1.2 主要试剂及仪器
STC缓冲液:0.05 mol/L Tris-His(pH=8.0),0.05 mol/L CaCl2,0.8 mol/L山梨醇;酶液:用0.7 mol/L NaCl配制10 mg/mL溶解酶 (Sigma)+10 mg/mL崩溃酶(Sigma)+10 mg/mL蜗牛酶(北京拜尔迪生物技术有限公司)的混合酶液后,8 800 r/min离心,上清液用直径0.22 μm过滤器过滤除菌,现配现用。
蛋白酶K缓冲液:100 mmol/L EDTA(pH= 8.0)、1%月桂酰肌氨酸、0.2%脱氧胆酸钠、1 mg/mL蛋白酶K[5]。
SCE缓冲液:1 mol/L山梨醇,20 mmol/L柠檬酸钠(pH=5.8),10 mmol/L EDTA。
低熔点琼脂糖、蛋白酶K、Tris、EDTA、溴化乙锭、高强度琼脂糖、月桂酰肌氨酸、脱氧胆酸钠均购自上海生工生物工程技术服务有限公司,其他试剂均为分析纯。
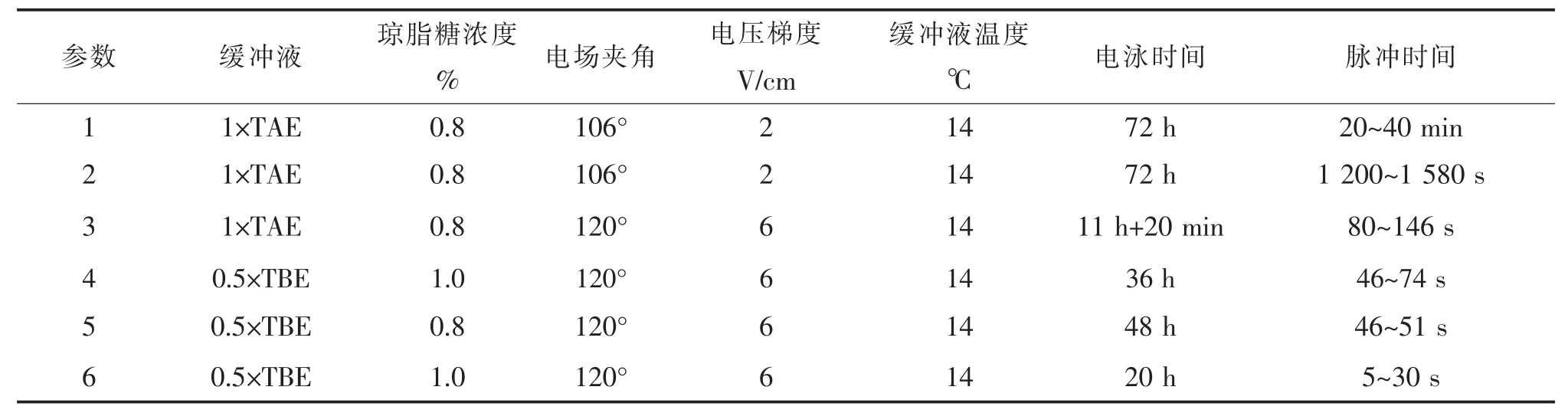
表1 电泳参数设置
主要仪器有水平摇床、低温离心机、具有Axiocam CCD摄像头和Axiovision数字成像软件(Axio Vision Software Release 3.1., Carl Zeiss Vision Imaging Systems)的Zeiss Axiophot 2显微镜、电泳系统(Bio-Rad CHEF Mapper)、数码凝胶成像系统(Fine-do X3)。
1.3 茭白黑粉菌原生质体的获得
①将离心收集到的孢子用无菌水振荡、离心洗涤2次。再用0.7mol/LNaCl溶液振荡、离心洗涤1次。
②尽量倒干水分,加入酶液(菌体∶酶液=1 g∶10 mL),摇动以混合均匀。30℃,100 r/min酶解3 h[6]。30 min后观察有无原生质体释放,以后每隔30 min观察1次。
③酶解后的原生质体用4层擦镜纸过滤,过滤前先用STC缓冲液润湿擦镜纸,过滤完后用STC缓冲液冲洗擦镜纸。
④将收集到的滤液4 000 r/min,4℃离心10 min,移液枪吸取上清,检查是否有原生质体。若上清有原生质体,再次离心。至上清无原生质体时,弃上清,收集沉淀的原生质体。分别用0.7 mol/L NaCl溶液和STC缓冲液离心洗涤收集到的原生质体1次。
⑤向离心收集的原生质体中加入1 mL STC缓冲液,轻轻混合均匀,用血球计数板计数。用STC缓冲液调至原生质体浓度大约为108个/mL,然后立即42℃预热备用或加甘油于-80℃冰箱中保存。
1.4 电泳样品准备
①将450 μL 42℃预热的原生质体悬浮液与750 μL预冷至42℃的1%低熔点琼脂糖溶液 (用STC缓冲液配制)混合均匀,用移液枪吸取混合物于模子中,避免产生气泡。每个模子80 μL,室温凝固15 min左右[7]。
②一旦凝固,在50 mL离心管上做好标记,每管加入20 mL蛋白酶K缓冲液。打开模具,将胶块移入相应的管子中,50℃水浴,24 h[5]。
③弃去溶液,用 10 mmol/L Tris(pH=8.0)和50 mmol/L EDTA的混合液洗胶块4次,共1 h,轻微震荡。
④洗完后,将胶块放在0.5 mol/L EDTA(pH= 8.0)中,30 min后将胶块保存在4℃,新的0.5 mol/L EDTA(pH=8.0)中。
1.5 进行脉冲电泳
①调整梳子的高度,使梳子齿与胶槽的底面有一定间距,调整胶槽使其水平。
②将EDTA从管中吸出,加入200 μL电泳缓冲液,室温缓冲10~15 min。
③称取高强度琼脂糖于100 mL电泳缓冲液中,加热溶解后冷却至60℃。
④把胶块加在梳子齿上,干燥约3 min后,从胶槽的下部中央缓慢倒入配制好的琼脂糖溶液,室温凝固30 min。
⑤小心拔去梳子,加缓冲液于电泳槽中,用熔化的胶封闭加样孔,设置参数开始电泳(表1)。
⑥据每次分离染色体片段大小选定Marker。
1.6 染色拍照
①电泳结束后,用0.5 μg/mL的溴化乙锭电泳缓冲液或水进行凝胶的染色,30~45 min。
②室温下用水将已经染色的凝胶浸泡30 min脱色,可以降低由未结合的溴化乙锭所引起的背景荧光。
③数码凝胶成像系统观察染色体大小、数目,并拍照。
2 操作中应注意的事项
①制备电泳样品时,包埋的原生质体或孢子的浓度不能太低。若其浓度太低,则电泳的条带较暗。
②蛋白酶K的浓度过高、消化时间过长或孵育温度过高,都会对细胞的结构有一定的破坏,导致组织切片的脱落,细胞核的消失,从而影响试验结果。
③低熔点琼脂糖的浓度不能太低。若其浓度较低,则会形成较大的孔道,电泳后可能看不到任何条带;若其浓度太高,则琼脂糖很容易凝固,不利于操作。
④要确保电泳槽是水平的。电泳结束后,及时取出凝胶,防止因时间过长,造成条带弥散。
3 小结与讨论
不同的电泳参数跑出来的凝胶条带个数是不同的,若条带中有异常的明亮条带出现,证明此处很可能是分子量相同或相近的两条染色体重合在一起。需要再重新设置电泳参数,以分离重叠的染色体条带。明亮的带可能会随着电泳条件的改善而出现更清晰的结果[9]。电泳过程是一个极其复杂的过程,很多因素制约着试验结果的好坏。影响脉冲电泳分离效果的因素主要包括:电流强度、电泳温度、琼脂糖浓度、脉冲时间以及电场角度等[10~11]。在筛选电泳的影响因素时首先确定一个电泳条件,然后根据试验结果,依次更改各个因素,以达到最佳效果[12]。
制备原生质体法是完整染色体DNA获得中最经典的方法,适用范围较广[12]。但重要的是试验中要获得较高浓度的原生质体,因此要对原生质体的制备条件进行摸索。另外还可以采用液氮研磨法,此方法无须用溶壁酶破壁,这就使得制备完整染色体DNA的过程大大简化,因此有很好的发展前景。但不足的地方在于研磨菌丝体过程中极可能导致染色体DNA断裂。该方法要求试验操作者有较好的试验操作经验。
本技术用于分离茭白黑粉菌的染色体,可以探索茭白黑粉菌的染色体大小和数目。为其之后的细胞学和遗传学的深入研究提供条件,将极大地推动茭白黑粉菌分子生物学方面的研究。但该试验方法是对茭白黑粉菌核型分析方面的首次探索,仍需在今后的研究中不断改进。
[1]余永年.茭白黑粉菌刺激生长物质的研究[J].植物学报,1962,12(3):317-327.
[2]吴甘霖.核型分析在细胞分类学中的应用[J].生物学杂志,2006,23(1):39-42.
[3]付晓燕,胡克兴,范黎.脉冲场凝胶电泳技术及其在真菌学研究中的应用[J].微生物学通报,2006,33(1):144-148.
[4]Schwartz D C,Cantor C R.Separation of yeast chromosome-sized DNAs by pulsed field gradient gel electrophoresis[J].Cell,1984,37:67-75.
[5]Ellwood S R,Liu Z H,Syme R A,et al.A first genome assembly of the barley fungal pathogen Pyrenophora teres f. teres[J].Genome Biology,2010,11:R109.
[6]管培刚.棉花黄萎病菌GFP标记转化子的特征及其病害的生物防治[D].杭州:浙江大学,2011.
[7]Guzmán P A and Sánchez J G.Characterization of telomeric regions from Ustilago maydis[J].Microbiology,1994,140: 551-557.
[8]Meksem K,Shultz J,Tebbji F,et al.A bacterial artificial chromosome based physical map of the Ustilago maydis genome[J].Genome,2005,48:207-216.
[9]荣跃文,徐莉,汪小艳,等.高雄山虫草无性型细脚拟青霉的核型分析[J].菌物学报,2010,29(1):31-36.
[10]Vollrath D,Davis R W.Resolution of DNA molecules greater than 5 megabases by contour-clamped homogeneous electric fields[J].Nucleic Acids Research,1987,15 (19):7 865-7 876.
[11]Chu G,Vollrath D,Davis R W.Separation of large DNA moleculesby contour-clamped homogeneouselectric fields[J].Science,1986,234(4783):1582-1585.
[12]汪小艳.几株蛹草拟青霉原生质体制备及染色体核型研究[D].合肥:安徽农业大学,2010.
Protocol for pulsed field gel electrophoresis ofUstilago esculenta
WANG Xiaoqing,ZHANG Jingze,CHU Fuqiang,ZHANG Yanli,GUO Deping
(College of Agriculture and Biotechnology,Zhejiang University,Hangzhou 310058)
Karyotype ofUstilago esculentawas analyzed by pulsed field gel electrophoresis.The experiment results were affected by the sample treatment methods of pulsed field gel electrophoresis ofU.esculenta,including protoplast preparation and entrapment.While preparing the test samples,the concentration of embedded protoplast or spore and low melting point agarose can't be too low,and the concentration of proteinase K can't be too high.In addition,the electrophoresis tank should be placed horizontally,and the gel should be taken out timely after the electrophoresis.
Ustilago esculenta;Protoplast;Entrapment;Pulsed field gel electrophoresis;Karyotype
10.3865/j.issn.1001-3547.2011.16.029
公益性行业(农业)科研专项经费项目“水生蔬菜产业技术体系研究与示范”(200903017-03)
王晓清(1988-),女,硕士,主要从事蔬菜学研究,电话:0571-88982796,E-mail:xccghh_620@163.com
郭得平,通信作者,E-mail:dpguo@zju.edu.cn
2011-07-11

