干扰素-α治疗慢性乙型肝炎的疗效观察*
胡旭东 程海林 田德安 曹荣 夏冰 柏涛 甘洪颖 黄少平
干扰素-α(IFN-α)具有广泛的抗病毒、抗肿瘤和免疫调节作用[1]。近年来,体外和临床研究表明IFN-α具有抗肝纤维化作用[2~6]。转化生长因子β1(TGF-β1)、肿瘤坏死因子 α(TNF-α)、金属蛋白酶组织抑制因子 1(TIMP-1)、基质金属蛋白酶 1(MMP-1)和 I型胶原等与肝纤维化的发生及进展关系密切。我们观察了IFN-α治疗慢性乙型肝炎患者对它们的影响。
资料与方法
一、研究对象 本院2009年3月至2010年6月住院的慢性乙型肝炎患者50例,男性38例,女性12例,年龄23岁~42岁,平均年龄31.6岁。诊断依据2005年《慢性乙型肝炎防治指南》的标准。患者血清HBsAg、HBeAg 阳 性 ,HBV DNA ≥1 ×105IU/ml;HBV DNA基因分型为B型;ALT大于正常值上限2倍,但小于正常值上限10倍;肝组织学检查符合慢性乙型肝炎的表现。所有患者甲、丙、戊型肝炎病毒标记物均为阴性,均无饮酒史。甲状腺功能及血常规正常。胃镜检查无食管胃底静脉曲张。所有患者在第1次肝穿刺前6个月内未应用过免疫调节剂或抗病毒药物,排除精神病、孕妇、哺乳期妇女及有严重心、肾疾病患者。
二、治疗方法 给予IFN-α(安达芬,安徽安科生物工程股份有限公司)6MU皮下注射,隔日1次,治疗6个月。
三、肝活检 取肝穿组织,采用免疫组化法检测TGF-β1、TNF-α、TIMP1、Fas、MMP-1 和 I型胶原蛋白(一抗及羊抗兔二抗均购自武汉博士德生物工程有限公司)。应用HMIAS-2000高清晰彩色医学图文分析系统(武汉千屏影像技术有限责任公司)进行分析,计算每例样本平均阳性面积作为比较参数。
四,常规检测 采用ELISA法(上海凌云生物制品有限公司)检测HBV标记物;采用聚合酶链反应法检测HBV DNA(上海生工生物工程技术服务有限公司);采用ELISA法检测透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)及Ⅳ型胶原(Ⅳ-c,上海凌云生物制品有限公司)。
五,统计学处理 应用SPSS17.0统计软件包,计量资料以表示,采用配对t检验,等级计数资料采用秩和检验,P<0.05为差异有统计学意义。
结果
一、血清学和病毒学应答情况 在治疗结束时,27例(54%)患者发生HbeAg/HbeAb血清转换,37例(74%)患者HBV DNA转阴。
二、治疗前后血清肝纤维化指标的变化 见表1。
表1 治疗前后血清肝纤维化指标的变化(,ng/m l)
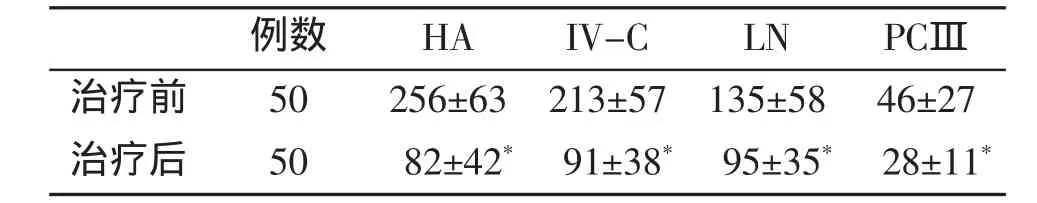
表1 治疗前后血清肝纤维化指标的变化(,ng/m l)
①P<0.01
例数 HA IV-C LN PCⅢ治疗前 50 256±63 213±57 135±58 46±27治疗后 50 82±42* 91±38* 95±35* 28±11*
三、肝组织学变化情况 见表2。
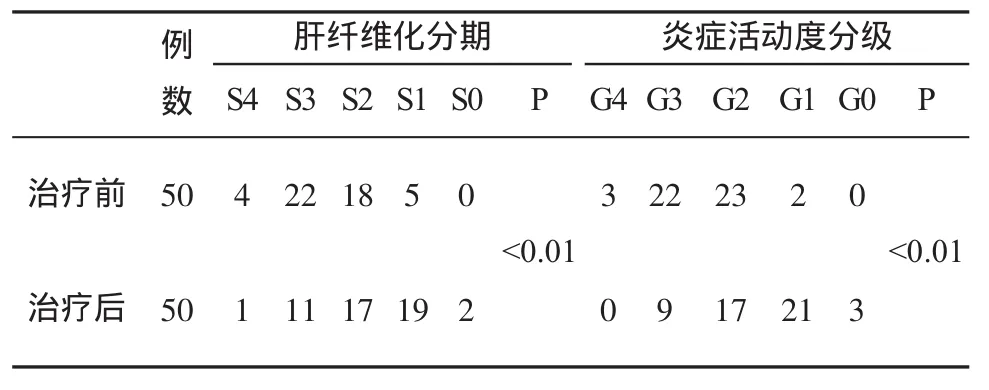
表2 治疗前后肝纤维化分期和炎症活动度分级情况
四、肝组织 TGF-β1、TNF-α、TIMP1、Fas、MMP1和I型胶原表达的变化 在治疗6个月结束时,肝组织 TGF-β1、TNF-α、TIMP1、Fas和 I型胶原的表达明显下降,MMP1表达增强(图 1~6)。
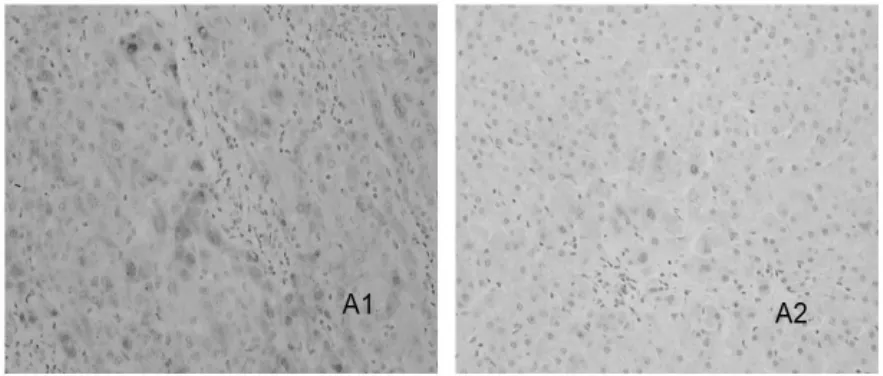
图1 肝组织TGF-β1的表达(SP,100×)

图2 肝组织TNF-α 的表达(SP,100×)
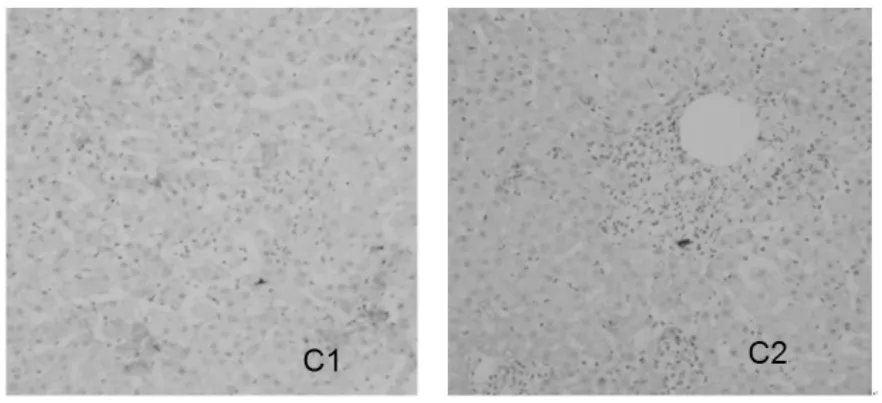
图3 肝组织Fas的表达(SP,100×)

图4 肝组织I型胶原的表达(SP,100×)
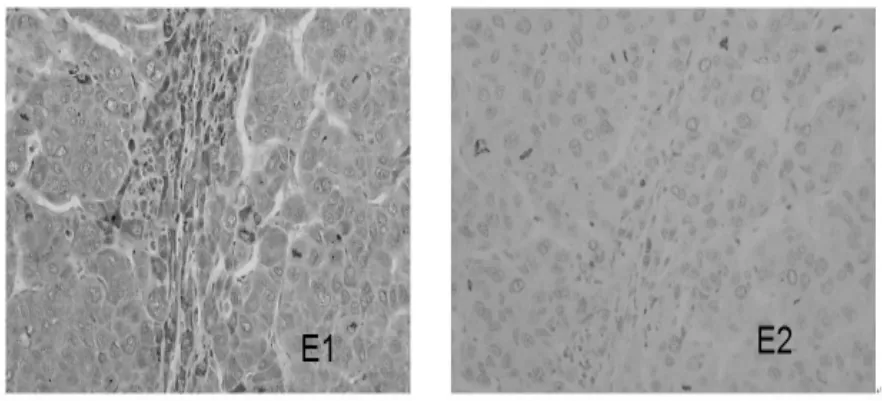
图5 肝组织TIMP1的表达(SP,100×)
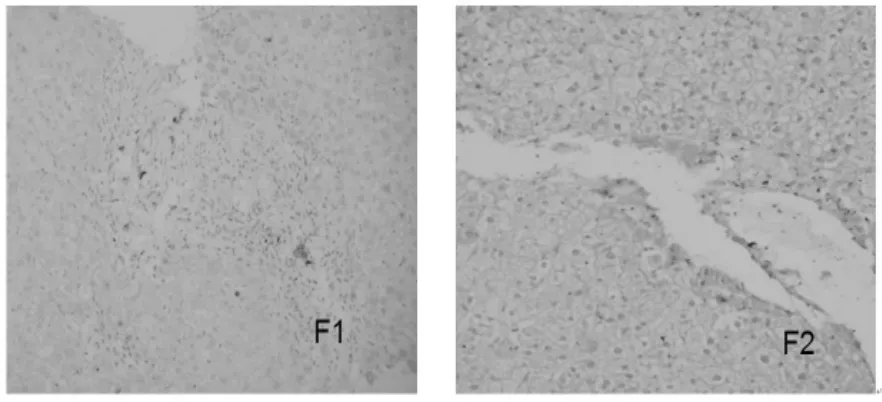
图6 肝组织MMP1的表达(SP,100×);
讨论
IFN-α作为最主要的抗病毒药物之一,不仅具有抗病毒、抗肿瘤及调节免疫等作用外,还具有抗肝纤维化作用[7]。肝细胞的损伤是肝纤维化发生的始动因素,乙型肝炎病毒感染可使机体免疫系统活化,产生并释放各种细胞因子,诱导肝内细胞合成大量TNF-α。TNF-α刺激HSC合成ECM,导致肝纤维化[8],而在肝纤维化的进展期,主要通过Fas系统介导肝细胞凋亡作用引起肝细胞持续损伤,促进肝纤维化进一步进展[9]。
本研究结果显示INF-α抗病毒治疗六个月后,74%患者病毒转阴,54%患者发生血清学转换,TNF-α表达水平明显下降,肝组织炎性程度也明显下降。治疗前Fas表达丰富,以肝细胞为主,INF-α抗病毒治疗6个月后Fas表达明显下降,以间质为主,提示干扰素可能通过控制病毒载量以减少病毒对肝细胞的免疫损害,减轻肝脏炎症反应及坏死,并抑制间质细胞(主要是HSC)的活化与增殖,并可能促使间质细胞的凋亡,从而起到抗肝纤维化的作用。
HSC的激活、增殖以及细胞外基质的沉积是肝纤维化的重要环节,而TGF-β1在肝纤维化的启动、进展乃至肝硬化的形成中发挥了核心作用。HSC活化、增殖,向肌成纤维细胞转化,通过旁分泌与自分泌作用合成分泌多种ECM成分,同时合成、释放大量TIMPs。TIMPs在组织中的主要作用是通过与MMPs按1∶1比例的结合而抑制MMPs的活性,从而阻止ECM的降解,形成或促进肝纤维化[10]。目前已发现的TIMPs有4种,在判定肝纤维化及肝组织学改变方面,TIMP-1的意义较大。MMP1和TIMP1在ECM的降解中起重要作用[11,12]。目前发现在病损肝脏中TIMP-1明显增高,出现的时间较早、表达较强。因此,越来越多的研究人员把它看作是肝纤维化的诊断指标[13]。本研究发现经抗病毒治疗6个月后,TGF-β1、I型胶原和TIMP1表达明显减少,而MMP1表达则升高,提示干扰素α可能通过阻断TGF-β1活化HSC途径,减少HSC合成细胞外基质、I型胶原及TIMPs,使MMPs的活性增强,加强ECM的降解,从而改善肝纤维化。
[1]SHEN H,ZHANG M,MINUK GY,et a1.Different effects of rat interferon alpha,beta and gamma on rat hepatic stellate cell proliferation and activation[J].BMC Cell Biol,2002,3:9-13.
[2]INAGAKI Y,NEMOTO T,KUSHIDA M,et al.Interferon alfa down-regulates collagen gene transcription and suppresses experimental hepatic fibrosis in mice[J].Hepatology,2003,38:890-899.
[3]FRIEDMAN SL.Mechanisms of disease:Mechanisms of hepatic fibrosis and therapeutic implications[J].Nat Clin Pract Gastroenterol Hepatol,2004,1:98-105.
[4]LU G,SHIMIZU I,CUI X,et al.Interferon-alpha enhances biological defense activities against oxidative stress in cultured rat hepatocytes and hepatic stellate cells[J].J Med Invest,2002,49:172-181.
[5]SAILE B,EISENBACH C,EL-ARMOUCHE H,et al.Antiapoptotic effect of interferonalpha on hepatic stellate cells(HSC):a novel pathway of IFN-alpha signal transduction via Janus kinase 2(JAK2)and caspase-8[J].Eur J Cell Biol,2003,82:31-41.
[6]ABE S,TABARU A,ONO M,et al.High-dose interferon-alpha therapy lowers the levels of serum fibrogenesis markers over 5 years in chronic hepatitis C[J].Hepatol Res,2003,25:22-31.
[7]BATALL ER,BRENNER DA.Liver fibrosis[J].J Clin Invest,2005,115(2):209-218.
[8]GONZALER AR,CARCIA MC,GARAIA BL,et al.Induction of tumor necrosis factor production by human hepatocytes in chronic viral hepatitis[J].J Exp Med,1994,179(6):841-842.
[9]BIECHE I,ASSELAH T,LAURENDEAU I,et al.Molecular profiling of early stage liver fibrosis in patients with chronic hepatitis C virus infection[J].Virology,2005,332:130-144.
[10]YANG JX,WANG XM,TANC ZY,et a1.The characterization of Ca2+-calmodulin independent phosphorylation of myosin light chains by a fragment from myosin light chain kinase[J].Acta Biochim Biophys Sin,2003,35(9):793-800.
[11]KOBAYASHI H,LI ZX,YAMATAKA A,et al.Clinical evaluation of serum levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases as predictors of progressive fibrosis in postoperative biliary atresia patients[J].J Pediatr Surg,2002,37:1030-1033.
[12]CAO Q,MAK KM,LIEBER CS,et al.Dilinoleoylphosphatidyl choline prevents transforming growth factor-betal-mediated collagen accumulation in cultured rat hepatic stellate cells[J].J Lab Clin Med,2002,139:202-210.
[13]YOJI M.The role of tissue inhibitor metalloproteinase(TIMP)on liver fibrogenesis in a transgenic mouse model[J].J Nara Med Assoc,2000,51(5):354-368.

