氟比洛芬脂质体的制备及其载药性能研究
陈柳华,甘礼华,赵云辉,刘明贤
(同济大学 化学系,上海 200092)
脂质体是1965年英国学者Bangham等将磷脂分散在水中进行电镜观察时发现并命名的[1],它作为模拟体系在推动生物膜的研究进展中起着非常重要的作用.20世纪70年代以后,研究人员开始将它作为药物分子的载体,尝试用于临床诊断、治疗等方面的研究[2].构成脂质体双分子层的物质主要是磷脂和胆固醇(cholesterol),其分子结构中既具有亲水基团又具有疏水基团,因此,脂质体的亲水基团夹层中可以包封水溶性药物,而脂质体的疏水基团夹层中则可以包封脂溶性药物[3].脂质体作为药物载体既可以起到对药物的缓释作用,又可以提高药物对机体特定部位的靶向性,在提高药效方面具有明显的优越性.脂质体的制备方法主要有薄膜蒸发-超声分散法、逆相蒸发法、注入法、冷冻干燥法、硫酸铵梯度法等,其中,薄膜蒸发-超声分散法是脂质体制备方法中最传统且应用最广泛的方法.
氟比洛芬(flurbiprofen)是非甾体消炎镇痛药中优秀品种之一,被广泛用于治疗类风湿关节炎、骨关节炎、强直性脊柱炎、外伤疼痛和其它疼痛.该药物口服有效,耐受性好,长期使用既不促进也不抑制自身代谢[4].然而,氟比洛芬生物利用度差,且具有较严重的胃肠道及中枢神经系统等不良反应[5].为了降低氟比洛芬的毒副作用,丁雪鹰等[6]制备了氟比洛芬巴布剂,巴布剂是一种经皮给药制剂,它的应用可以避免胃肠道不良反应,提高患部药物浓度,增强抗炎作用.脂质体作为药物载体,既适合经皮给药,又适合经口给药,其双分子层与生物膜有较大的相似性以及组织相溶性,易于被人体组织吸收,从而提高了药物的生物利用度[7].同时,脂质体对机体无毒或毒副作用小,因此,氟比洛芬脂质体的制备及其载药性能研究具有重要意义.本文采用薄膜蒸发-超声分散法制备氟比洛芬脂质体,通过鱼精蛋白凝聚法测定脂质体对氟比洛芬的包封率和载药率,研究卵磷脂(lecithin)浓度、氟比洛芬/卵磷脂的质量比、胆固醇浓度对脂质体载药性能的影响.
1 实验部分
1.1 材料及仪器
材料为蛋黄卵磷脂、胆固醇、氯仿(分析纯,中国医药集团化学试剂公司),氟比洛芬(质量分数≥98%,Tokyo Kaset Kogyo Co.Ltd)、氢氧化钾(分析纯,上海同试化工有限公司)、磷酸二氢钾(分析纯,上海恒信化学试剂有限公司)、氯化钠(分析纯,江苏强盛化工有限公司)、鱼精蛋白(分析纯,国药集团化学试剂有限公司).仪器为紫外-可见吸收光谱仪(Agilent 8453)、旋转蒸发仪(上海亚荣生化仪器有限公司)、透射电镜(JEOL JEM-1230).
1.2 氟比洛芬脂质体的制备
将一定量的卵磷脂、氟比洛芬和胆固醇溶于30 mL的甲醇-氯仿溶液中(氯仿与甲醇的体积比为2∶1),用旋转蒸发的方法在40℃温度下除去氯仿与甲醇,直至烧瓶内壁形成一层脂质膜,通氮气10 min以除去残留溶剂.将50 mL磷酸缓冲液(pH =7.8)加入脂质膜中,在氮气保护下旋涡2 h,超声15 min,经0.45 μ m滤膜过滤制得氟比洛芬脂质体.
1.3 透射电镜分析
通过负染透射电镜技术观察脂质体的形貌.将脂质体滴在具有Formvar(polyvinyl formal)膜的铜网上,吸附25 min后,滴加染色液磷钨酸,烘干后用透射电镜观测脂质体的形貌.
1.4 紫外-可见吸收光谱分析
1.4.1 氟比洛芬在水/脂质体体系中的分配系数
测定不同浓度的氟比洛芬脂质体的紫外-可见吸收光谱,扫描的波长范围为200~500 nm,通过其在247 nm处的紫外特征吸收峰强度,计算氟比洛芬在水/脂质体体系中的分配系数.
1.4.2 氟比洛芬脂质体的载药性能
将0.1 mL氟比洛芬脂质体置于10 mL的离心管中,加入0.2 mL质量浓度为10 mg◦mL-1鱼精蛋白溶液,混合均匀后,静置3 min.然后往离心管中加入10 mL磷酸缓冲液,3 000 r◦min-1离心30 min.取上层清液,用紫外-可见吸收光谱仪测定游离的氟比洛芬的吸光度,根据溶液的吸光度与氟比洛芬浓度的线性关系,计算未被包封的氟比洛芬浓度.将0.1 mL氟比洛芬脂质体溶解在10 mL的乙醇中,通过紫外-可见吸收光谱仪测定脂质体体系中氟比洛芬的吸光度,并由此计算氟比洛芬脂质体体系中氟比洛芬的含量.脂质体对氟比洛芬的包封率(EE)和载药率(DL)分别通过如下公式计算得到[8]:

式(1),(2)中:Wtotal是氟比洛芬的总质量;Wfree是未被包封的氟比洛芬的质量;Wlipid是卵磷脂的质量.
2 结果与讨论
2.1 氟比洛芬在水/脂质体体系中的分配系数
分配系数KD是指组分在磷脂相中浓度与组分在水相中浓度的比例[9],它是反映药物在生物膜中分配的一个重要参数.图1是脂质体中卵磷脂浓度不同时氟比洛芬的紫外-可见吸收光谱,氟比洛芬浓度(cf)为5.0×10-5mol◦L-1.由图1可知,247 nm处吸收峰是氟比洛芬在紫外-可见吸收光谱中的特征吸收峰.随着卵磷脂浓度的增加,氟比洛芬在247 nm处的紫外特征吸收峰强度增强.根据氟比洛芬在脂质体中的紫外-可见吸收光谱的测定结果,用公式(3)计算氟比洛芬在卵磷脂相与水相中的分配系数KD[10].

式中:εφ为氟比洛芬在指定波长下的摩尔吸光系数; εm和εw分别为氟比洛芬在卵磷脂脂质体磷脂相和水相中的摩尔吸光系数;cl为卵磷脂的浓度;KD为分配系数.摩尔吸光系数 εφ和εw由所得的氟比洛芬脂质体体系中氟比洛芬在247 nm处的紫外-可见吸收峰强度计算而得到.以1/(εφ-εw)对1/cl作图,如图1所示,按照公式(3)计算得到氟比洛芬在卵磷脂相和水相中的分配系数KD为815.6,由此可知,氟比洛芬是具有较大的分配系数的药物,该药物容易渗透通过生物膜而被脂质体包埋,因此,氟比洛芬脂质体具有较良好的载药性能.

图1 卵磷脂浓度不同时氟比洛芬溶液的紫外-可见吸收光谱Fig.1 UV-vis spectroscopy of flurbiprofen solution at different concentrations of lecithin
2.2 氟比洛芬脂质体的形成过程
氟比洛芬脂质体的形成过程主要是基于卵磷脂分子之间的缔合作用以及卵磷脂分子与氟比洛芬分子之间的疏水作用[11].将卵磷脂、氟比洛芬和胆固醇的甲醇-氯仿溶液旋转蒸发,除去烧瓶内有机溶剂(氯仿和甲醇)后,卵磷脂分子和氟比洛芬分子均匀分散在烧瓶内壁并形成一层脂质膜.当脂质膜分散在40℃磷酸缓冲液中旋涡浸泡时,脂质膜从烧瓶内壁脱落,脱落的卵磷脂分子通过疏水缔合作用在磷酸缓冲液中相互靠拢,定向排列形成一个类球状的、包封一部分水相的封闭囊泡即脂质体,卵磷脂分子的亲水性基团形成脂质体双层类脂膜的内外表面,卵磷脂分子的疏水性基团形成脂质体双层类脂膜内侧.
紫外-可见吸收光谱研究表明,氟比洛芬在水/脂质体体系中的分配系数KD为815.6,它是一种脂溶性较强的药物,通过与卵磷脂分子的疏水作用定位于脂质体疏水基团的夹层中形成氟比洛芬脂质体,所得氟比洛芬脂质体的透射电镜照片如图2所示.由图2可见,得到的脂质体为球状或近球状的封闭囊泡,这种囊泡具有双分子层结构,其粒径在100~250 nm之间,大小比较均匀,分散性良好,空白脂质体的平均粒径大约为120 nm,随着氟比洛芬的浓度增大,脂质体的平均粒径不断增大,当氟比洛芬浓度为2×10-5mol◦L-1,脂质体的平均粒径增加至150 nm左右.
2.3 氟比洛芬脂质体载药性能的影响因素

图2 氟比洛芬脂质体的透射电镜照片Fig.2 TEM photographs of flurbiprofen liposomes
不同浓度的氟比洛芬溶液的紫外-可见吸收光谱如图3所示,以247 nm处的吸光度对浓度作图,得一直线,图中氟比洛芬溶液的吸光度与其浓度呈良好的线性关系,根据此线性关系可以计算氟比洛芬脂质体的载药率和包封率,以此考察卵磷脂浓度、氟比洛芬对卵磷脂的质量比以及胆固醇浓度对氟比洛芬脂质体载药性能的影响.
2.3.1 卵磷脂浓度
脂质体的包封率是指包封于脂质体中的药物量占脂质体系中药物总量的比例,它是评价脂质体制剂质量好坏的重要指标,也是其能否发挥较普通制剂高效、低毒特点的关键[12].包封率越高,游离药物越少,即药物缓释效果越好,药物的毒副作用越低.而脂质体的载药率则是指脂质体所能载的药物量,它是评价载体材料载药性能的一项重要指标,载药率愈高载药性能愈好.图4是卵磷脂浓度对氟比洛芬脂质体包封率和载药率的影响.由图4可知,当卵磷脂浓度为2.7×10-4mol◦L-1时,氟比洛芬脂质体的包封率为39%,载药率为49.9%;当卵磷脂浓度为4.0×10-4mol◦L-1时,氟比洛芬脂质体的包封率为46%,载药率为38.4%;当卵磷脂浓度为5.4×10-4mol◦L-1时,氟比洛芬脂质体的包封率为54%,载药率为34.6%.由此可知,随着卵磷脂浓度的增加,脂质体的包封率增加,载药率降低.不过,当卵磷脂浓度大于5.4×10-4mol◦L-1时,所得脂质体的稳定性较差,脂质体的包封率随卵磷脂浓度增加变化不大,而脂质体的载药率却不断降低.

图3 氟比洛芬的紫外-可见吸收光谱Fig.3 UV-vis absorption spectra of flurbiprofen solution
2.3.2 氟比洛芬对卵磷脂的质量比
脂质体通过将脂溶性药物镶嵌在磷脂双分子层中实现对药物的包载,药物与磷脂的相容性以及药物与磷脂的比例会显著影响脂质体的载药性能[13].图5是卵磷脂质量(ml)不变的情况下,改变氟比洛芬质量(mf)对脂质体包封率和载药率的影响.由图5可知,当氟比洛芬用量增加时,脂质体的载药率增大,这是由于氟比洛芬能够通过疏水作用定位于脂质体疏水基团的夹层中,而当氟比洛芬用量较小时,脂质体携带的氟比洛芬分子较少,尚未达到饱和.随着氟比洛芬用量的继续增加,定位于脂质体中的氟比洛芬分子逐渐增多,使得脂质体对氟比洛芬的载药率也逐渐增大.然而随着氟比洛芬用量的增加,脂质体对氟比洛芬的包封率降低,这是因为虽然脂质体所能携带氟比洛芬分子的数量增加,但体系中未被脂质体包封的氟比洛芬也在增加,根据公式(1)可知,氟比洛芬浓度增加使得未包封的氟比洛芬分子数目变得过多,从而导致脂质体对氟比洛芬的包封率降低.

图4 卵磷脂浓度对氟比洛芬脂质体包封率和载药率的影响Fig.4 Effect of lecithin concentration on the entrapment efficiency and drug loading of liposomes

图5 氟比洛芬对卵磷脂的质量比对脂质体包封率和载药率的影响Fig.5 Effect of flurbiprofe n/lipid mass ratio on the entrapment efficiency and drug loading of liposomes
2.3.3 胆固醇浓度
脂质体膜的流动性是脂质体的一个重要物理性质,在相变温度时,膜的流动性增加,被包裹的药物极易泄露,因此,膜的流动性直接影响着脂质体的稳定性.胆固醇具有调节膜流动性的作用,在低于相变温度时可以减少膜的有序性而增加膜的流动性,高于相变温度时可以增加膜的有序排列而减少膜的流动性[14].在实验中发现,在脂质体的制备过程中,加入少量的胆固醇可以提高脂质体的稳定性.图6是改变胆固醇质量(mc)对氟比洛芬脂质体载药性能的影响.由图6可知,当胆固醇对卵磷脂的质量比从0增加到0.3时,脂质体对氟比洛芬的包封率和载药率几乎没有变化;当胆固醇对卵磷脂的质量比分别为0.60,0.75, 1.00和1.50时,脂质体对氟比洛芬的包封率从54.0%降低至51.0%,43.6%,43.8%,42.3%,载药率从34.6%降低至32.6%,27.9%,28.0%,26.8%.这是由于脂质体双分子层结构被过量的胆固醇干扰的结果.氟比洛芬是疏水性药物,其本身是嵌入磷脂形成的双分子层之间,因此,膜的面积越大,药物包封率就越高.然而,胆固醇本身并不形成双分子层结构,它能够镶嵌入双层膜中占据一定的空间,胆固醇的含量过高,使膜的刚性增强,曲率变小,所形成的脂质体的总表面积减小,从而引起载药率和包封率的降低.这表明,虽然胆固醇的加入能够增加脂质体的稳定性,但是过量的胆固醇却会造成脂质体对氟比洛芬载药率和包封率的降低.因此,在制备氟比洛芬脂质体时,胆固醇对卵磷脂的质量比应该控制在0.3以内.
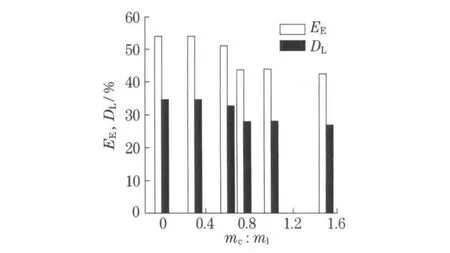
图6 胆固醇浓度对氟比洛芬脂质体包封率和载药率的影响Fig.6 Effect of cholesterol concentration on the entrapment efficiency and drug loading of liposomes
3 结论
通过薄膜蒸发-超声分散法制备氟比洛芬脂质体,研究了氟比洛芬脂质体载药性能的影响因素.氟比洛芬定位于脂质体的疏水基团区域,随着氟比洛芬用量的增加,脂质体对氟比洛芬的载药率增大,包封率降低.胆固醇可调节膜的稳定性,其本身并不形成双分子层结构,它能够镶嵌于双层膜中,少量的胆固醇对脂质体的包封率和载药率影响不大,胆固醇浓度过高导致脂质体对氟比洛芬的载药率和包封率降低.
[1] Bangham A D,Standish M M,Watkins J C.Diffussion of univalent ions across the lamella of swollen phospholipids[J]. Journal of M olecular Biology,1965,13(1):238
[2] Kim J H,Kim M W.In-situ observation of the inside-tooutside molecular transport of a liposome[J].The Journal of Physical Chemistry B,2008,112(49):15673.
[3] Nii T,Takamura A,MohriK,etal.Factorsaffecting phy sicochemical properties of liposomes prepared with hydrogenated purified egg yolk lecithins by the microencapsulation vesicle method[J].Colloids and Surfaces B:Biointerfaces,2002,27(4):323.
[4] Park K,Lee M,Hwang K,et al.Phospholipid-based microemulsions of flurbiprofen by the spontaneous emulsification process[J].International Journal of Pharmaceutics,1999,183(2):145.
[5] Chi S,Park E,Kim H.Effect of penetration enhancers on flurbiprofen permeation through rat skin[J].International Journal of Pharmaceutics,1995,126(1/2):267.
[6] 丁雪鹰,高申,钟延强,等.氟比洛芬巴布剂的质量评价[J].中国医院药学杂志,2001,21(10):592.
DING Xueying,GAO Shen,ZHONG Yanqiang,et al. Evaluation of quality of flurbiprofen transdermal delevery sy stem ofcataplasms[J].Chinese JournalofHospital Pharmacy,2001,21(10):592.
[7] Menger F M,Keiper J S,Lee S J.Adhesion of giant liposomes as observed by light microscopy[J].Langmuir,1997,13 (17):4614.
[8] Sun W T,Zhang N,Li A G,et al.Preparation and evaluation of N3-O-toluyl-fluorouracil-loaded liposomes[J].International Journal of Pharmaceutics,2008,353(1/2):243.
[9] Ikonen M,M urtomäkiL,KontturiK.An electrochemical method forthe determination of liposome-water partition coefficients of drugs[J].Journal of Electroanalytical Chemistry,2007,602(2):189.
[10] Zou A H,Gu Q,He Q G,et al.Interaction of malachite g reen with lecithin liposomes[J].Colloidsand SurfacesA: Physicochemical and EngineeringAspects,2003,224(1/ 3):75.
[11] Ikonen M,M urtomakiL,KontturiK.An electrochemical method forthe determination of liposome-water partition coefficients of drugs[J].Journal of Electroanalytical Chemistry,2007,602(2):189.
[12] Piel G,Piette M,Barillaro V,etal.Betamethasone-incy clodex trin-in-liposome:the effect of cyclodextrins on encapsulation efficiency and release kinetics[J].International Journal of Pharmaceutics,2006,312(1/2):75.
[13] Nii T,Ishii F.Encapsulation efficiency of water-soluble and insoluble drugs in liposomes prepared by the microencapsulation vesicle method[J].International Journal of Pharmaceutics,2005,298(1):198.
[14] Chen C J,Han D D,Cai C F,et al.An overview of liposome lyophilization and its future potential[J].Journal of Controlled Release,2010,142(3):299.

