人类MMP3基因2号外显子Lys45Glu单核苷酸多态性与乳腺癌易感性的关系
李 劲,高雯琪,邓志芳,胡文娟,欧阳刚,刘 莹,王朝元,姚品芳
(1中南民族大学生命科学学院,武汉430074;2湖北省肿瘤医院,武汉430079)
乳腺癌(Breast Carcinoma,BC)是仅次于肺癌的第二大女性恶性肿瘤杀手[1].我国乳腺癌发病率近年来呈现上升趋势[2],已成为威胁女性健康、生活和生命的重要因素.
乳腺癌的发生与发展是环境与遗传因素共同作用的结果.环境因素如绝经后雌激素的使用、酒精的消耗和较少的体育活动等起着一定的作用[3].然而癌症的发生有个体差异,当整体人群暴露于相同的环境因素中时,只有少数人群患病,这就提示个体之间存在肿瘤易感性的差异.在基因水平上,最显著影响不同个体对外界刺激产生差异反应的即为单核苷酸多态性.Ou Y G 等[4,5]利用病例-对照分析,研究发现MMP-3基因外显子2中Lys45Glu的SNP多态性(rs679620)与食管鳞状上皮细胞癌相关,但rs679620与乳腺癌相关性尚未见报道.本研究利用PCR-RFLP方法对湖北省武汉市散发患者和湖北省武汉市正常人群进行MMP3基因分型分析,旨在发现MMP3基因Lys45Glu的单核苷酸多态性rs679620与乳腺癌遗传易感性的关系.
1 材料与方法
1.1 材料
1.1.1 研究对象
湖北省武汉市女性乳腺癌散发患者EDTA抗凝血标本由湖北省肿瘤医院收集;湖北省武汉市正常对照女性EDTA抗凝血标本由湖北省武汉市中医院和湖北省陆军总医院收集.所有标本于-70°C保存.本实验中研究对象按病理诊断分为2组(病例组和对照组),各实验组的个体年龄均大于40岁.病例组和对照组在年龄、性别的分布上均无统计学意义差异(P>0.05).
1.1.2 实验设备
德国BioMetra PCR仪;冷冻离心机(Sigma);超级恒温水浴槽SYC-15C(金坛市科兴仪器厂);-80℃冰箱(SANYO);组织匀浆器;ASWO-0005-U超纯水系统(Aquapro);Power Pac HC型电泳仪(Bio-RAD);Mini PROTEAN3 cell型电泳槽(Bio-RAD);TY-80B脱色摇床(金坛市科兴仪器厂);EPSON PERFECT10N 4990 PHOTO扫描仪.
1.1.3 实验试剂
Chelex-100为Sigma分装,引物、dNTP购于上海赛百盛基因技术有限公司,Taq聚合酶购于天根生化科技(北京)公司,Taq I内切酶购于 Promega公司.
1.2 方法
1.2.1 引物设计和限制酶筛选
根据 GenBank数据库(http://www.ncbi.nlm.nih.gov/),查取 MMP3基因序列信息,利用软件Primer Premier(version5.0)设计引物和筛选限制性内切酶,分别见表1和表2.
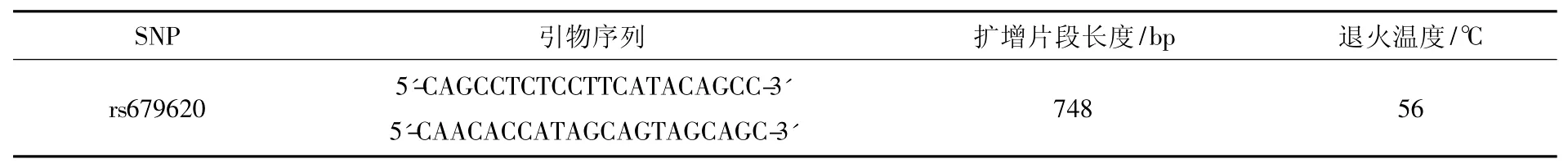
表1 引物的设计Tab.1 Primer sequences in the experiments

表2 限制酶的选择Tab.2 Selected restrict enzyme
1.2.2 外周血基因组DNA的Chelex-100提取
取20μL人体外周血于1.5 mL离心管中,加1 mL灭菌蒸馏水,混匀,冰上放置15 min.13000 r/min离心3 min,去上清,收集白细胞沉淀.移取200 μL 5%Chelex-100溶液加至含白细胞沉淀的离心管中,充分振荡,56℃水浴30 min,取出振荡,冰上放置3 min,13000 r/min离心3 min,上清作为模板用于 PCR 扩增[6].
1.2.3 PCR 扩增
按照特定说明书配置PCR体系,本实验PCR体系见表3.
经梯度PCR实验后确定最优PCR反应程序:①94℃,5 min;②94℃,1 min;③56℃,30 s;④72℃,1 min;⑤回到步骤②35个循环;⑥72℃,15 min;⑦4℃,2 h.PCR反应结束后,1% 琼脂糖凝胶电泳检测,EB染色,凝胶成像仪拍照.

表3 PCR体系Tab.3 System of PCR
1.2.3 限制性内切酶酶切
按照特定限制酶的产品说明书体系和要求进行酶切.
1.2.4 聚丙酰胺凝胶电泳法对基因分型的检测
本实验所用凝胶浓度为8%,以1×TBE为电解液,电压15 V/cm.电泳完成后,将凝胶置于固定液(10% 乙醇,0.5% 冰乙酸)中10~20 min.倒出固定液,加入染色液(0.2%AgNO3)覆盖凝胶,置于摇床上缓慢摇晃15~20 min.倒出染色液,用超纯水漂洗凝胶3~4次,加入显色液(1.5%NaOH,0.4% 甲醛)覆盖凝胶,轻轻晃动10~20 min后加入终止液(0.75%Na2CO3)终止显色.银染结束后,直接拍照或扫描保存图片,肉眼观察并记录基因分型情况.
1.2.5 统计分析方法
实验中涉及的人群信息,包括年龄、是否患乳腺癌、SNP位点等位基因分型数据,首先输入EXCEL里进行初步处理;然后运用SPSS 13.0软件包,进行Χ2检验、logistic regression分析等;用 SHEsis软件(http://analysis.bio-x.cn/myAnalysis.php) 计 算HWE值.
2 结果与分析
2.1 基因组提取结果
用Chelex-100提取人外周血基因组因基因组DNA产量太少,不能用琼脂糖凝胶电泳检测,因此直接进行PCR反应.
2.2 PCR产物琼脂糖凝胶电泳结果
将人外周血基因组DNA PCR产物经琼脂糖凝胶电泳后的结果见图1.
由图1可知,PCR产物均为748 bp,DNA带型整齐亮度适宜,除100 bp以下引物二聚体DNA带外,无明显的非特异性杂带,表示PCR结果较好.
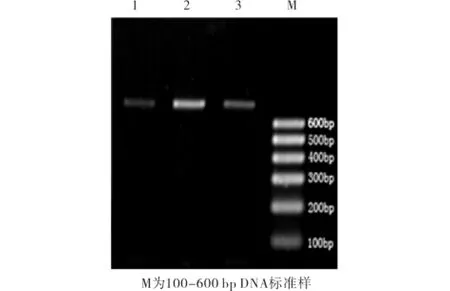
图1 PCR产物琼脂糖凝胶电泳Fig.1 Electrophoresis of PCR production
2.3 聚丙烯酰胺凝胶电泳基因分型结果
PCR产物酶切后经聚丙烯酰胺凝胶电泳基因分型结果见图2.
由图2可知,rs679620经Taq I完全酶切后产生3种结果,A泳道为纯合型完全酶切,上下2个片段大小分别为432、316 bp,即G/G基因型;B泳道为杂合型半数酶切,从上到下3个片段大小分别为748、432、316 bp,即A/G基因型;C泳道为纯合型完全不酶切,此单一片段大小为748 bp,即A/A基因型.
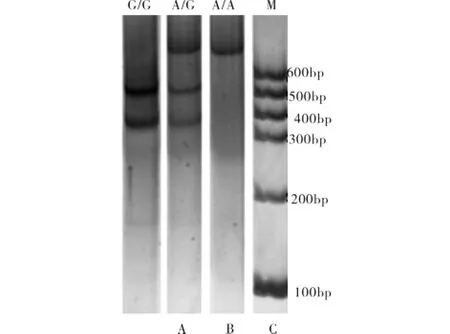
图2 rs679620基因分型Fig.2 Genotype of rs679620
2.4 HWE 值计算
采用 SHEsis软件(http://analysis.bio-x.cn/myAnalysis.php)计算病例组和对照组的HWE值.
病例组及对照组人群的Hardy-Weinberg数值分别为0.388 和0.214,均大于0.05,表明本实验选择的研究人群(包括病例组和对照组)符合孟德尔遗传,且群体中个体等位基因频率和基因型频率的分布比例维持恒定,是符合遗传平衡的群体和良好的研究对象.
2.5 rs679620等位基因频率、基因型频率计算
运用SPSS软件(version15.0)计算rs679620各等位基因频率以及3种基因型的频率,结果见表4和表5.
对rs679620进行病例-对照分析,病例组A等位基因频率(P=0.331)小于对照组(P=0.360),但两者差异不具有统计学意义(P>0.05).病例组和对照组在AA、AG和GG基因型频率分布上差异不明显(P>0.05).表明rs679620单核苷酸多态性位点与乳腺癌易感性不相关.但由表6中数据趋势分析,病例组A等位基因频率(0.331)略小于对照组(0.360),可以推断,rs679620 A等位基因在肿瘤的发生和侵染过程中可能是保护因素.

表4 MMP-3基因单位点SNPs的基因型频率差异Fig.4 Difference of genotype frequency on independent SNP site of MMP-3 between case and control
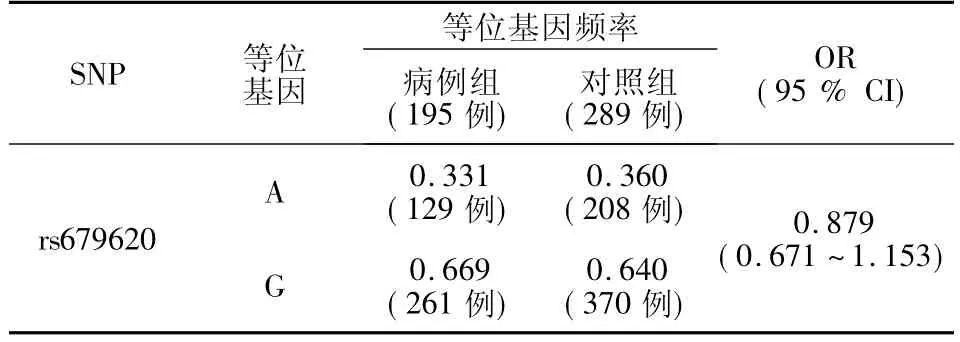
表5 MMP-3基因单位点SNPs的等位基因频率差异Fig.5 Difference of allele frequency on independent SNP sites of MMP-3 between case and control
3 讨论
由 NCBI数据库(http://www.ncbi.nlm.nih.gov/)查询可知,单核苷酸多态性(SNP)位点rs679620(A/G,Lys45Glu,exon_2)为MMP-3蛋白2号外显子第45位氨基酸的错意突变.Eguchi T等[7]发现MMP-3有转录因子和核定位功能,其所具有的核定位信号NLS0序列涵盖MMP3的44-56位氨基酸(LKKDVKQFVRRKD),而rs679620(A/G)位点多态性,正好是第45位氨基酸Lys(K)和Glu(E)之间的变换.rs679620(A/G)的A等位基因对应的氨基酸Lys为酸性带负电荷,G等位基因对应的氨基酸Glu为碱性带正电荷.这种存在于编码区中的带电荷氨基酸和电荷性质的明显改变有可能会导致MMP3蛋白结构的改变和功能的异常[8],因此rs679620有可能影响MMP-3向细胞核内的定位.MMP-3 rs679620位点A等位基因可促进MMP-3向核内转运,并更有利于诱导凋亡.由此可推断,rs679620 A等位基因在肿瘤的发生和侵染过程中是保护因素.因此,整体分析表明,在中国武汉地区汉族女性中,MMP-3 rs679620(A/G)位点的A等位基因可能为保护因素,病例和对照的差异虽然不具有统计学意义.但呈现一定的趋势,需加大样本量和增加考察的SNP数量进行深入研究.
SNPs被认为是最具应用潜力的新一代遗传标志物.通过聚合酶链式反应—限制性片段长度多态性方法(PCR-RFLP)发现单核苷酸多态性与癌症的关联关系,从而为癌症的预防和临床诊断治疗等提供分子标志物,具有疾病预防和诊断等方面的重要意义.
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer JClin,2007,57(1):43-46.
[2]Yu K D,DiG H,Wu J,et al.Development and trends of surgicalmodalities for breast cancer in China:a review of 16-year data [J].Ann Surg Oncol,2007,14(9):2502-2509.
[3]Hulka B S,Moorman PG.Breast cancer:hormones and other risk factors [J].Maturitas.2001,38(1):103-116.
[4]Ou Y G,Yao P F,Hu W J,et al.A non-synonymous coding SNP Lys45Glu ofmmp3 associated with ESCC genetic susceptibility in population of Henan,China[J].Chinese-German Journal of Clinical Oncogene,2009,8(9):510-515.
[5]欧阳刚,姚品芳,胡文娟,等.MMP3基因Lys45Glu单核苷酸多态性与食管鳞癌遗传易感性的关系[J].世界华人消化杂志,2009,17(24):2456-2462.
[6]欧阳刚,胡文娟,姚品芳,等.PCR-RFLP中Chelex-100制备DNA模版的方法建立及其条件优化[J].中南民族大学学报:自然科学版,2009,28(1):38-41.
[7]Eguchi T,Kubota S,Kawata K,et al.Novel transcription-factor-like function ofhumanmatrixmetalloproteinase 3 regulating the CTGF/CCN2 gene [J].Mol Cell Biol,2008,28(7):2391-413.
[8]Zhang J,Jin X,Fang S,etal.The functional SNP in the matrixmetalloproteinase-3promotermodifies susceptibility and lymphaticmetastasis in esophageal squamous cell carcinoma but not in gastric cardiac adenocarcinoma[J].Carcinogenesis,2004,25:2519-2524.

