羟丙基化罗望子多糖合成工艺研究
高立颜 张晓东
(青岛大学化学化工与环境学院 山东 青岛:266071)
罗望子多糖是从罗望子种子中提取分离出来的一种中性多糖,易分散于冷水,但不溶于冷水。罗望子多糖胶具有良好的耐热、耐盐、耐酸、耐冷冻和解冻性能,并具有稳定、乳化、增稠、凝结、保水、成膜与保健作用[1],已广泛应用于食品、医药、纺织、乳胶、造纸及日化等行业[2-5]。但由于其室温不溶于水,以及易产生老化现象[6],因而不能很好的满足食品与饮料加工和贮藏需要。为了改善罗望子多糖胶的室温水溶性,国外已经对其进行了羧甲基化改性研究,并取得了一定成效。但到目前为止尚未见文献报道对罗望子胶进行羟丙基化改性研究。
1 实验材料与方法
1.1 实验材料与设备
碱性罗望子胶粉(工业品,蛋白质含量<3%);工业酒精(90%);环氧丙烷(CP);氢氧化钠(AR),盐酸(AR),1,2-丙二醇(AR),浓硫酸(AR),水合茚三酮(AR);红外光谱仪器 (Nicolet FI-IR200),美国Thermo公司;UV-2101PC型紫外可见分光光度计,上海优尼科公司;Advance III600MHz核磁共振波普仪,瑞士布鲁克公司;NDJ-1旋转粘度计,上海森地科学仪器设备有限公司;Brookfield DV-I+型粘度计,美国Brookfield公司。
1.2 实验原理
环氧丙烷在碱性条件下可与罗望子多糖起醚化反应得到羟丙基罗望子多糖(HPT),反应方程式如下:
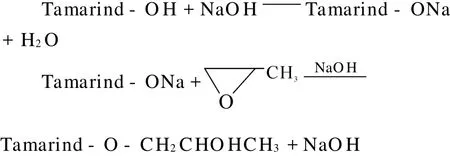
当然在反应过程中也存在副反应 ,如环氧丙烷在碱性条件下开环自聚或生成丙二醇,以及当羟丙基化反应达到一定程度后,环氧丙烷也会与产物中的羟丙基上的羟基发生副反应[7]等。
1.3 羟丙基罗望子胶粉的制备
称取45g罗望子胶粉,用适量工业酒精搅拌打浆10min,加入氢氧化钠,调节浆液 PH=10~11[8-9],于室温下加入一定量环氧丙烷,密封好,开动搅拌,升温至所需温度反应一定时间,抽滤,调p H值至6.5,烘干,粉碎,得羟丙基化罗望子多糖胶粉(HPT)。
1.4 羟丙基罗望子胶粉结构与性能测试
1.4.1 羟丙基罗望子胶粉取代度测定
采用JONES和JOHN的分光光度计法测定羟丙基取代度[10]。
1.4.2 透光率测试
称取羟丙基化罗望子胶粉在室温下用水溶解,配制成1%的胶液,以蒸馏水作参比,在620nm波长下测定胶液的透光率 T[11]。
1.4.3 流变性能测定
称取羟丙基化罗望子胶粉在室温下用水溶解,配制成4%的胶液,用BROOKFIELD DV-I+ VISCOMETER在不同转速下测定其粘度。
1.4.4 红外光谱分析
罗望子的原胶粉、羟丙基化罗望子胶粉(MS= 0.24,据本文2.3所示制备工艺)经90%酒精提纯洗盐后,除去样品中的游离水或结晶水,加 KBr压片,利用傅立叶变换红外光谱仪(Nicolet FI-IR 200)进行分析。
1.4.5 核磁共振氢谱分析
根据远期快车及慢车客流预计,远期早高峰快车客流最高断面约1.25万人次/h,慢车客流最高断面约3.83万人次/h。13号线列车采用8节编组的A型车,其列车定员为2 136人/列,因此远期高峰小时行车量需按照快车6对/h、慢车18对/h开行(其中,12对/h的慢车在深莞边界的公明北站折返),交路图如图3所示。
利用Bruker-600核磁共振仪,以重水为溶剂对经90%酒精提纯洗盐后的羟丙基化罗望子胶粉(MS=0.24)及原胶粉进行核磁碳氢谱分析。
2 结果与讨论
2.1 结构确认
2.1.1 红外光谱分析
图1为罗望子多糖胶(a)与羟丙基化罗望子多糖胶(b)的红外光谱图。由图1可以看出,罗望子多糖胶在 3411cm-1出现了羟基特征吸收峰,在2990cm-1出现了C-H的伸缩振动特征吸收峰,在1633cm-1、1572cm-1出现了烯醇的C=C伸缩振动特征吸收峰,在1424cm-1出现了C-H的弯曲振动峰,在1200-1000cm-1出现了C-O-C键不对称伸缩振动和-OH伸缩振动叠加的特征吸收峰,而羟丙基改性后的罗望子多糖胶保留了罗望子多糖在3411cm-1、 2990cm-1、 1633cm-1、 1572cm-1、1424cm-1、1200-1000cm-1较强的特征吸收峰外,还在1379cm-1处出现了-CH3的面内对称弯曲振动特征吸收峰,在1438cm-1处出现了-CH3的面内反对陈弯曲振动特征吸收峰,说明羟丙基确实被引入。
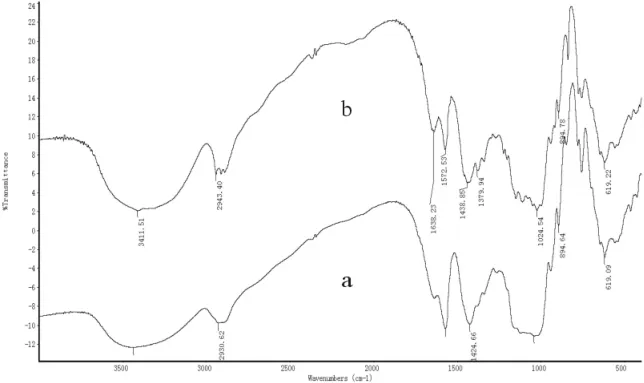
图1 羟丙基化前后罗望子多糖胶红外谱图对比
2.1.2 核磁共振氢谱分析
图2为羟丙基化罗望子多糖结构示意图,图3为罗望子原胶粉的1H-NMR图,图4为羟丙基化罗望子胶粉的1H-NMR图。罗望子多糖是由D -半乳糖,D-木糖,D-葡萄糖三种结构单元组成,其改性后引入羟丙基团,结构如图2所示,三种单糖中C-1相连的氧原子最多,相应的H-1处于最低场(δ5.220,δ5.213,δ4.636),C2-C6只连接了一个氧原子,故而其 H的化学位移接近,吸收信号严重重叠,很难分开,化学位移为δ3.214-δ3.895,如图3所示。对其进行羟丙基改性后,引入了羟丙基基团,羟丙基上的甲基峰位于最高场,化学位移δ在1.2左右,如图4所示,由此证明了羟丙基化反应已经成功进行。
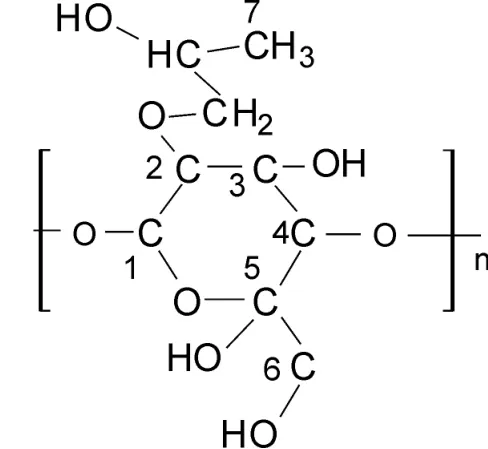
图2 羟丙基化罗望子多糖分子结构示意图
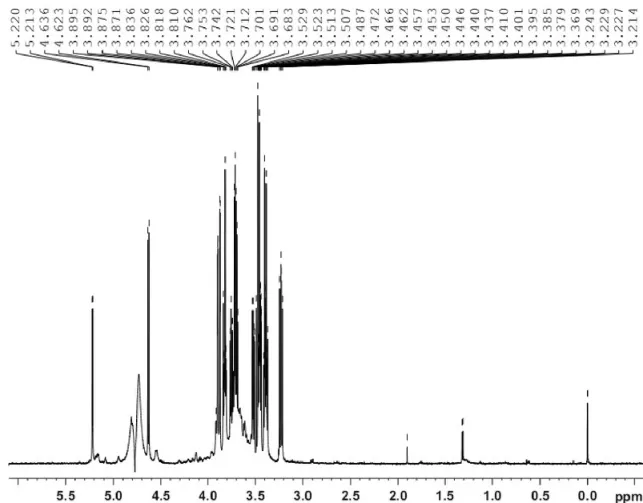
图3 罗望子原胶粉的1H-NMR图
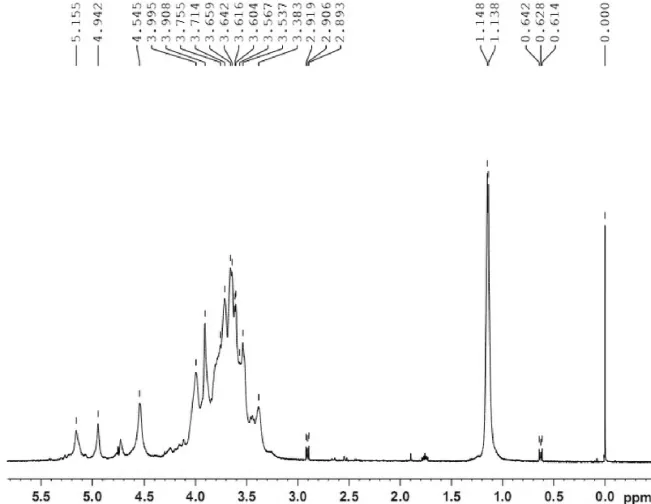
图4 羟丙基化罗望子胶粉的1H-NMR图
2.2 羟丙基化罗望子多糖的制备工艺
2.2.1 环氧丙烷用量对制备HPT取代度的影响
图5是在罗望子胶粉 45g,工业酒精(90%) 65mL,反应温度37℃,反应时间24h条件下,不同环氧丙烷用量对羟丙基罗望子多糖胶(HPT)取代度与表观粘度影响关系曲线。由图5可见,随着环氧丙烷用量的增加,羟丙基化罗望子多糖胶的的取代度增加,同时产品的表观粘度下降。实验发现当环氧丙烷用量增加到20.7mL后,反应产物与溶剂酒精成胶状,说明产品在酒精水溶液中的溶解性更好,取代度更高,但此时产品分离操作困难增加。为了能够适应工业化生产,本文选取环氧丙烷最高用量为20.7mL。由图5还可以看出:羟丙基罗望子胶粉随着取代度的增加,其表观粘度下降,这是由于在罗望子多糖分子上引入的羟丙基基团破坏了原有的罗望子多糖分子间的氢键缔合,以及在碱性条件下,罗望子多糖大分子发生降解所致。
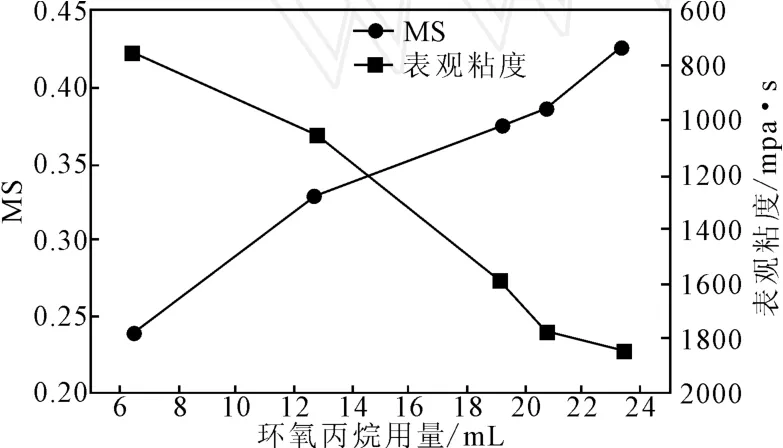
图5 环氧丙烷用量对HPT取代度的影响
2.2.2 反应时间对HPT取代度影响
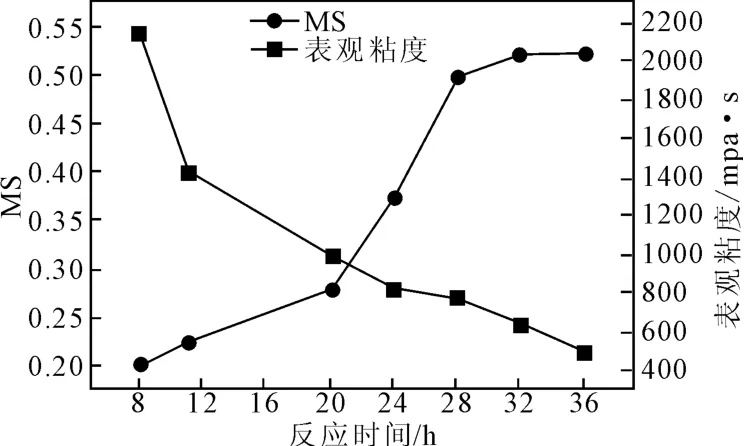
图6 反应时间对HPT取代度的影响
2.2.3 反应温度对HPT取代度的影响
图7是在罗望子胶粉45g,工业酒精65mL,环氧丙烷20.7mL,反应时间24h条件下,不同反应温度对羟丙基罗望子多糖胶(HPT)取代度与表观粘度影响关系曲线。由图7所示,随着反应温度的升高,羟丙基罗望子胶粉取代度呈直线持续增加,表观粘度逐渐下降。当反应温度达到45℃时,取代度达到最高,说明取代反应到了终点。提高反应温度,一方面会增加罗望子多糖胶颗粒的溶胀,使环氧丙烷易于渗透到其中,从而增加了环氧丙烷与罗望子多糖上的活泼羟基的接触与碰撞,另一方面,提高反应温度,还可以降低反应活化能,从而有利于醚化反应,提高产品的取代度。同时反应温度提高,还会使致多糖分子链降解反应加剧,导致表观粘度快速下降。另外环氧丙烷的沸点较低,温度过高,易挥发流失,导致会取代度下降。因此该实验条件下,为了获取较高的取代度,反应温度最高应取45℃。
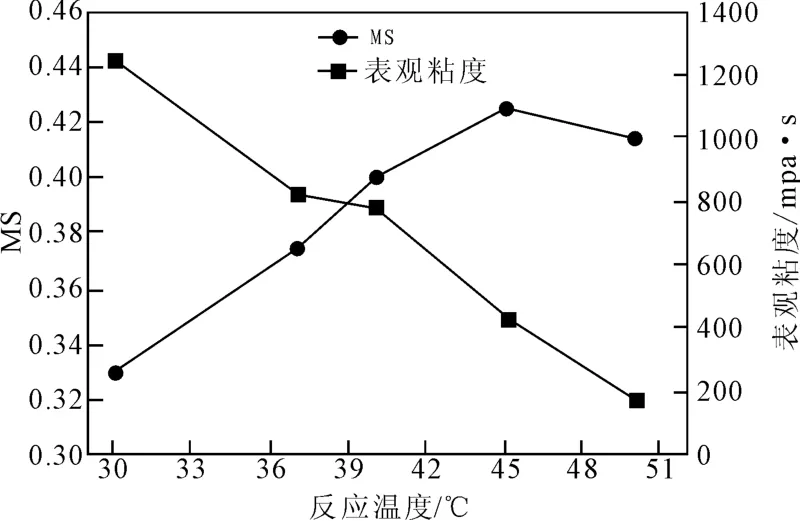
图7 反应温度对HPT取代度的影响
2.2.4 体系酒精浓度对HPT取代度的影响
图8是在罗望子胶粉45g,环氧丙烷20.7mL,反应时间24h,反应温度37℃条件下,反应体系不同酒精浓度对羟丙基罗望子多糖胶(HPT)取代度与表观粘度影响关系曲线。罗望子胶粉在冷水中不溶,但是会溶胀,反应体系中加入适量水分可以使得胶粉适当膨胀并溶解环氧丙烷。由图8可见,在最低酒精浓度(71%)时,产品的取代度最高,之后随着体系酒精浓度的提高,羟丙基化罗望子多糖的取代度不断降低,当体系酒精浓度提高到76%时,产品取代度降低速率逐渐变小;而产品粘度随着酒精浓度增加,呈现出先增大后减小的趋势,当体系酒精浓度达到76%时,产品粘度最大,再增加酒精浓度,产品粘度逐渐降低。实验发现当体系酒精浓度小于70%,反应体系随着反应的进行,会变得非常粘稠,导致搅拌困难,反应难于进行。因此在该反应条件下,酒精浓度至少要大于70%。
根据上述实验结果,本文在确定羟丙基化反应温度为45℃,反应时间为30小时,反应体系酒精浓度为75%的条件下,通过改变胶粉与环氧丙烷用量合成了系列不同取代度的羟丙基化罗望子多糖,并测定了其室温水溶性,透光率和流变性能。水溶性与透光率测试结果见表1所示。
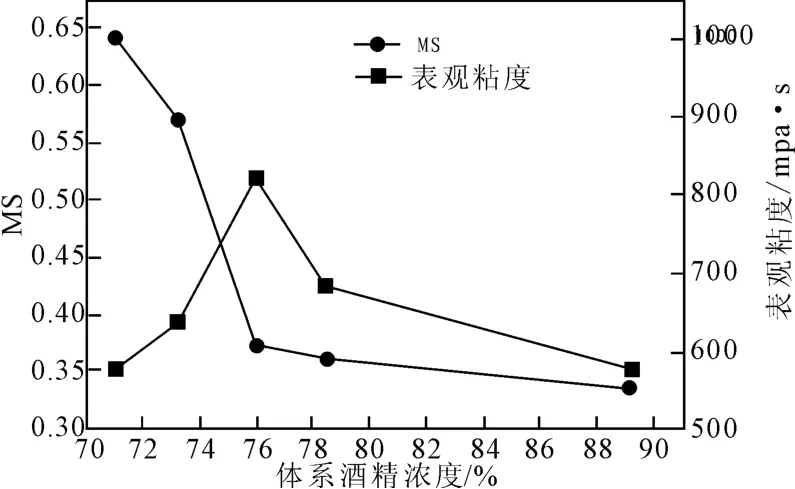
图8 体系酒精浓度对HPT取代度的影响
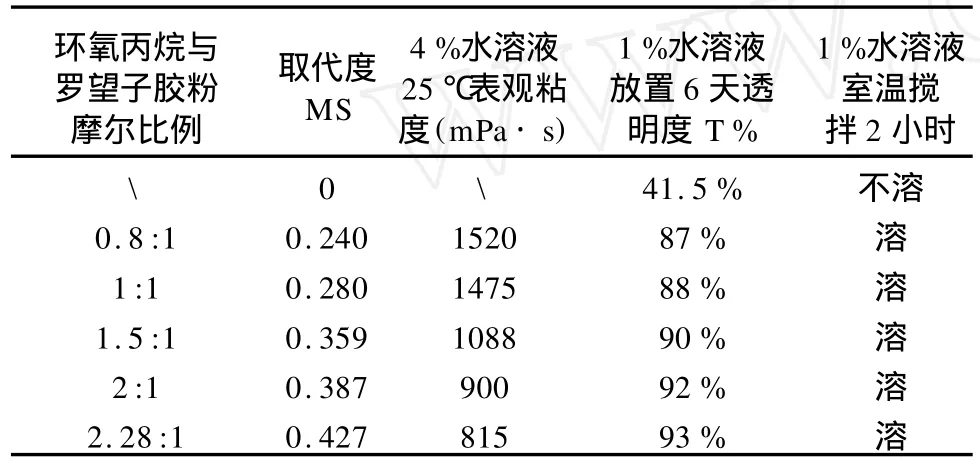
表1 不同取代度HPT水溶性与透光率
由表1中数据可见:原罗望子胶粉室温不能水溶,羟丙基化罗望子胶粉在室温下可以溶解或部分溶解,并且随着羟丙基取代度增加,产品的1%水溶液的透光率提高,产品的表观粘度下降。
图9为取代度MS为0.24和取代度MS为0.35的羟丙基罗望子胶粉的4%水溶液在不同的剪切速率τ下,测定溶液的表观粘度η,并以lnη对lnτ作图拟合得到的剪切速率与表观粘度的关系曲线。表2是由拟合直线的斜率和截距分别求得相应的稠度系数k和粘性指数n值。
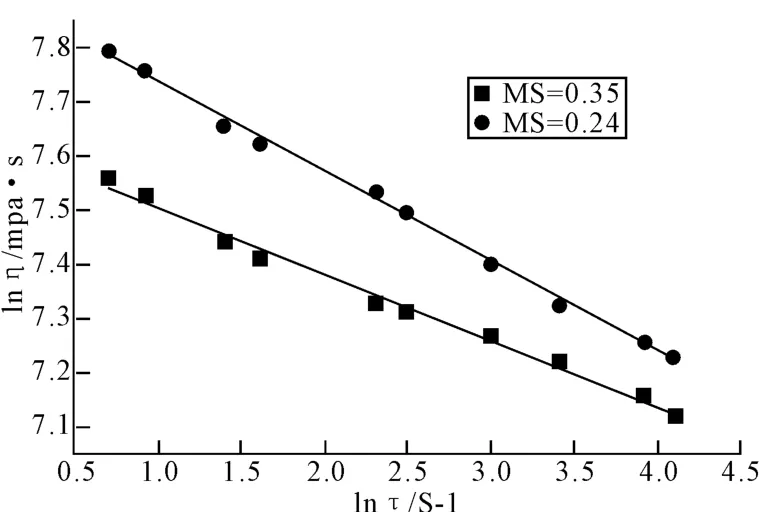
图9 HPT溶液的lnη对lnτ
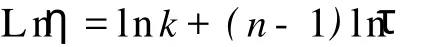
其中η为表观粘度,k为稠度系数,n为粘性指数,τ为剪切速率。

表2 羟丙基罗望子胶粉水溶液的稠度系数k和粘性指数n
由图9和表2数据可见:4%的取代度MS分别为0.24和0.35的羟丙基罗望子胶粉水溶液的表观粘度随剪切速率的变化符合Ostwald-Dewaele方程[12-13],在不同的剪切速率τ下,4%的羟丙基罗望子胶粉水溶液的表观粘度η呈现出剪切变稀的特征,属于非牛顿流体流变性质。
3 结论
羟丙基化罗望子多糖在室温下能够水溶,取代度越大,溶解时间越短,表观粘度越小,透光率越大,并且其水溶液表现出非牛顿流体流变性质,其溶液表观粘度随剪切速率的变化可以用Ostwald-Dewaele方程进行描述。
[1] 王元兰,李忠海.罗望子胶结构、性能、生产及其在食品工业中的应用[J].经济林研究,2006,24(3):71-74.
[2] 周家华.食品添加剂[M].北京:北京化学工业出版社,2001.
[3] 查正根,张悠金,舒俊生,等.罗望子种子多糖的制备及在再造烟叶中的应用究[J].烟草科技,2007,(7):3-5.
[4] Masaaki Fujisawa,Kanagawa(JP).Gel Composition and pack cosmetic using the same:US,2009/0130039A1[P].2009-5-21.
[5] Saettone,Marco Fabrizio.Ophthalmic solutions viscosified with tamarind seed polysaccharide:USA,6056950[P].2000-05-02.
[6] Peter Lang.Structure and aggregation behavior of tamarind seed polysaccharide in aqueous solution[J].Makromol.Chem. 1993,(194):3157-3166.
[7] 刘松青.马铃薯原淀粉制备羟丙基羧甲基淀粉新型片剂辅料的研究[D].四川:四川农业大学,2004.
[8] WeiLiu,JingXu.Preparation of a hydroxypropyl Ganoderma lucidum polysaccharide and its physicochemical properties[J]. food chemistry,2010,(122):965-971.
[9] StevenJ.Leusner,Lakewood,N.J.Process for hydroxypropylating starch:USA,4431800[P].1984-2-14.
[10] Jones,L.R.,Riddick,J.A.Colorimetric Determination of 1, 2-Propanediol and related compounds[J].Analytical Chemistry,1957,29(8):1214-1216.
[11] 张艳萍.变性淀粉制造与应用[M].北京:化学工业出版社, 2001.
[12] M.U.Beer,P.J.Wood,J.Weisz.A simple and rapid method for evaluation of Mark-Houwink-Sakurada constants of linear random coil polysaccharides using molecular weight and intrinsic viscosity determined by high performance size exclusion chromatography:application to guar galactomannan[J]. Carbohydrate Polymers,1999,39.377-380.
[13] S.Venkataiah&E.G.Mahadevan.Rheological properties of hydroxypropyl-and sodium carboxymethyl-substituted guar gums in aqueous solution[J].J Appl Poly Scie,1982,27:1533 -1548.

