非强化表观弥散系数值对急性脑梗死预后的研究*
张立涛 崔群生 马振波 武玉恒 孔庆奎 程 琮
(1.泰山医学院附属泰山医院影像诊断科, 山东 泰安 271000;2.泰山医学院公共卫生学院,山东 泰安 271016)
急性脑梗死(acute stroke)发病急,可继发一系列神经系统后遗症状或发病短时间内突发死亡,因此其早期快速、准确诊断是及时有效治疗的关键。Rose[1],Sobesky[2]等研究所用DWI与PWI组合模型往往需要注射增强对比剂,参数不统一,操作较为复杂、延误MR检查时间等问题,限制了其在临床的应用。DWI有助于对急性脑梗死及时进行正确的诊断[3]。Fiehler等[4]研究表明表观弥散系数(apparent diffusion coefficient,ADC)值的降低与血流灌注异常的程度密切相关,从梗死核心区到其周围,ADC值呈逐渐升高,这为应用ADC来表征弥散异常提供了依据。本研究旨在通过对33例急性脑梗死患者的DWI及ADC图进行分析,探讨非强化表观弥散系数值对急性脑梗死预后的诊断价值。
1 材料与方法
1.1 临床资料
自2010年3月至2010年11月筛选急诊及神经内科就诊并经随诊观察确诊为急性脑梗死患者33例(图像质量合格,无明显运动伪影等)。男22例,女11例,平均年龄为(61±11)岁。所有患者在发病6~12小时内进行磁共振成像,间隔4天后进行常规复查。所有患者在MR检查前均行计算机断层(computer tomography,CT)检查。以前有过梗死史、经CT证实为脑出血、颅内肿瘤、动静脉畸形或蛛网膜下腔出血患者排除在外。根据在DWI上测量病灶的大小将患者分为病灶扩大组(I组)与无扩大组(II组)。所有患者均无进行降高血压及抗脑水肿药物治疗。该研究经泰安市中心医院伦理委员会通过,并获得所有患者或其家属的知情同意。
1.2 MR检查
采用1.5T超导型磁共振成像系统(SQ,Siemens,Avanto,Germany),仰卧位,采用头部8通道线圈行MR检查,再行多模式MR检查的成像序列弥散加权成像检查,采用多层单发射回波平面成像(single-shot echo-planar imaging,SS-EPI)序列,采集19层覆盖全脑,b(弥散敏感系数)值分别为b=0 s/mm2和b=1000 s/mm2,重复时间(repetition time,TR)3200 ms,回波时间(echo time,TE)94 ms,slice=5 mm,视野(field of view,FOV)230 cm×230 cm,矩阵(matrix )190 mm×190 mm,成像时间38 s。
1.3 影像分析与信号测量
全部病例的MR图像均由2名放射学专家采用盲阅法进行阅片,观察和分析DWI上的病灶的影像表现,并与同层对侧相应同一层面正常部位影像进行比较。选取DWI显示病变范围最大层面,手动勾画出DWI异常区域的边缘,并自动得到所勾画区域梗死灶的大小(mm2),同时在ADC图上选取并测量病变区梗死中心及半暗带ADC值和对侧相应区域正常脑实质ADC值(图1)。
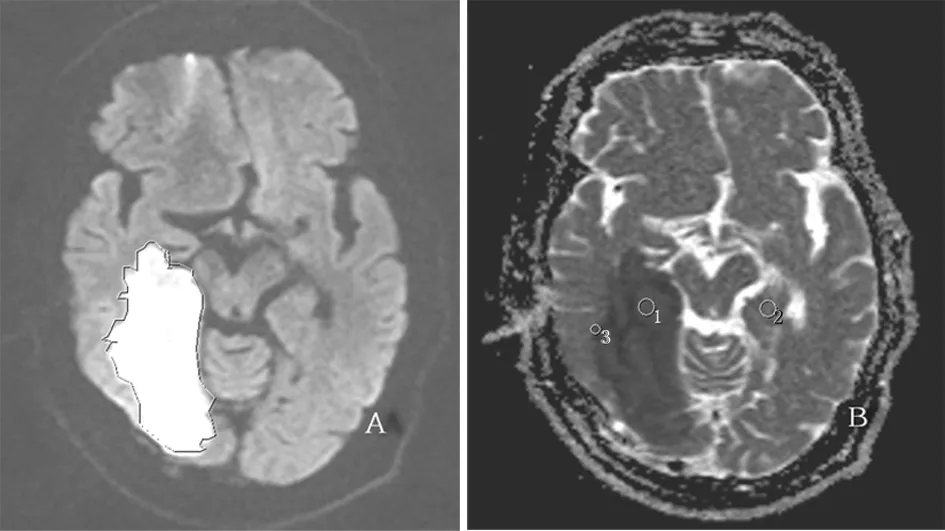
图1 DWI与ADC图
A:DWI图 B:ADC图
1:梗死灶 2:对侧相应区域正常脑实质 3:半暗带
1.4 统计学分析
2 结 果
2.1 病灶扩大组与无扩大组病灶大小的比较
发病6~12小时与间隔4天DWI测得病灶大小(表1),两组间差异有统计学意义(P<0.001)。

表1 DWI图上病灶大小(mm2)
2.2 病灶扩大组ADC均值的比较
发病6~12小时内病灶中心ADC均值、半暗带ADC均值明显低于对侧相应区域正常脑实质ADC均值[(392.3±57.2)×10-6mm2/s vs(807.0±43.6)×10-6mm2/s,(547.0±71.8)×10-6mm2/s vs(807.0±43.6)×10-6mm2/s,P<0.001](图2)。
2.3 病灶无扩大组ADC均值的比较
间隔4天病灶中心ADC均值、半暗带ADC均值明显低于对侧相应区域正常脑实质ADC均值[(480.5±61.6)×10-6mm2/s vs(770.3±45.1)×10-6mm2/s,(761.9±33.9)×10-6mm2/s vs(770.3±45.1)×10-6mm2/s,P=0.005](图2)。
2.4 病灶扩大组与无扩大组ADC均值的比较
两组病灶中心ADC均值之间及两侧相应区域正常脑实质ADC均值之间差异无统计学意义[(392.3±57.2)×10-6mm2/s vs(480.5±61.6)×10-6mm2/s,(807.0±43.6)×10-6mm2/s vs(770.3±45.1)×10-6mm2/s,P>0.05]。而病灶扩大组半暗带ADC均值明显低于病灶无扩大组[(547.0±71.8)×10-6mm2/s vs(761.9±33.9)×10-6mm2/s,P<0.001](图2)。
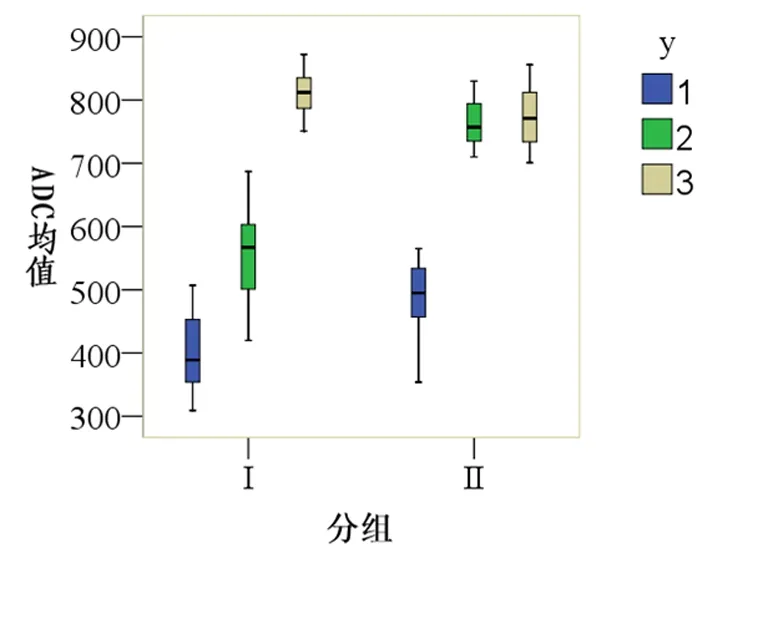
图2 组I与组II ADC均值图
注:1,2,3分别代表病灶中心、半暗带和对侧相应区域正常脑实质ADC均值。
3 讨 论
1977年,Abtrup等[5]通过实验首次提出缺血半暗带的概念。1981年,其将缺血半暗带定义为:脑缺血后坏死周围的脑组织,其血流灌注水平低于维持正常脑功能的血流水平。近年来,很多研究表明缺血半暗带内ADC值呈中等程度的下降[6]。Hoehn-Berlage等[7]的动物实验表明脑缺血组织内ADC值小于正常侧的70%左右。
人缺血脑组织的梗死中心区和缺血半暗带的ADC阈值也尚未统一。在过去,Dardzinski[8]认为,ADC很难对脑梗死不可逆损伤区域作出明确的界定。Schlaug[9]则认为梗死病灶中心ADC均值与对侧相应区域正常脑实质ADC均值的比值在0.50~0.78之间,缺血半暗带不可逆损伤区域ADC均值与对侧相应区域正常脑实质ADC均值的比值在0.87~0.98之间,缺血半暗带可逆损伤区域ADC均值与对侧相应区域正常脑实质ADC均值的比值在0.93之间。Pamela等人最初认为半暗带ADC均值小于584.0×10-6mm2/s,而且半暗带ADC均值与对侧相应区域正常脑实质ADC均值的比值小于0.8,容易发展为脑梗死;最初半暗带ADC均值大于804.0×10-6mm2/s,而且半暗带ADC均值与对侧相应区域正常脑实质ADC均值的比值大于0.96时,并没有演变为脑梗死。但是,还有相关文献则认为仅病灶中心ADC均值、半暗带ADC均值并不能对脑梗死的预后作出定论。在Fiehler等[4]研究中,发现有2例血管再通的患者,最初ADC值比正常值低60%左右,在第7天复查时,在T2WI图像上,病灶较发病时减少一半。他们分析认为与ADC绝对值没有关系,而是与组织自身修复能力有关。马丽、高培毅等[10]研究结果显示ADC方法对于判断缺血半暗带的存在具有较高的敏感度(88.4%)。在本研究中,组I与组II半暗带ADC均值之间差异有统计学意义(P<0.001)。组I病人梗死灶中心ADC均值(392.3±57.2)×10-6mm2/s,半暗带ADC均值(547.0±71.8)×10-6mm2/s ,也就是,梗死灶中心ADC均值、半暗带ADC均值与对侧相应区域正常脑实质ADC均值[(807.0±43.6)×10-6mm2/s]的比值分别为0.48、0.67。组II梗死灶中心ADC均值(480.5±61.6)×10-6mm2/s,半暗带ADC均值(761.9±33.9)×10-6mm2/s,相对应的ADC均值比值分别为0.62、0.99,这与Pamela等研究结果基本相似。
本研究的创新点在于通过DWI分析病灶异常区域的病灶的大小及结合ADC值来确定病灶预后。与其它应用ADC值判断缺血半暗带的研究[11-13]不同,本研究提出了这一全新的解决方案,不仅能够明显缩短传统急性脑梗死病人的MRI检查时间,为临床制定治疗方案提供有利时机,使得更多的病人获得治疗的机会,同时由于不需注射对比剂,能明显降低医疗费用。
本研究也有局限性,在有的病例中,病灶可能会沿着同一层面向周围脑组织扩大,而有的病灶则是沿着不同的层面向不同的方向同时扩展,因此,ADC值的大小与很多因素有关,如ADC图成像条件、ROI'S的大小及所选区域、数据的测量与分析和成像参数等,而且还与病灶扩大方向有密切关系,这就难免会造成假阳性结果。因此在本研究中,排除了在不同部位的梗死灶及不同点所测量的误差较大的ADC值。
综上所述,由于不需做注射对比剂的检查,因此ADC值可以作为梗死程度及梗死病变是否可逆的一个有效指标。我们认为梗死灶中心及半暗带的ADC值在急性脑梗死预后评估及对临床采用更积极有效的治疗方案,从而降低病死率是非常有帮助的。
[1] Rose SE, Janke AL, Griffin M, et al. Improved prediction of final infarct volume using bolus delay-corrected perfusion-weighted MRI implications for the ischemic penumbra[J].Stroke,2004, 35(5):2466-2471.
[2] Sobesky J, Zaro Weber O, Lehnhardt FG, et al. Which time-to-peak threshold best identifies penumbral flow? A comparison of perfusion-weighted magnetic resonance imaging and positron emission tomography in acute ischemic stroke[J]. Stroke, 2004, 35(7):2843-2847.
[3] Roberts TP, Rowley HA.Diffusion weighted magnetic resonance imaging in stroke[J]. Neurology, 2010, 74(24):1946-1953.
[4] Fiehler J, Knab R, Reichenbach JR. Apparent diffusion coefficient decreases and magnetic resonance imaging perfusion parameters are associated in ischemic tissue of acute stroke patients[J]. J Cereb Blood Flow Metab, 2001, 21:577-584.
[5] Astrup J, Siesj BK, Symon L. Thresholds in cerebral ischemia-the ischemic penumbra[J].Stroke, 1981,12(6):723-725.
[6] de Crespigny AJ, Rother J, Beaul ieu C. Rapid monitoring of diffusion, DC potential, and blood oxygenation changes during global ischemia Effects of hypoglycemia, hyperglycemia and TTX[J]. Stroke, 1999, 30(10):2212-2222.
[7] Hoehn-Berlage M, Norris DG, Kohno K. Evaluation of regional changes in apparent diffusion coefficient during focal ischemia of rat brain: the relationship quantitative diffusion NMR imaging to reduction in cerebral blood fow and metabolic disturbances[J]. Cereb Blood Flow Metab, 1995, 15:1002-1011.
[8] Dardzinski B, Sotak C, Fisher M, et al. Apparent diffusion coefficient mapping of experimental focal cerebral ischemia using diffusion-weighted echo-planarimaging[J]. Magn Reson Med, 1993,30(3):318-325.
[9] Schlaug G, Beneld A, Baird A, et al. The ischemic penumbra: operationally defined by diffusion and perfusion MRI[J]. Neurology, 1999,53(7):1528-1537.
[10] 马丽,高培毅,胡庆茂,等.表观弥散系数对确定急性缺血性卒中缺血半暗带的潜在价值[J].中国卒中杂志, 2009,4(9):731-737.
[11] Oppenheim C, Grandin C, Samson Y, et al. Is there an apparent diffusion coefficient threshold in predicting tissue viability in hyperacute stroke[J]? Stroke, 2001,32(5):2486-2491.
[12] Bristow MS, Poulin BW, Simon JE, et al. Identifying lesion growth with MR imaging in acute ischemic stroke[J]. J Magn Reson Imaging, 2008,28(4):837-846.
[13] Montiel NH, Rosso C, Chupin N, et al. Automatic prediction of infarct growth in acute ischemic stroke from MR apparent diffusion coefficient maps[J]. Acad Radiol, 2008,15(1):77-83.

