丹参对糖尿病大鼠肾组织VEGF表达的影响及其保护作用*
黄晓磊 王晓东
(泰山医学院附属泰山医院,山东 泰安 271000 )
糖尿病肾病(diabetic nephropathy,DN) 为糖尿病性微血管病变所致,病理学特征性改变表现为肾脏肥大、肾小球和肾小管基底膜增厚、细胞外基质(extracellular matrix,ECM)积聚致系膜区扩张,最后导致肾小球硬化、间质纤维化[1]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种内皮细胞特异性的丝裂原,已发现VEGF与DN发生发展密切相关[2-3]。本研究我们应用丹参(Salvia miltiorrhiza)对糖尿病大鼠进行干预,观察该药对大鼠生化指标和肾组织VEGF表达的影响,探讨其治疗糖尿病肾病可能的机制。
1 材料和方法
1.1 材料
普通级雄性Wistar大鼠40只,体质量180~220 g[山东大学实验动物中心提供。合格证号:SCXK(鲁) 20050015)];丹参注射液(三九医药股份有限公司产品);链脲佐菌素(streptozotocin,STZ,Sigma公司),批号S-0130规格100 mg;VEGF一抗及免疫组化试剂盒(PV-6001)(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1建立糖尿病大鼠模型 所有大鼠适应性喂养1周后,禁食12 h,随机取28只大鼠,将STZ溶于0.1 mmol/L、pH 4.2的无菌枸橼酸-枸橼酸钠缓冲液中,配制成10 g/L的STZ,按50 mg/kg一次性腹腔注射,72 h后经尾静脉取血测血糖,连续3次血糖≥16.7 mmol/L者达到模型标准。对照组仅注射等量的枸橼酸-枸橼酸钠缓冲液。
1.2.2动物分组及给药剂量 将成模的24只大鼠随机分成糖尿病模型组和丹参治疗组,每组12只。将预留的12只大鼠设为正常对照组。丹参治疗组自成模之日起按15 g·(kg·d)-1予以灌胃,糖尿病模型组和正常对照组给予等体积的蒸馏水灌胃,1次/d,连续8周。 所有大鼠在整个实验期间喂标准饮食,自由饮水,不用胰岛素。
1.2.3标本收集 ①大鼠精神状态、饮食、毛色、体重(每周记录1次)。②每周尾静脉采血测外周血血糖1次。③大鼠处死前1 d放入代谢笼,准确收集24 h尿液,离心分装后保存于-70℃冰箱中待测尿蛋白、尿肌酐。④于实验8周末在戊巴比妥腹腔注射麻醉下经股动脉收集血标本,保存于-40℃冰箱中待测血糖、血肌酐、尿素氮、胆固醇。经心脏注入4℃预冷的生理盐水反复灌洗,至整个肾脏颜色变苍白后游离,置于冰上,取8 mm3大小肾组织置于40 g/L多聚甲醛溶液中固定,石蜡包埋,制成厚度为4 μm切片,行HE染色。同时行多聚赖氨酸处理切片,进行免疫组化研究。
1.2.4尿白蛋白排泄率与肌酐清除率测定 采用EIA测定尿白蛋白含量,尿白蛋白排泄率(urine albumin excretion rate,UAER)为尿白蛋白含量与24 h尿量乘积;内生肌酐清除率(Ccr)按照下列公式计算:Ccr(ml/min)=Ucr(μmol/L)×V(ml) / Scr(μmol/L)×1440(min),并用体重(100 g)校正。其中Ucr,Scr,V分别代表尿肌酐、血肌酐浓度、24 h尿量。
1.2.5免疫组织化学采用即用型二步法(非生物素) 石蜡切片常规脱蜡,分级乙醇水化后行微波炉抗原修复15min,按即用型二步法检测试剂盒(PV-6001)说明进行免疫组织化学操作,VEGF多克隆抗体的稀释度为1︰100。显色时间为5 min,蒸馏水冲洗终止反应,中性树胶封片,镜下观察。VEGF抗体染色以胞质出现棕黄色颗粒为阳性信号。每例标本1张切片, 每张切片高倍镜下(×400)随机选择2~3个视野的肾小球及肾小管-间质, 采用Image-proplus 5.0图像分析系统测定该区域平均吸光度值, 取其平均吸光度均值作为结果。
1.3 统计学处理
2 结 果
2.1 一般状况
正常对照组大鼠精神状态良好、毛色光泽、进食正常,体重逐渐增加。糖尿病模型组大鼠在实验期间均表现出多饮、多食、多尿、体重下降,生长迟缓,精神萎靡,反应迟钝,毛发竖立无光泽,动作迟缓,蜷卧拱背等症状,丹参治疗组有类似表现,但程度有所缓解。
2.2 一般生化指标
糖尿病模型组大鼠表现为血糖升高、体重降低。丹参治疗组大鼠与糖尿病模型组相比血糖有所下降,体重有所增加,但差异无统计学意义。糖尿病模型组大鼠BUN、CHO、UAER明显高于正常对照组,Ccr明显低于正常对照组。丹参治疗8周大鼠BUN、CHO、UAER低于糖尿病模型组,Ccr高于模型组(表1)。
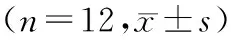
表1 各组大鼠临床及代谢参数的比较
注:与正常对照组比较,aP<0.01;与糖尿病模型组比较,bP< 0.05,cP<0.01。
2.3 各组大鼠肾组织病理形态学变化
光镜下观察,正常对照组肾小球毛细血管襻开放良好,未见肾小球节段硬化,肾小管上皮细胞排列整齐。糖尿病模型组肾小球体积增大,系膜区弥漫性增宽,细胞外基质增多,系膜细胞增生,基底膜增厚,肾间质有炎细胞浸润。丹参治疗组肾小球轻度肿胀,系膜区轻度增宽,系膜细胞增生,基底膜增厚较糖尿病模型组明显减轻。
2.4 各组大鼠肾组织VEGF表达变化
VEGF在正常对照组主要在肾小球脏层上皮细胞有微弱表达;在糖尿病模型组,肾小球VEGF表达明显增加(P<0.01),主要表达于肾小球系膜细胞、系膜区及上皮细胞,近曲小管也有微弱表达;在丹参治疗组,上述增加的表达受到显著抑制(P<0.05)。表达强度均采用平均光密度值(OD%值)作为结果记录(表2)。
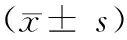
表2 各组大鼠肾组织VEGF的表达
注:与正常对照组比较,aP<0.01; 与糖尿病模型组比较,bP< 0.05。
3 讨 论
本实验采用STZ诱导大鼠糖尿病模型,8周后大鼠出现体质量下降,相对肾质量、尿素氮、胆固醇、尿蛋白排泄率增加,提示本模型已出现DN早期表现。丹参给药8周对糖尿病大鼠血糖、体质量无明显影响,但改善了肾脏病理损害,减少了尿蛋白排泄率,增加了内生肌酐清除率。研究表明丹参对实验性早期DN有明显保护作用,我们进一步探讨丹参对DN保护作用的可能机制。丹参属活血化瘀类中药,具有降低血黏度、抗凝、抗血栓、促进纤溶、改善微循环等作用。
DN为糖尿病性微血管病变所致,已成为终末期肾衰竭最常见的病因,其主要病理特点是肾脏高灌注、肾小球基底膜增厚和以肾小球系膜区为主的ECM积聚,导致结节性或弥漫性肾小球硬化及小管间质纤维化,出现蛋白尿、肾功能衰竭等功能紊乱。它的发生发展与血管内皮功能障碍密切相关,其蛋白尿出现提示糖尿病肾病存在广泛微血管损害[4-5]。VEGF在DN的发生发展中,已引起广泛重视。VEGF可诱导肾小球基底膜细胞增生、分裂 。VEGF是内皮细胞特异性的丝裂原,能促进内皮细胞增生、迁移,与血管内皮细胞上的受体结合,促进新血管生成,增加血管通透性[6]。 Satchell等[7]发现VEGF可降低肾小球内皮细胞的电阻达12.5 Ω/cm2,从而增加内皮细胞的通透性。VEGF与组胺和缓激肽的作用相似,可直接引起血浆外渗,可致occludin蛋白丝氨酸或苏氨酸残基磷酸化,引起occludin降解或构象改变,增加血管通透性。另外,VEGF可引起内皮细胞形态改变,如质膜囊泡和囊泡状小体(VVOS)的形成和聚集,通过影响细胞信号转导及胞间转运来调节蛋白尿的形成。VEGF与肾小球系膜细胞上的受体结合活化细胞内MAP激酶信号传递系统,促进系膜细胞合成ECM,还可促进单核细胞及多种细胞因子从血浆中渗出,沉积于肾小球系膜区,促进细胞增殖、ECM沉积,导致肾小球肥大。最近研究[8]表明糖尿病早期肾小球高滤过、肾小球和肾脏增大除上述原因外,常与肾小球滤过面积增加、新生血管生成有关,给予VEGF单克隆抗体或血管生成抑制剂(tumstatin)可缓解实验性糖尿病鼠肾高滤过、肾小球肥大、肾重和尿蛋白排泄,提示VEGF与糖尿病肾脏和DN阶段的微血管结构改变、血管新生有关。此外,VEGF还可诱导IGF-1、TGF-β、MCP-1、ET-1、PDGF等细胞因子的表达,参与DN的形成。
本实验结果显示,丹参治疗组大鼠VEGF在肾脏中的表达明显低于模型组,其平均光密度较模型组均有统计学意义(P<0.05)。证实丹参能降低VEGF在糖尿病大鼠肾脏中的表达,这可能是丹参治疗DN的机理之一。
[1] 叶任高,李幼姬. 临床肾脏病学[M] .北京:人民卫生出版社,2007:241-242.
[2] Flyvbjerb A. Putative pathophysiological role of growth factors and cytokines in experimental diabetic kidney disease[J].Diabetologia,2000,43(10):1205-1223.
[3] Gudehithlu KP,Singh AK.Vascular endothelial growth factor and diabetic nephropathy[J].Int J Artif Organs,1999,22(5):297-299.
[4] Senthil D,Choudhury G G,Mclaurin C,et al.Vascular endothelial growth factor induces protein synthesis in renal epithelial cells:a potential role in diabetic nephropathyl[J].Kidney Int,2003,64(2):468-479.
[5] De Vriese A S,Tilton R G,Elger M,et al.Antibodies against vascular endothelial growth factor improve early renal dysfunction in experimental diabetes[J].J Am Soc Nephrol,2001,12(5):993-994.
[6] Amemiya T,Sasamura H,Mifune M,et al.Vascular endothelial growth factor activates MAP kinase and enhances collagen synthesis in human mesanginal ceils[J].Kidney Int,1999,56(9):2054-2056.
[7] Satchell SC,Anderson KL,Mathieson PW.Angiopoietin l and vascular endothelial growth factor modulate human glomerular endothelial cell barrier properties[J].J Am Soc Nephrol,2004,15(3):566-574.
[8] Yamamoto Y,Maeshima Y,Kitayama H, et al.Tumstatin peptide,an inhibitor of angiogenesis,prevents glommerular hypertrophy in the early stage of diabetic nephropathy[J].Diabetes,2004,53(7):1831-1840.

