urantide抑制动脉粥样硬化大鼠单核细胞趋化蛋白-1的表达
赵娟
(承德医学院病理生理学教研室,河北承德067000)
urantide抑制动脉粥样硬化大鼠单核细胞趋化蛋白-1的表达
赵娟
(承德医学院病理生理学教研室,河北承德067000)
目的研究urantide对动脉粥样硬化(AS)大鼠胸主动脉及血管平滑肌细胞(VSMC)中单核细胞趋化蛋白-1(MCP-1)的表达的影响。方法(1)在体实验:采用给予高脂饮食及ip给予维生素D3制备AS模型。AS大鼠分别尾静脉注射urantide 30 μg·kg-1·d-1,分为3,7和14 d组。于各实验结束时间点测量体质量,检测血中甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和Ca2+;免疫组化法检测胸主动脉中MCP-1表达。(2)体外实验:贴块法制备的血管平滑肌细胞(VSMC)中加入尾加压素Ⅱ(UⅡ)10 μmol·L-1+urantide 0.1,1,10 nmol·L-1,0.1和1 μmol·L-1作用48 h,ELISA法检测细胞中MCP-1含量。结果(1)在体实验:与AS模型组比较,只有14 d urantide给药组的体质量显著增加(P<0.05);3 d组、7 d组及14 d组血清中Ca2+,TG,TC,HDL及LDL均随给药时间的延长呈现逐渐降低的趋势(P<0.01),达到或接近阳性药氟伐他汀组水平;在大鼠胸主动脉内膜及中膜斑块内,与AS模型对照组相比,urantide 3 d组、7 d组及14 d组MCP-1阳性染色强度和范围均减少。(2)体外实验:urantide各浓度组对VSMC培养上清中MCP-1的表达均有下调趋势(P<0.05)。结论urantide在大鼠动脉粥样硬化中可抑制炎症因子MCP-1的表达。
urantide;尾加压素Ⅱ;单核细胞趋化蛋白-1;动脉粥样硬化;血管平滑肌细胞
尾加压素Ⅱ(urotensinⅡ,UⅡ)作为目前收缩血管活性最强的活性肽,同时又是一种强烈的丝裂原,它在动脉粥样硬化(atherosclerosis,AS)中的病理生理意义越来越受到人们的重视。因此,对UⅡ及其受体的直接干预,可能为治疗AS提供新的策略和手段[1]。urantide是在hUⅡ基础上衍生的肽类UⅡ受体拮抗剂,其能竞争性地拮抗UⅡ对大鼠胸主动脉收缩作用及对血管壁细胞的促丝裂作用[2]。单核细胞趋化蛋白(monocyte chemotactic protein-1,MCP-1)是炎症反应最强的单核细胞趋化因子,在正常血管壁中几乎未见表达,而在AS损伤部位则有MCP-1产生,促进AS的发生[3-4]。UⅡ和炎症因子MCP-1都是促AS发生、发展的重要因素。urantide在拮抗UⅡ收缩作用的同时,是否对炎症因子MCP-Ⅰ的表达也具有一定的作用,这对于明确AS中UⅡ与炎症介质之间相互作用机制有重要的实验意义。因此,本研究利用大鼠AS模型和体外培养的血管平滑肌细胞(vascular smooth muscle cells,VSMC),探讨在urantide干预下,AS大鼠胸主动脉及VSMC中MCP-1表达的变化,为临床防治AS提供实验依据。
1 材料与方法
1.1 药物及试剂
urantide由上海华大天源生物科技有限公司合成;氟伐他汀(fluvastatin,Flu)购自北京诺华制药有限公司;DMEM培养基干粉及UⅡ2购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS)购自天津灏洋公司;α肌动蛋白抗体(anti-actin α,α-SMA)抗体购自北京博奥森生物技术有限公司;山羊抗大鼠MCP-1多克隆抗体购自北京中杉公司;生物素标记小鼠抗山羊IgG购自武汉博士德生物工程公司;SABC免疫组织化学试剂盒、DAB显色试剂盒购自福州迈新生物技术公司。
1.2 在体实验
1.2.1 动物、模型制备及分组
高脂饲料的配制:基础饲料,3.5%胆固醇,10%猪油,0.2%丙硫氧嘧啶,0.5%胆酸钠和5%白糖。
健康雄性Wistar大鼠,160只,体质量180~200 g,由吉林大学白求恩医学部动物部提供〔许可证号:SCXK(吉)-2009-0004〕。除25只大鼠作为正常对照组给予正常饲料外,其余125只Wistar大鼠,饲以高脂饲料基础上,每天ip给予维生素D3(vitamin D3,Vit D3)70 U·kg-1,连续3 d。实验周期为6周。HE染色,观察大鼠胸主动脉形态学改变。
AS模型复制成功后,AS模型组再随机分3组:模型组(25只)、阳性药氟伐他汀组(25只)、urantide组(75只,每个时间点各25只)。正常对照组和模型组每日尾静脉注射生理盐水30 μg·kg-1,连续14 d;氟伐他汀组每日ig给予氟伐他汀5 μg·kg-1,连续14 d;urantide组,每日尾静脉注射urantide 30 μg·kg-1,分别持续3,7和14 d。
1.2.2 血脂及血Ca2+浓度检测
分别在实验开始时、给药前及实验结束时进行血标本采集。采集方法:各组动物禁食过夜,大鼠用0.3%戊巴比妥30 mg·kg-1ip给予麻醉后,分离胸主动脉,用5 ml注射器采集动脉血,用1006×g。离心15 min,吸取血清分装于Eppendorf管中,-20℃冰箱保存备用。全自动生化分析仪检测大鼠血清中的甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)和Ca2+的含量。
1.2.3 免疫组织化学染色检测胸主动脉MCP-1表达
实验结束时,取胸主动脉约为1 cm,用4%多聚甲醛固定,留做组织学检测之用。采用SABC法进行免疫组化染色,按试剂盒操作说明进行,一抗滴加的山羊抗大鼠MCP-1多克隆抗体按1∶100比例稀释,新鲜配置的DAB显色液,室温下显色3~5 min,复染,封片。每张切片随机选取10个高倍镜视野(×400),用Introduction to Image-Proplus 6.0病理图像分析软件对所选视野内的免疫组化阳性信号进行图像分析,计算各组大鼠胸主动脉阳性信号的平均吸光度值(absorbance,A)。
1.3 体外实验
1.3.1 血管平滑肌细胞原代培养
健康雄性Wistar大鼠采用贴块法进行血管平滑肌细胞(vascular smooth muscle cells,VSMC)原代培养。步骤:①大鼠经乙醚麻醉后,迅速将胸主动脉自体内取出,立即放入75%乙醇中,移入无菌超净工作台;②将动脉剪成长2~3 cm的小段,去除外膜的血管放入培养皿中,纵向剪开管壁,然后用刀片轻轻刮除内膜,将中膜剪成1 mm3左右的小块,用弯吸管均匀接种于培养瓶中,在37℃条件下培养2~4 h;③待组织块牢固贴壁,沿侧壁缓慢加入含有10%胎FBS的DMEM培养液,置于CO2孵箱静止培养3 d后,观察换液。至细胞呈单层汇合后进行传代。
1.3.2 ELISA法检测上清中MCP-1的含量
对数生长期细胞用0.25%胰蛋白酶消化,制成细胞悬液,调整细胞密度约为1×107L-1接种至24孔板。待细胞80%融合后,加入含0.5%血清培养基同步生长24 h后,按照分组:(1)正常对照组,用含10%胎牛血清的DMEM培养液继续培养;(2)UⅡ组,加入UⅡ,终浓度为10-8mol·L-1;(3)氟伐他汀组:UⅡ组培养液的基础上加入氟伐他汀,终浓度为10-7mmol·L-1氟伐他汀;(4)urantide组:UⅡ组培养液的基础上加入urantide,终浓度为10-10~10-6mol·L-1,于48 h收集培养上清,用ELISA法检测上清中MCP-1的含量。每组设5个复孔。
1.4 统计学分析
2 结果
2.1 饲高脂饲料大鼠胸主动脉的组织结构改变
HE染色结果发现,正常对照组大鼠血管内皮完整,中膜可见梭形平滑肌细胞,弹力纤维层结构清晰完整(图1A);而饲高脂饲料大鼠病变部位内膜明显增厚,血管内皮细胞排列不完整,平滑肌细胞在内膜增生显著,大量堆积的泡沫细胞,出现典型AS病理改变(图1B)。说明ip给予Vit D3联合高脂饲料喂养的方法可成功建立大鼠AS模型。
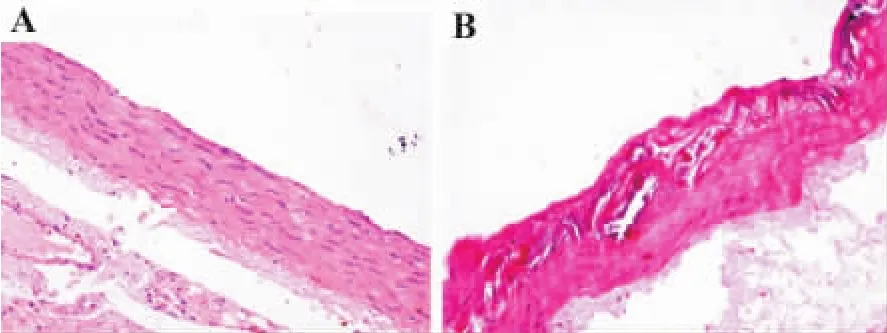
图1 饲高脂饲料大鼠胸主动脉的组织结构(HE×200).Wistar大鼠饲以高脂饲料基础上,每天ip给予维生素D370 U·kg-1,连续3 d。实验周期为6周.A:正常对照组;B:饲高脂饲料组.Fig.1 Morphological characters of thoracic aorta of atherosclerosis(AS)rats fed with high fat diet(HE×200)
2.2 urantide对动脉粥样硬化大鼠体质量的影响
表1结果显示,在模型制备期间,正常对照组大鼠体质量随饲养时间的增加而增长;与正常对照组比较,模型组大鼠体质量明显减少(P<0.01)。给药后,与模型组比较,只有urantide给药14 d时的体质量显著增加,与氟伐他汀组近似(P<0.05)。urantide给药3 d与7 d体质量与模型组无差异,依旧低于正常对照组(P<0.01)。
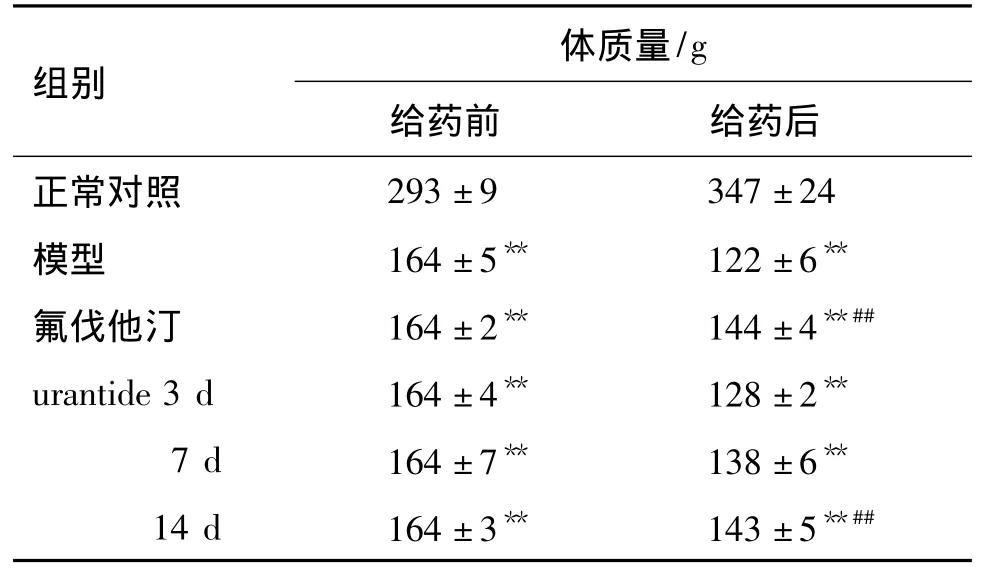
表1 urantide对动脉粥样硬化(AS)大鼠体质量的影响Tab.1 Effect of urantide on body mass of atherosclerosis(AS)rats
2.3 urantide对动脉粥样硬化大鼠血脂和血钙浓度的影响
表2结果显示,与正常对照组比较,模型组大鼠血清中Ca2+,TG,TC,HDL及LDL含量均明显升高,具有统计学意义(P<0.01)。与模型组比较,氟伐他汀组血清中Ca2+,TG,TC,HDL及LDL含量均明显降低(P<0.01),urantide各给药组在给药后,血清中各项指标均随给药时间的延长呈现逐渐降低的趋势(P<0.01),达到或接近氟伐他汀组的水平。
2.4 urantide对动脉粥样硬化大鼠胸主动脉MCP-1表达的影响
图2和表3结果显示,正常对照组大鼠胸主动脉内膜及中膜几乎没有MCP-1表达。在模型组胸主动脉AS斑块内,MCP-1阳性颗粒有少量表达。urantide各给药组及氟伐他汀组MCP-1表达减少。
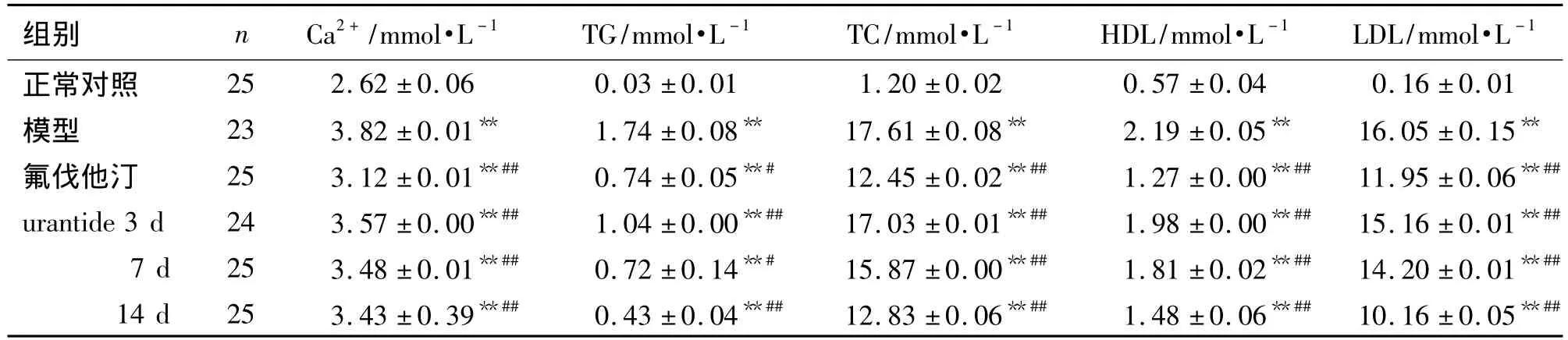
表2 urantide对AS大鼠血脂和血钙浓度的影响Tab.2 Effect of urantide on lipid and calcium concentrations of AS rats
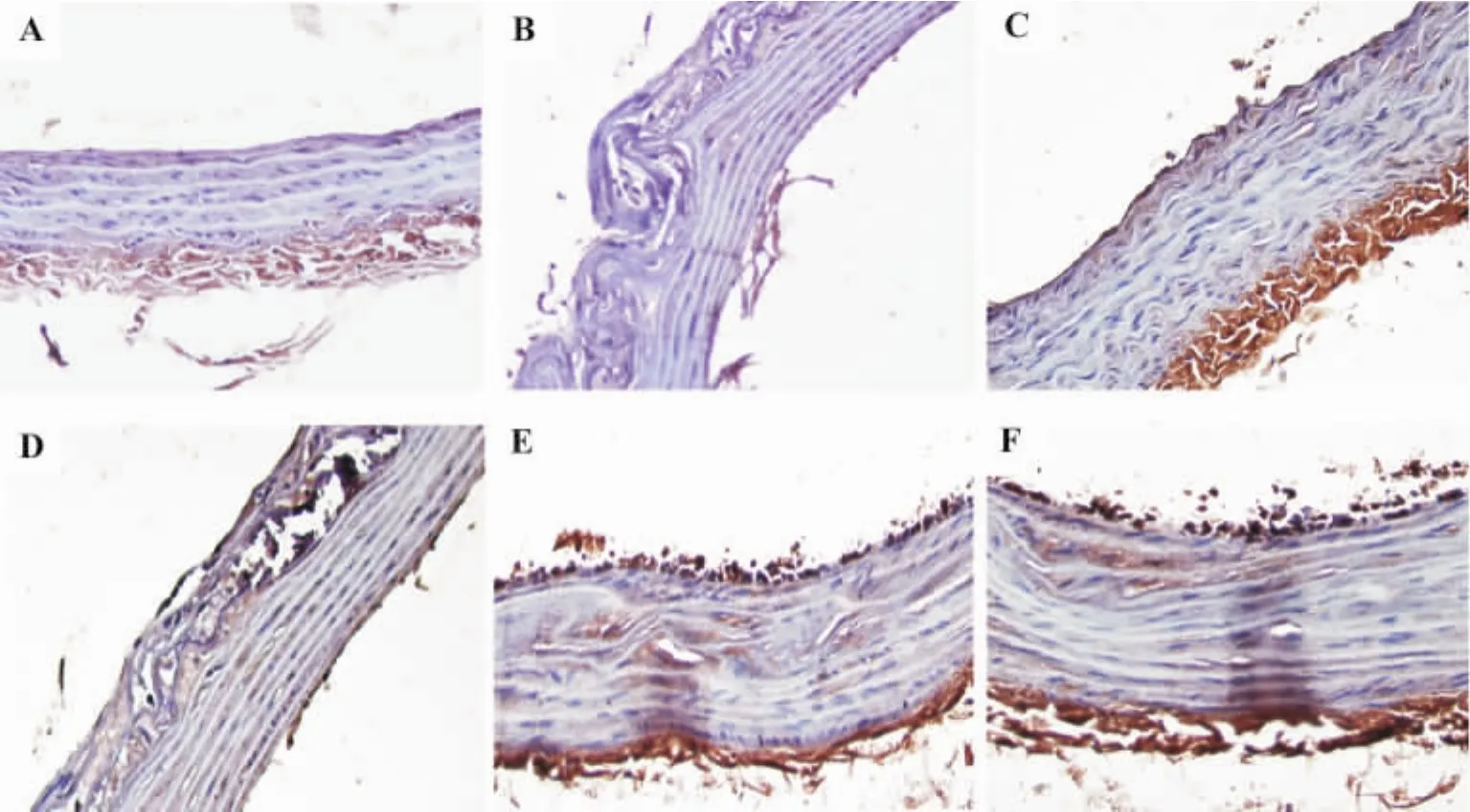
图2 免疫组化法检测urantide对AS大鼠胸主动脉单核细胞趋化蛋白(MCP-1)表达的影响(×400).A:正常对照;B:模型;C:氟伐他汀;D,E,F:urantide给药3,7及14 d组.Fig.2 Effect of urantide on monocyte chemotactic protein-1(MCP-1)in thoracic aorta of AS rats by immunohistochemistry(×400).
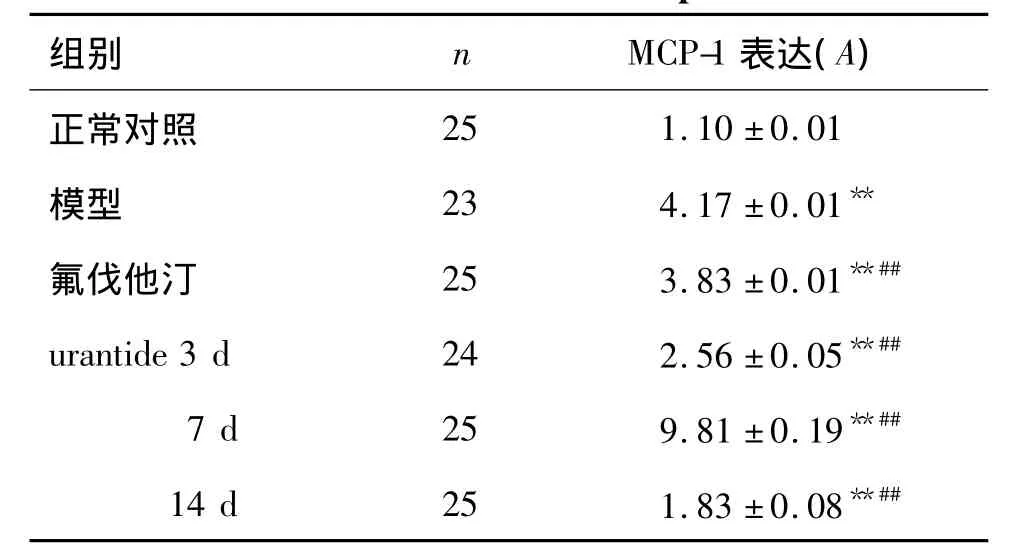
表3 urantide对AS大鼠MCP-1表达的影响Tab.3 Effect of urantide on MCP-1 expression in AS rats
2.5 urantide对血管平滑肌细胞培养上清中MCP-1含量的影响
表4结果显示,与正常对照组比较,UⅡ组VSMC培养上清中MCP-1的表达明显增加(P<0.01);urantide各浓度组对MCP-1的表达均有下调趋势,仅urantide 10-8,10-7及10-6mol·L-1组对MCP-1的抑制作用具有统计学意义(P<0.01或P<0.05)。
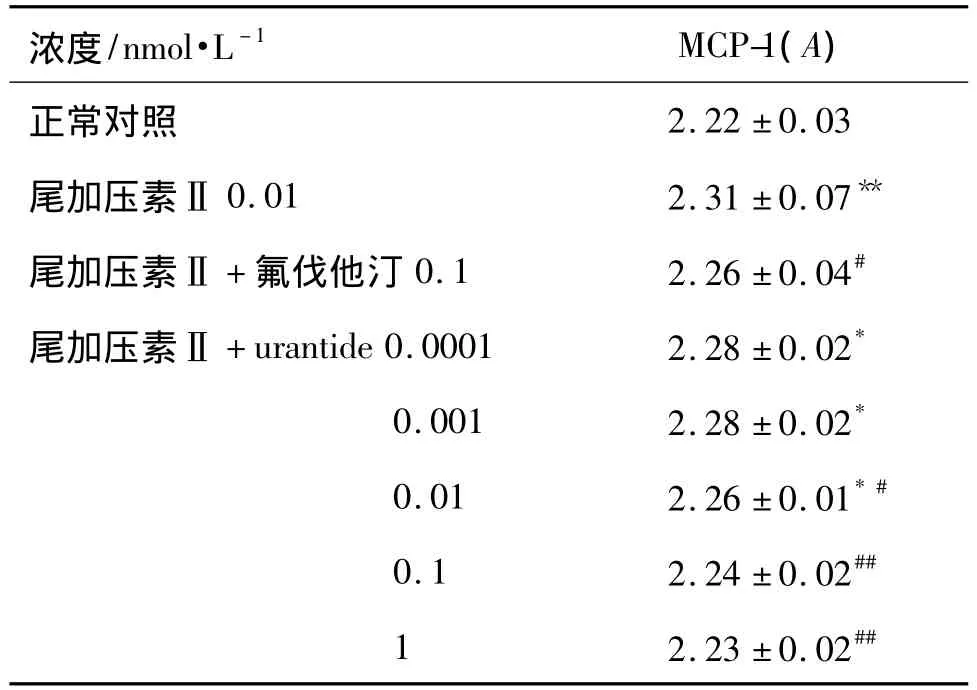
表4 urantide对尾加压素Ⅱ诱导的血管平滑肌细胞中MCP-1表达的影响Tab.4 Effect of urantide on MCP-1 expression in vascular smooth muscle cells induced by urotensinⅡ
3 讨论
研究证实,MCP-1主要存在于AS损伤部位脂质核心周缘富含巨噬细胞、内皮细胞和VSMC的区域。AS早期,炎症细胞在内膜聚集的过程,依赖于炎症细胞相关趋化因子的表达[5-6]。本实验发现,在模型组的胸主动脉内膜及中膜斑块内有MCP-1阳性颗粒表达,得到与MCP-1在血管损伤早期表达相一致的类似结果,提示MCP-1直接或间接地参与AS的发生。MCP-1在单独或与其他细胞因子协同作用下,可吸引血中单核细胞浸润到动脉壁,而浸润的单核细胞进入内皮转变成巨噬细胞,后者表面的受体与氧化变性的LDL结合,使之摄入大量的胆固醇,成为AS的泡沫细胞,促进AS斑块形成[7]。动物实验中,正常对照组MCP-1阳性颗粒在胸主动脉内膜及中膜几乎没有表达;在胸主动脉内膜及中膜斑块内,模型组MCP-1阳性颗粒有少量表达;而urantide给药3,7及14 d时,MCP-1阳性颗粒表达较模型组染色强度和范围逐渐减少。由此表明,urantide对MCP-1的表达有下调趋势,MCP-1随AS症状缓解而表达减少,这可能与UⅡ在AS含量变化有关。
MCP-1除能趋化单核细胞和T细胞外,对VSMC也有趋化、增殖作用,对单核/巨噬细胞的迁移和激活起特异性调控作用,从而直接或间接地参与AS的发生和发展[8]。UⅡ对VSMC有很强的促丝裂作用,并与其他丝裂原有协同作用。本实验结果显示,在VSMC的培养上清中,UⅡ对MCP-1的表达有上调作用,UⅡ受体拮抗剂urantide各浓度组对MCP-1的表达均有下调趋势,表明urantide不但可以拮抗UⅡ对VSMC的促丝裂作用,而且还可进一步的抑制UⅡ和炎症因子MCP-1之间的协同促增殖作用。
综上所述,在AS中,UⅡ特异性受体拮抗剂urantide在竞争性拮抗UⅡ对大鼠胸主动脉收缩及促丝裂作用的同时,对炎症因子MCP-1的表达也有下调作用,使大鼠AS症状缓解,对AS起一定的保护作用。其作用机制可能是urantide直接拮抗UⅡ与其受体GPR14结合产生的,也可能是通过调节MCP-1等炎症因子的表达间接引起的,或者是由其他途径介导的,这些尚有待进一步研究。
[1]Ban Y,Watanabe T,Suguro T,Matsuyama TA,Iso Y,Sakai T,et al.Increased plasma urotensin-Ⅱand carotid atherosclerosis are associated with vascular dementia[J].J Atheroscler Thromb,2009,16(3):179-187.
[2]Cheriyan J,Burton TJ,Bradley TJ,Wallace SM,MäkiúPetäjä KM,Mackenzie IS,et al.The effects of urotensinⅡand urantide on forearm blood flow and systemic haemodynamics in humans[J].Br J Clin Pharmacol,2009,68(4):518-523.
[3]林杨,叶山东.单核细胞趋化蛋白-1与糖尿病动脉粥样硬化的关系[J].国际内科学杂志,2007,34(7):381-385.
[4]Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s[J].Nature,1993,362(6423):801-809.
[5]Weisberg SP,Hunter D,Huber R,Lemieux J,Slaymaker S,Vaddi K,et al.CCR2 modulates inflammatory and metabolic effects of high-fat feeding[J].J Clin Invest,2006,116(1):115-124.
[6]Viedt C,Vogel J,Athanasiou T,Shen W,Orth SR,Kübler W,et al.Monocyte chemoattractant protein-1 induces proliferation and interleukin-6 production in human smooth muscle cells by differential activation of nuclear factor-kappaB and activator protein-1[J].Arterioscler Thromb Vasc Biol,2002,22(6):914-920.
[7]陈志伟,李胜涛,陈琪,张静,张钰敏.白细胞介素26、白细胞介素210与冠心病关系的研究进展[J].中西医结合心脑血管病杂志,2008,6(8):949-951.
[8]Ohman MK,Eitzman DT.Targeting MCP-1 to reduce vascular complications of obesity[J].Recent Pat Cardiovasc Drug Discov,2009,4(3):164-176.
Inhibitory effect of urantide on monocyte chemotactic protein-1 in atherosclerotic rats
ZHAO Juan
(Department of Pathophysiology,Chengde Medical College,Chengde067000,China)
OBJECTIVETo study the effect of urantide on monocyte chemotactic protein-1(MCP-1)expression in the vascular smooth muscle cells(VSMC)of the thoracic aorta atherosclerotic(AS)rats.METHODSThe AS rat model was replicated by high fat diet with vitamin D3intraperitoneally.Urantide was injected from tail vein at 30 μg·kg-1·d-1,the body mass in various groups of rats were recorded and triglyceride(TG),total cholesterol(TC),high density lipoprotein(HDL),low density lipoprotein(LDL)and the concentration of calcium in serum were detected at 3,7 and 14 d after urantide injection.The MCP-1 protein expression was detected by immunohistochemistry.The VSMC of thoracic aorta were cultured in vivo in the medium containing urotensinⅡ(10 μmol·L-1)with or without urantide 0.1,1,10,100 and 1000 nmol·L-1.The MCP-1 in the medium was detected by ELISA after 48 h.RESULTSCompared with AS model group,only the body mass of 14 d group of urantide 30 μg·kg-1increased significantly(P<0.05)while Ca2+,TG,TC,HDL and LDL in 3,7 and 14 d all decreased markedly(P<0.01).The immunostaining of MCP-1 could be seen in the intima and media of thoracic aorta,which increased significantly as well.Urantide down-regulated the expression of MCP-1 in VSMC(P<0.01).CONCLUSIONMCP-1 can be inhibited by urantide in AS rats.
urantide;urotensinⅡ;monocyte chemotactic protein-1;atherosclerosis;vascular smooth muscle cells
The project supported by Major Projects Funded Project of Science and Technology Bureau of Jilin Province(2005040425);and by Doctor Funded Project of Chengde Medical College(201102)
ZHAO Juan,E-mail:zhaojuan811015@sina.com,Tel:(0314)2291364
R966,R363
A
1000-3002(2011)05-0425-05
10.3867/j.issn.1000-3002.2011.05.003
吉林省科技厅重大项目资助课题(2005040425);承德医学院博士基金(201102)
赵娟(1981-),女,博士,主要从事病理学研究。
赵娟,E-mail:zhaojuan811015@sina.com,Tel:(0314)2291364
2011-03-01接受日期:2011-07-05)
(本文编辑:乔虹)

