依非韦伦的肝细胞毒性作用及对蛋白质表达谱的影响
马芳,熊华伟,贾小芳,姚亚敏,刘晓茜,张丽军,3
(1.上海市公共卫生临床中心科学研究部,上海201508;2.南昌大学生命科学与食品工程学院生物科学系,江西南昌330031;3.中南大学临床药理研究所,湖南长沙410083)
依非韦伦的肝细胞毒性作用及对蛋白质表达谱的影响
马芳1,熊华伟2,贾小芳1,姚亚敏1,刘晓茜1,张丽军1,3
(1.上海市公共卫生临床中心科学研究部,上海201508;2.南昌大学生命科学与食品工程学院生物科学系,江西南昌330031;3.中南大学临床药理研究所,湖南长沙410083)
目的探讨依非韦伦对肝细胞的毒性作用及对蛋白质表达谱的影响。方法人肝癌细胞系Huh7中分别加入依非韦伦1.25,2.5,5和10 mg·L-1,培养5 h后采用原位比色法测定细胞内活性氧类(ROS)的含量;依非韦伦2.5 mg·L-1与细胞作用5 h后,用膜联蛋白-Ⅴ/碘化丙啶细胞凋亡检测试剂盒染色。用流式细胞仪测定细胞凋亡;依非韦伦2.5 mg·L-1处理细胞5 h,获得全细胞蛋白质进行二维凝胶电泳,采用Image Master软件分析差异蛋白质点,应用纳升级液相色谱串联电喷雾离子阱质谱进行差异蛋白质鉴定。结果随着依非韦伦浓度的增加,细胞内ROS的含量逐步升高(r=0.9740,P<0.05)。依非韦伦2.5 mg·L-1与细胞作用5 h后,与正常对照组比较,细胞凋亡百分率无显著变化,但有7种蛋白质表达量显著降低,其中线粒体热激蛋白75和抗氧化蛋白1的表达量分别降低了76.7%和85.5%;抗胰蛋白酶及其S突变体、细胞角蛋白9、剪接体相关蛋白和磷酸丙糖异构酶的表达被完全抑制。结论依非韦伦对Huh7细胞具有明显的细胞毒性,可能通过调节热激蛋白75和抗氧化蛋白1等的表达影响线粒体的功能,最终导致肝毒性的发生。
依非韦伦;肝细胞;毒性;活性氧类;蛋白质组学
依非韦伦(efavirenz,EFV)是一种在抗艾滋病治疗中广泛使用的非核苷类逆转录酶抑制剂。目前临床上推荐使用的剂量是每天单次口服600 mg,从而可达到药物的有效浓度1~4 mg·L-1[1]。虽然临床结果表明,EFV与其他抗艾滋病一线治疗药物相比具有相对较高的安全性,但不良反应时有发生,包括皮肤反应、神经系统病变及肝毒性[2]。在一项接受EFV抗病毒治疗的312名艾滋病患者的研究中发现,EFV引起的严重肝中毒的发生率高达8%;但在这些严重肝中毒的发生病例中,只有50%艾滋病患者在服药12周内,可通过检测血清中谷草转氨酶或谷丙转氨酶水平及时判断严重肝中毒,另外50%的肝中毒患者则在12周之后才可做出判断[3-4],表明EFV相关的严重肝毒性的早期观察和诊断仍缺乏较好的标志物。Ena等[5]研究表明,在服用EFV并存在以下因素之一时,EFV导致的严重肝毒性的发生率升高,这些因素包括丙肝病毒感染、酗酒和联合使用蛋白酶抑制剂。
研究表明,细胞线粒体功能的紊乱是许多药物引起肝毒性的重要机制,而线粒体功能失调可由细胞内活性氧类(reactive oxygen species,ROS)的升高引起[6-7]。因此,细胞内ROS的升高可作为判断肝毒性发生的指标之一。目前,对EFV导致肝毒性的研究仅局限于测定谷草转氨酶和谷丙转氨酶等酶活性的改变,尚未从细胞蛋白质组水平探讨EFV对细胞蛋白质整体表达水平的改变,从而明确该药物对肝细胞总蛋白表达的影响。本研究采用蛋白质组学的方法,探讨EFV对肝细胞的毒性作用及其机制。
1 材料与方法
1.1 细胞、药品、试剂和仪器
人肝癌细胞系Huh7,由复旦大学医学院袁正宏教授惠赠。EFV口服片,购自澳大利亚默沙东制药公司,用甲醇溶解磨碎成粉末[5],配成EFV 10 g·L-1的甲醇溶液,用0.22 μm滤器过滤除去未溶解的辅料及杂质,4℃储存备用,使用时用含10%胎牛血清的DMEM培养基(完全培养基)稀释至适当浓度。DMEM培养基、胰蛋白酶、青霉素、链霉素和胎牛血清,均购自美国Gibco公司;甲醇,购自国药集团;GENMED细胞氧化应激ROS定量检测试剂盒,购自上海杰美基因医药科技有限公司;膜联蛋白-Ⅴ/碘化丙啶细胞凋亡检测试剂盒,购自南京凯基生物科技发展有限公司;蛋白质快速定量试剂盒,购自美国Bio-Rad公司。CO2培养箱,美国Thermo公司;倒置显微镜,日本Olympus公司;稳压电源和垂直平板电泳系统,美国Bio-Rad公司;纳升级液相色谱Ultimate 3000(包括C18预柱和C18反向柱),购自美国戴安公司;高容量离子阱HCT质谱仪,购自德国Bruker Daltonics公司。
1.2 细胞培养
人肝癌细胞Huh7在含青霉素200 kU·L-1,链霉素100 mg·L-1的完全培养基中于37℃,5%CO2条件下培养。取对数生长期的Huh7细胞制备细胞悬液,调整细胞密度为3×107L-1,接种于96孔板中或10-cm细胞培养皿中继续培养。
1.3 ROS含量检测
按上述方法将细胞接种于96孔板中并培养至约85%细胞融合后,将完全培养基更换成含EFV终浓度分别为1.25,2.5,5和10 mg·L-1的完全培养基,每个浓度设5个复孔,在CO2培养箱中培养5 h,按照GENMED ROS原位比色法定量检测试剂盒所述步骤进行ROS的定量检测:染色液染色4 h,固着液固定2次,空气中晾干后用溶解液充分溶解后,使用酶标仪测定浓度650 nm的吸光度值(absorbance,A)。药物处理组细胞ROS相对含量的计算参考文献[7]进行,ROS相对含量(%)=(A药物/A正常对照)×100%。
1.4 细胞凋亡百分率检测
按上述方法将细胞接种于6孔板中并培养至85%细胞融合,将完全培养基换成含EFV终浓度为2.5 mg·L-1的培养基,设3个复孔,在CO2培养箱中培养5 h,用不含EDTA的胰酶消化细胞后按照膜联蛋白-Ⅴ/碘化丙啶双染法细胞凋亡检测试剂盒进行细胞染色,最后用流式细胞仪检测细胞凋亡百分率。
1.5 细胞全蛋白质的提取、定量和二维凝胶电泳分离
细胞在生长至约85%细胞融合后,移除完全培养基,用EFV 2.5 mg·L-1的完全培养基培养5 h后,PBS洗细胞2次,向培养皿中加入细胞裂解液(含尿素8 mol·L-1,硫脲2 mol·L-1,4%CHAPS,1%NP-40,1%DNA酶),用细胞铲收集细胞,离心收集上清即得细胞蛋白质。用蛋白质快速定量试剂盒对提取的蛋白质进行定量,对照组和EFV 2.5 mg·L-1组各500 μg蛋白质样品同时在20℃自动进行18 cm IPG干胶条水化和聚焦,聚焦时间为6 h。等电聚焦结束后,将胶条进行两步平衡,进行SDS-聚丙烯酰胺凝胶电泳,分离胶浓度为13.5%;最后进行考马斯亮蓝染色。每组样品重复3次。
1.6 差异蛋白分析和质谱鉴定
采用Image Master软件分析差异蛋白质,胶中切取差异蛋白质点,脱色脱水冻干后,每管加入约5 μl胰酶(0.02 g·L-1),37℃酶解过夜。酶切后肽段先经C18预柱脱盐,再经C18反向柱进行分离,分离的肽段由纳流喷针进入HCT质谱进行实时的离子化分析检测。用Data Analysis 3.2软件整合肽指纹图谱和串联质谱二级图谱,通过Mascot软件查询NCBI数据库。所有的蛋白质质谱鉴定结果均经过人工检查,每个蛋白质至少有一条肽段同时检测到3个或3个以上连续的y离子或b离子。
1.7 统计学分析
2 结果
2.1 EFV对人肝癌细胞Huh7 ROS含量的影响
如表1所示,与正常对照组相比,EFV 1.25,2.5,5和10 mg·L-1组细胞ROS含量均明显升高(P<0.05,P<0.01),且具有浓度依赖关系(r=0.9740,P<0.05)。

表1 依非韦伦(EFV)对人肝癌细胞Huh7细胞内活性氧类(ROS)含量的影响Tab.1 Effect of efavirenz(EFV)on content of reactive oxygen species(ROS)in Huh7 cells
2.2 EFV对人肝癌细胞Huh7凋亡率的影响
图1流式细胞仪检测结果表明,EFV 2.5 mg·L-1与Huh7细胞作用5 h,与正常对照组比较,细胞凋亡率无明显变化。EFV 2.5 mg·L-1组细胞凋亡率为(22.5±3.4)%,正常对照组为(19.7±5.1)%,无显著性差异(n=3,P=0.475)。
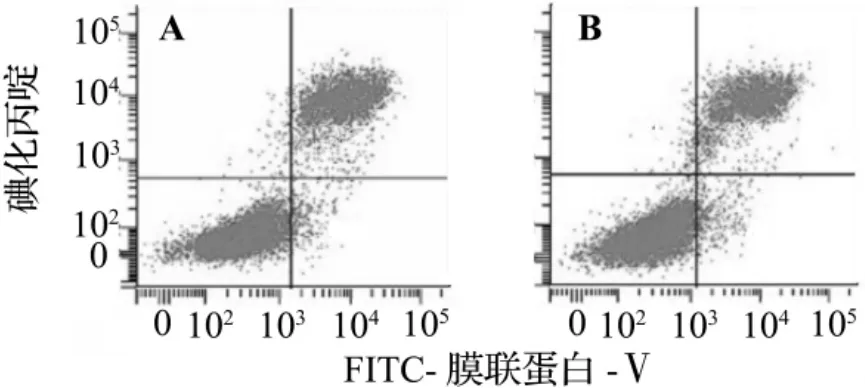
图1 EFV 2.5 mg·L-1与Huh7细胞作用5 h对细胞凋亡率的影响.A:正常对照组;B:EFV 2.5 mg·L-1.Fig.1 Effect of EFV 2.5 mg·L-1on cell apoptosis incubating with Huh7 cells for 5 h.
2.3 EFV对人肝癌细胞Huh7蛋白质表达谱的影响
将正常对照组和EFV 2.5 mg·L-1组细胞的全蛋白质进行二维凝胶电泳,对电泳胶进行考马斯亮蓝染色。ImageMaster软件分析鉴定结果表明,EFV组和对照组分别有733±75和764±104个蛋白质点(n=3)。选择二维凝胶电泳分离效果好、点数多的一块胶作为参考胶,进行平行组间的匹配分析,筛选表达量差异在2倍及其以上的差异蛋白,共识别了7个差异蛋白(图2),将其编号为1~7号。其中1号蛋白质点(图3)胶内校正后的平均灰度值,EFV组与正常对照组比较下降了76.7%。

图2 EFV 2.5 mg·L-1对Huh7细胞差异表达蛋白影响的二维凝胶电泳.图中圆圈画出的蛋白质点为经过Image Master软件分析表达差异在2倍以上的蛋白质点.A:正常对照组;B:EFV 2.5 mg·L-1.Fig.2 Profiles of two-dimensional gel electrophoresis on differently expressed proteins in Huh7 cells for effect of EFV 2.5 mg·L-1.

图3 1号蛋白质点在正常对照组(A)和EFV 2.5 mg·L-1组(B)中的差异表达.箭头所指为1号蛋白质点的位置.1-3:分别表示3次重复实验.Fig.3 Different expression of No.1 protein spot between normal control(A)and EFV 2.5 mg·L-1(B)treated cells.
2.4 EFV引起人肝癌细胞Huh7差异表达蛋白质的质谱鉴定及分析
将经过图像分析确定的7个差异蛋白质点进行取点、脱色和胰酶酶解后,经过液相色谱串联质谱(LC-MS/MS)分析,获得的肽片段的质荷比(m/z)输入Mascot查询系统,检索NCBI蛋白质数据库。如果Mascot分数>45则认为得到鉴定,否则视为未得到鉴定。图4为1号蛋白质点的Mascot搜索结果的得分示意图,显示1号蛋白质点得到阳性鉴定。图5显示1号蛋白质点的匹配肽段和二级质谱图,图中可见质谱检测到该肽段9个连续的y离子:y4,y5,y6,……,y12,表明该肽段的鉴定非常准确。结合蛋白质等电点和相对分子质量的信息,将1号蛋白质点鉴定为线粒体热休克蛋白75。另外6个差异点的分析类似1号蛋白质点,鉴定结果见表2。其中线粒体热休克蛋白75和抗氧化蛋白1在EFV 2.5 mg·L-1组表达量分别下降76.7%和85.5%,而其余5个蛋白质则是在对照组中有表达,而在EFV 2.5 mg·L-1组中未检测到表达。
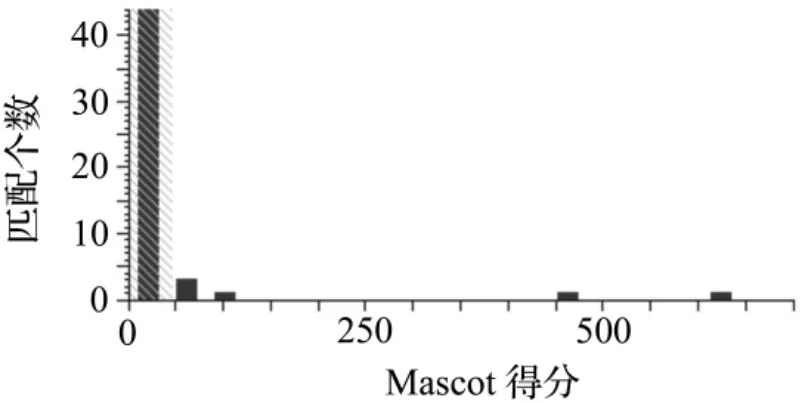
图4 1号蛋白质点的Mascot得分.得分超出阴影区表明得到阳性鉴定(P<0.05),1号蛋白质点的Mascot得分是624分.Fig.4 Mascot score of No.1 protein spot.

图5 线粒体热激蛋白75的质谱鉴定的序列覆盖率和二级质谱图.A:蛋白质序列,带下划线的序列为通过HCT质谱检测到的氨基酸序列;B:肽段EQQIVIQSSGGLSK的酶切肽段二级质谱图,该肽段在线粒体热休克蛋白序列中的位置在A中以粗体表示.Fig.5 Sequence coverage of mitochondrial heat shock protein 75 and MS/MS spectrum of peptide(EQQIVIQSSGGLSK)from it.
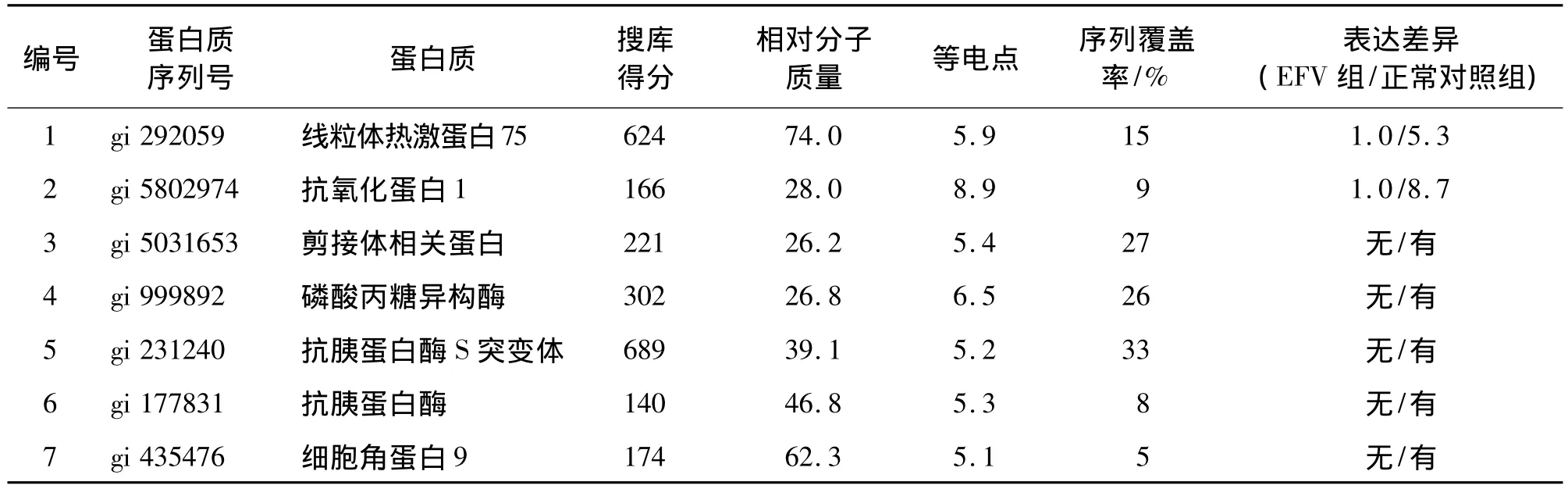
表2 鉴定EFV 2.5 mg·L-1作用Huh7细胞5 h表达的差异蛋白Tab.2 Differential proteins between EFV 2.5 mg·L-1treated Huh7 cells and untreated control cells
3 讨论
EFV作为一种临床一线使用的抗艾滋病药物,其广泛和长期使用势必需要对其毒性进行全面的评估。本研究发现,EFV 2.5 mg·L-1对肝细胞凋亡无明显影响,但可使肝毒性指标——细胞内ROS含量明显升高。通过蛋白质组学的方法检测EFV 2.5 mg·L-1作用后的肝细胞Huh7蛋白质表达谱的改变,结果表明7种蛋白表达明显降低,分别是线粒体热激蛋白75、抗胰蛋白酶及其S突变体、细胞角蛋白9、剪接体相关蛋白、磷酸丙糖异构酶和抗氧化蛋白1。
肝细胞内线粒体热激蛋白75和抗氧化蛋白1是与细胞应激相关的蛋白。线粒体热激蛋白75是一种定位在线粒体受葡萄糖调节的蛋白质,具备普遍性和保守性,可通过抗氧化作用、协同免疫作用和抗细胞凋亡途径发挥作用,使细胞产生应激反应从而保护细胞[8]。抗氧化蛋白1也定位在线粒体,能调节细胞增殖和分化,从而实现细胞的抗氧化功能,对线粒体自稳态的维持发挥重要作用[9],它的异常表达会导致肿瘤的发生[10]。在对空气中常见的一种污染物——丙烯醛的毒性研究发现,细胞在丙烯醛5 μmol·L-1暴露30 min后,抗氧化蛋白1抗氧化活性被抑制85%以上,并且这种抑制作用具有浓度依赖关系,同时该蛋白的活性在消除丙烯醛刺激4 h后仍然不能恢复,表明丙烯醛对该蛋白活性的抑制是不可逆的[11]。在细胞凋亡过程中,抗氧化蛋白1的缺失导致了细胞内超氧化物H2O2水平的升高,这种超氧化物的增多反过来又抑制线粒体的功能,促进细胞凋亡[12]。本研究发现,在EFV作用下来源于线粒体的热激蛋白75和抗氧化蛋白1的表达量显著下降,为研究EFV肝毒性早期细胞蛋白质的变化以及线粒体功能紊乱在肝毒性中的作用提供了线索。
另外5个差异蛋白均是在正常对照组中有表达,而EFV 2.5 mg·L-1处理5 h后则不表达。其中有丝氨酸蛋白酶抑制剂家族的抗胰蛋白酶及其S突变体,该基因的缺失会引起肝高胆红素血症和一些肝酶的活性改变,并且会通过肝纤维化的途径进一步导致肝硬化[13]。还有3种差异蛋白质,分别是细胞角蛋白,它参与蛋白质结合及细胞骨架的组成;剪接体相关蛋白,它与mRNA的剪接相关,定位在细胞核;磷酸丙糖异构酶,可催化磷酸二羟丙酮和右旋甘油醛3磷酸之间互换。这3种蛋白质与肝毒性之间的相关性目前尚未见文献报道。
肝是EFV最主要的代谢场所[14]。本研究在用ROS实验证实了EFV肝毒性的前提下,采用蛋白质组学的方法从蛋白质表达整体水平探讨EFV对肝细胞的毒性作用,有利于揭示EFV作用早期细胞的变化,为EFV肝毒性的早期诊断和机制研究提供了线索。
[1]Katsounas A,Frank A,Klinker H,Langmann P.Efa virenz-therapy in HIV-patients with underlying liver disease:importance of continuous TDM of EFV[J].Eur J Med Res,2007,12(8):331-336.
[2]Harris M,Montaner JS.Clinical uses of non-nucleoside reverse transcriptase inhibitors[J].Rev Med Virol,2000,10(4):217-229.
[3]Sulkowski MS,Thomas DL,Mehta SH,Chaisson RE,Moore RD.Hepatotoxicity associated with nevirapine or efavirenz-containing antiretroviral therapy:role of hepatitis C and B infections[J].Hepatology,2002,35(1):182-189.
[4]Brück S,Witte S,Brust J,Schuster D,Mosthaf F,Procaccianti M,et al.Hepatotoxicity in patients prescribed efavirenz or nevirapine[J].Eur J Med Res,2008,13(7):343-348.
[5]Ena J,Amador C,Benito C,Fenoll V,Pasquau F.Risk and determinants of developing severe liver toxicity during therapy with nevirapine-and efavirenz-containing regimens in HIV-infected patients[J].Int J STD AIDS,2003,14(11):776-781.
[6]Sato N.Central role of mitochondria in metabolic regulation of liver pathophysiology[J].J Gastroenterol Hepatol,2007,22(Suppl 1):S1-S6.
[7]Blas-García A,Apostolova N,Ballesteros D,Monleón D,Morales JM,Rocha M,et al.Inhibition of mitochondrial function by efavirenz increases lipid content in hepatic cells[J].Hepatology,2010,52(1):115-125.
[8]Voloboueva LA,Lee SW,Emery JF,Palmer TD,Giffard RG.Mitochondrial protection attenuates inflammation-induced impairment of neurogenesis in vitro and in vivo[J].J Neurosci,2010,30(37):12242-12251.
[9]Greco T,Fiskum G.Neuroprotection through stimulation of mitochondrial antioxidant protein expression[J].J Alzheimer's Dis,2010,20(Suppl 2):S427-S437.
[10]Chua PJ,Lee EH,Yu Y,Yip GW,Tan PH,Bay BH.Silencing the peroxiredoxinⅢgene inhibits cell proliferation in breast cancer[J].Int J Oncol,2010,36(2):359-364.
[11]Myers CR,Myers JM.The effects of acrolein on peroxiredoxins,thioredoxins,and thioredoxin reductase in human bronchial epithelial cells[J].Toxicology,2009,257(1-2):95-104.
[12]Chang TS,Cho CS,Park S,Yu S,Kang SW,Rhee SG.PeroxiredoxinⅢ,amitochondrion-specificperoxidase,regulates apoptotic signaling by mitochondria[J].J Biol Chem,2004,279(40):41975-41984.
[13]Fregonese L,Stolk J.Hereditary alpha-1-antitrypsin deficiency and its clinical consequences[J].Orphanet J Rare Dis,2008,3:16.
[14]Pulido F,Torralba M.NNRTI hepatotoxicity:efavirenz versus nevirapine[J].J HIV Ther,2002,7(Suppl 2):S3-S16.
Proteomic analysis and hepatotoxicity of efavirenz in hepatocytes
MA Fang1,XIONG Hua-wei2,JIA Xiao-fang1,YAO Ya-min1,LIU Xiao-qian1,ZHANG Li-jun1,3
(1.Department of Scientific Research,Shanghai Public Health Clinical Center,Shanghai201508,China;2.Department of Life Sciences,School of Life Sciences and Food Engineering,Nanchang University,Nanchang330031,China;3.Institute of Clinical Pharmacology,Central South University,Changsha410078,China)
OBJECTIVETo investigate the hepatotoxicity of efavirenz(EFV)in hepatocytes and its impact on proteome profile.METHODSThe reactive oxygen species(ROS)in cells were detected by colorimetry analysis after human liver cancer Huh7 cells were cultured with EFV 1.25,2.5,5 and 10 mg·L-1for 5 h,respectively.Cell apoptosis was analyzed by flow cytometry following Annexin-Ⅴ/propidium iodide dying after Huh7 cells were incubated with EFV 2.5 mg·L-1for 5 h.The proteins extracted from cells treated with EFV 2.5 mg·L-1or untreated control cells were separated by two-dimensional gel electrophoresis,and the differently expressed proteins in normal control and EFV 2.5 mg·L-1groups were analyzed using ImageMaster software and identified by online reversed-phase nano-flow liquid chromatography coupled with ion trap mass spectrometry.RESULTSCompared with normal control cells,the ROS content in EFV groups significantly increased(P<0.05),and there was a good concentration-effect relationship(r=0.9740,P<0.05).After EFV 2.5 mg·L-1treatment for 5 h,the apoptosis percentage had no significant change,but expression level of seven proteins decreased significantly,among which mitochondrial heat shock protein 75 and antioxidant protein 1 were down-regulated 4.3 and 7.7 times by EFV,respectively.Alpha-1-antitrypsin,the S variant of alpha-1-antitrypsin,cytokeratin 9,pre-mRNA-splicing factor and triosephosphate isomerase were completely inhibited by EFV.CONCLUSIONEFV has hepatotoxicity,and EFV might regulate mitochondrial function through decreasing the expression of MTHSP75 and antioxidant protein 1 in mitochondria,which may contribute to its hepatotoxicity.
efavirenz;hepatocytes;toxicity;reactive oxygen species;proteomics
The project supported by Natural Science Foundation of Shanghai(09ZR1426300);WANG Bao-en Liver Fibrosis Foundation(20100031);and Post-doctoral Foundation of Central South University(20100471238)
ZHANG Li-jun,E-mail:zhanglijun1221@163.com,Tel:(021)37990333-5368
R978.7,R966
A
1000-3002(2011)05-0441-06
10.3867/j.issn.1000-3002.2011.05.006
上海市自然科学基金(09ZR1426300);王宝恩肝纤维化基金(20100031);中南大学博士后基金(20100471238)
马芳(1983-),实习研究员,硕士,主要从事药物毒理学研究;张丽军(1969-),副教授,博士,主要从事蛋白质组学研究。
张丽军,E-mail:zhanglijun1221@163.com,Tel:(021)37990333-5368
2011-02-11接受日期:2011-07-07)
(本文编辑:齐春会)

