甲氧滴滴涕及其代谢产物2,2-二(4-羟基苯基)-1,1,1-三氯乙烷在大鼠体内的毒代动力学
阚歆,张潇云,王哲,董洁,王蒙蒙,胡国新
(1.温州医学院药学院分子毒理与药理研究所,浙江温州325035;2.温州市第三人民医院药剂科,浙江温州325000)
甲氧滴滴涕及其代谢产物2,2-二(4-羟基苯基)-1,1,1-三氯乙烷在大鼠体内的毒代动力学
阚歆1,2,张潇云1,王哲1,董洁1,王蒙蒙1,胡国新1
(1.温州医学院药学院分子毒理与药理研究所,浙江温州325035;2.温州市第三人民医院药剂科,浙江温州325000)
目的探讨甲氧滴滴涕(MXC)及其代谢产物2,2-二(4-羟基苯基)-1,1,1-三氯乙烷(HPTE)在大鼠体内的毒代动力学。方法雄性SD大鼠单次ig给予MXC 500 mg·kg-1染毒后,于不同时间点收集血液样本。应用高效液相色谱-紫外法测定大鼠血浆中MXC和HPTE的含量,用DAS 2.0软件的房室模型进行拟合,计算代谢动力学参数。结果MXC的毒代动力学参数血浆最大浓度(cmax)为(5.52±1.21)mg·L-1;分布半衰期(t1/2α)为(4.12±1.21)h;消除半衰期(t1/2β)为(22.54±6.31)h;曲线下面积〔AUC(0-t)〕为(65.97±17.94)mg·h·L-1;AUC(0-∞)为(69.06±18.61)mg·h·L-1;清除率(Cl)为(7.94±2.31)L·h-1·kg-1;和表观分布容积(V)为(66.16±20.21)L·kg-1。代谢产物HPTE的毒代动力学参数cmax为(1.32±0.37)mg·L-1,t1/2α为(3.13±0.91)h;t1/2β为(31.12±10.91)h,AUC(0-t)为(14.69±2.99)mg·h·L-1,AUC(0-∞)为(17.23±3.66)mg·h·L-1,Cl为(30.14±6.09)L·h-1·kg-1,V为(232.55±36.44)L·kg-1。结论MXC及其代谢产物HPTE的毒代动力学均符合二室模型。MXC和HPTE的清除半衰期均较长,易发生体内蓄积。
甲氧滴滴涕;2,2-二(4-羟基苯基)-1,1,1-三氯乙烷;毒代动力学
甲氧滴滴涕(甲氧氯,methoxychlor,MXC)化学名为1,1,1-三氯-2,2-二对甲氧苯基乙烷,属有机氯杀虫剂,其较之滴滴涕毒性低并且容易降解,故而用来取代滴滴涕广泛用于保护水果、庄稼、蔬菜和宅园。MXC主要通过食物链途径进入人体[1]。在体内,MXC会转变成为2-(4-羟基苯基)-2-(4-甲氧基苯基)-1,1,1-三氯乙烷和2,2-二(4-羟基苯基)-1,1,1-三氯乙烷〔2,2-bis-(phydroxyphenyl)-1,1,1-trichloroethane,HPTE〕[2]。近年来,MXC及其代谢产物HPTE的毒性作用不断被发现,其涉及机体神经系统、生殖系统、免疫系统和内分泌系统等,其中生殖系统的毒性尤为突出[3]。并且发现HPTE具有比MXC更强的生殖毒性[4],从而受到越来越多的重视。目前,MXC的检测方法以及毒代动力学(简称毒动学)研究国内外已有文献报道[5-8],但HPTE的毒动学研究目前未见报道。
本研究采用高效液相色谱(high performance liquid chromatography,HPLC)-紫外法同时检测大鼠血浆中MXC及其代谢物HPTE的浓度,并研究二者在大鼠体内的毒动学过程,为研究MXC以及HPTE在动物体内代谢奠定基础。
1 材料与方法
1.1 试剂与仪器
MXC标准品,纯度95%,购自Sigma公司。HPTE标准品由Monsanto公司WR KELCE教授提供;氯硝西泮购自中国药品生物制品检定所,批号171227200802;乙腈色谱纯,批号1434430822,购自Merck公司。
1100系列高效液相色谱仪,包括G1311A四元泵,G1379A在线脱气机,G1316A柱温箱,G1314A VWD检测器和G1328B手动进样器和化学工作站(美国Agilent公司);AB204-A电子分析天平(梅特勒-托利多上海仪器公司);XW-80型旋涡混合器(上海医科大学仪器厂);TGL-16G型高速离心机(上海安亭科学仪器厂);SYZ-550型石英亚沸高纯水蒸馏器(江苏金坛市丹阳门石英玻璃厂)。
1.2 动物
SD大鼠8只,雄性,体质量250~280 g。由温州医学院实验动物中心提供,动物合格证号:SCXK(沪)2007-0005。
1.3 高效液相色谱条件
色谱柱XDB-C18(4.6 mm×150 mm,5 μm);流动相为A:H2O,B:乙腈;二元梯度洗脱程序:0 min时A∶B(55∶45),6 min时A∶B(15∶85),8 min时A∶B(55∶45),流速1.0 ml·min-1;紫外检测波长:240 nm;柱温:30℃。
1.4 动物给药及生物样品的收集
大鼠8只,适应性饲养1周,染毒前禁食12 h。MXC用玉米油溶解,一次性ig给予MXC 500 mg·kg-1染毒。分别于染毒前和染毒后5,10,20 min,1,2,4,4.5,5,5.5,6,6.5,8,12,24,36和48 h尾静脉取血0.3 ml;注入肝素化的试管,2898×g离心10 min,取血浆,-65℃保存备测。
1.5 血浆样品的预处理
取血浆样品100 μl注入1.5 ml EP管中,加入内标氯硝西泮15 mg·L-1工作液10 μl,混匀后加入乙腈150 μl,混旋1 min后,14 489×g离心10 min,取上清液,20 μl进样检测。操作过程尽量避光,处理好的样本及时检测。
1.6 MXC及HPTE标准曲线的制备
精密量取空白血浆180 μl置于带盖的1.5 ml EP管中,分别加入MXC和HPTE系列标准溶液各20 μl,摇匀,使样品中MXC血浆浓度分别为0.06,0.12,0.3,0.6,1.2,3,6和12 mg·L-1,HPTE血浆浓度分别为0.06,0.12,0.2,0.3,0.6,1.2,2和3 mg·L-1,按1.5项的方法预处理后,记录色谱图及峰面积,分别以MXC及HPTE的峰面积与内标峰面积之比为横坐标,MXC及HPTE的浓度为纵坐标进行线性回归,计算出校正标准曲线方程。
1.7 MXC及HPTE在血浆中回收率和精密度考察
分别配制MXC 0.12,0.6和6 mg·L-1,HPTE分别为0.12,0.3和2 mg·L-1的质控血浆样品各5份。按1.5项处理后,记录检测量,以检测量与加入量之比计算相对回收率;以血浆标准的峰面积与该浓度纯标峰面积之比计算绝对回收率。精密度用日内和日间变异表示。以各浓度分别在同日测定5次,记录检测量,计算日内变异系数。再按以上测定方法每日测定1次,连续5 d重复测定,记录检测量,计算日间变异。
1.8 MXC及HPTE在血浆中稳定性考察
配制MXC浓度分别为0.12,0.6和6 mg·L-1,HPTE浓度分别为0.12,0.3和2 mg·L-1的质控血浆样品各7份,其中4份在室温下放置0,3,6和12 h后再经血浆样品处理方法处理后进样检测,记录结果。另外3份分别在-65℃冰箱冰冻保存1,2和4周后,再经血浆样品处理方法处理后进样检测,记录结果。考察室温放置和冰冻保存血浆样品的稳定性;同时取3种浓度的MXC和HPTE血浆样品置于-65℃冰箱中,于2,4和6 h取出反复冻融,测定MXC和HPTE的含量。考察其冻融稳定性。
1.9 统计学分析
2 结果
2.1 MXC及HPTE的高效液相方法学确证
图1显示,血浆中MXC,HPTE和内标物氯硝西泮的峰形良好,分离完全,无杂质峰干扰。MXC,HPTE和内标氯硝西泮的保留时间分别为8.2,4.3和3.3 min。MXC的校正标准曲线回归方程为Y=2.2045X+0.0107(r=0.9998),HPTE的校正标准曲线回归方程为Y=2.8744X-0.0284(r=0.9997)。血浆MXC及HPTE的定量下限均为0.06 mg·L-1。
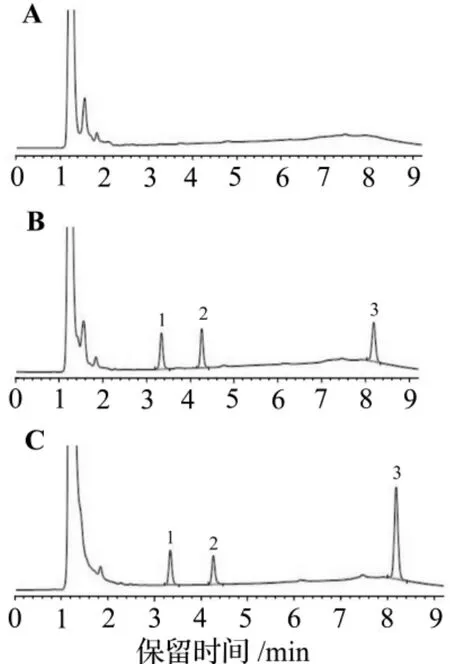
图1 甲氧滴滴涕(MXC)及其代谢产物2,2-二(4-羟基苯基)-1,1,1-三氯乙烷(HPTE)在大鼠血浆中的高效液相色谱分离图.A:空白血浆;B:空白血浆加MXC,HPTE对照品和内标氯硝西泮;C:血浆样品.峰1:氯硝西泮;峰2:HPTE;峰3:MXC.Fig.1 HPLC chromatograms of methoxychlor(MXC)and its metabolite 2,2-bis-(p-hydroxyphenyl)-1,1,1-trichloroethane(HPTE)in plasma of rats.
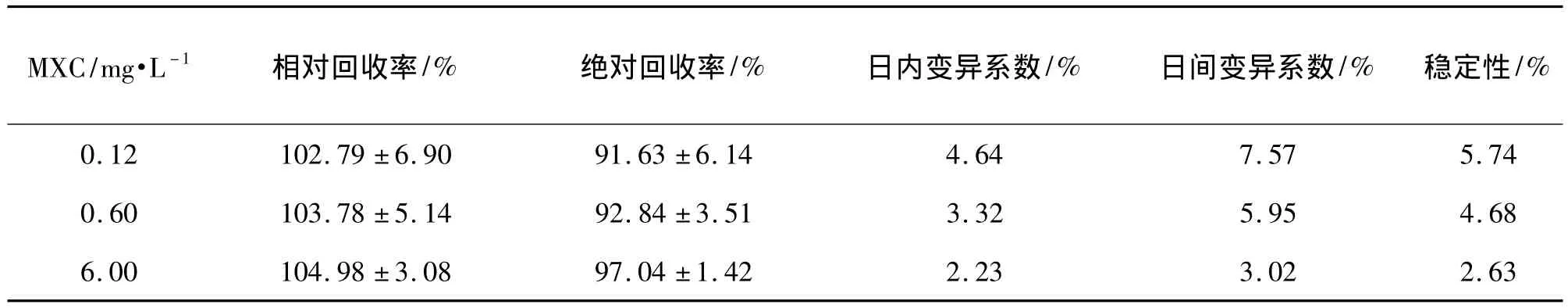
表1 MXC在血浆中的回收率、精密度和稳定性Tab.1 Recovery,precision and stability of MXC in plasma of rats
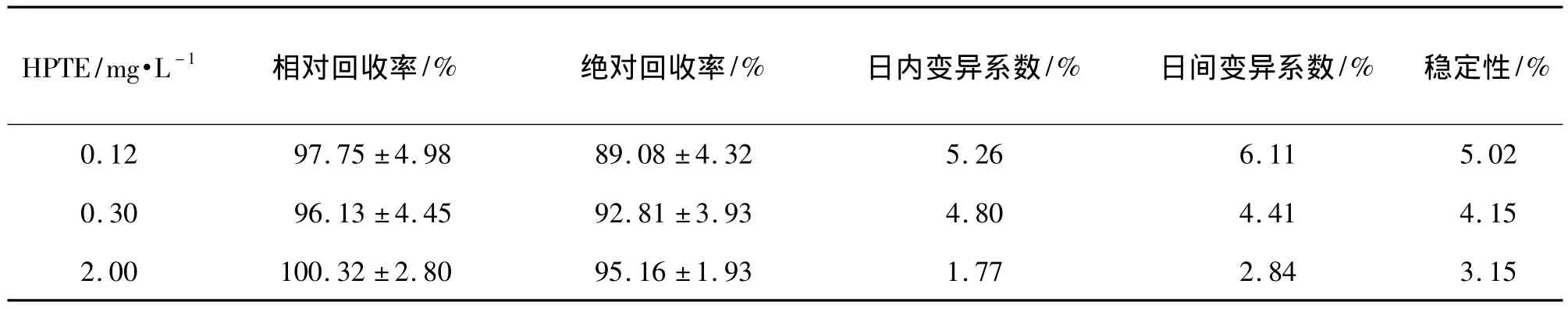
表2 HPTE在血浆中的回收率、精密度和稳定性Tab.2 Recovery,precision and stability of HPTE in plasma of rats
由表1和表2所示,MXC 0.12,0.6和6 mg·L-1和HPTE 0.12,0.3和2 mg·L-1血浆标准品的回收率均大于85%,精密度均小于10%。MXC 0.12,0.6和6 mg·L-1和HPTE 0.12,0.3和2 mg·L-1血浆标准品室温放置0,3,6,12 h和-65℃冰冻保存1,2和4周后考察稳定性,MXC和HPTE三个浓度的变异系数均小于10%;反复冻融3次后,MXC三个浓度的变异系数均<6.23%,HPTE三个浓度的变异系数均<5.34%。方法学验证结果符合生物样品分析指导原则的要求。方法具有较高的专属性。
2.2 MXC及其代谢产物HPTE毒动学
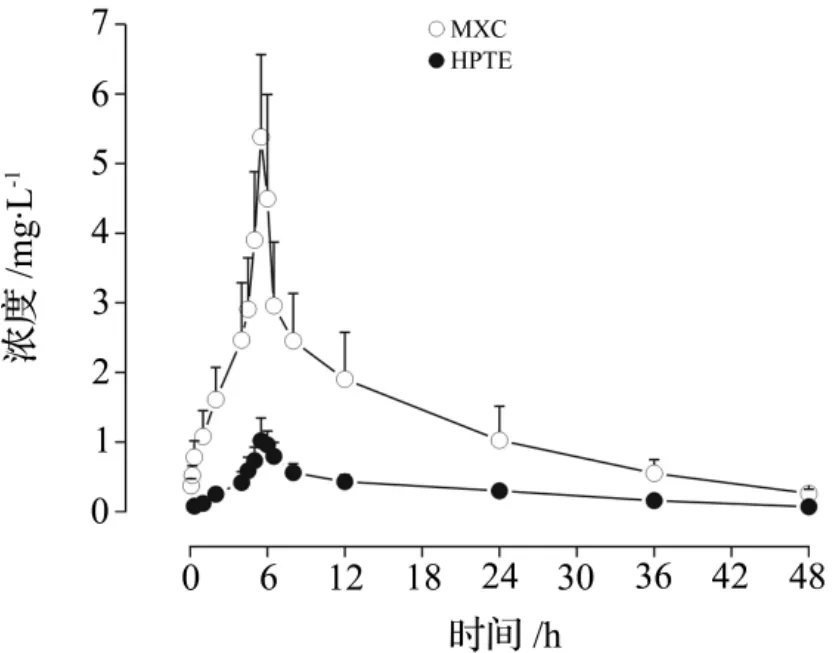
图2 MXC和HPTE的平均血浆浓度-时间曲线.大鼠一次性ig染毒MXC 500 mg·kg-1.分别于染毒前和染毒后5,10,20 min,1,2,4,4.5,5,5.5,6,6.5,8,12,24,36和48 h尾静脉取血.高效液相色谱法测定血药浓度.±s,n=8.Fig.2 Concentration-time curves of MXC and HPTE in plasma after MXC 500 mg·kg-1was ig given in rats.
大鼠ig给予MXC染毒后,MXC及其代谢产物HPTE的浓度-时间曲线如图2所示;经DAS2.0程序自动拟合,MXC与HPTE的毒动力学均符合二室模型,计算求得主要毒动学参数(表3)。MXC吸收及消除较慢,达到血浆最大浓度(cmax)5.52 mg·L-1需5.63 h,消除半衰期(t1/2β)长达(22.54±6.31)h;同时表观分布容积(V)较大,为(66.16±20.21)L·kg-1,说明MXC在血管外组织有广泛分布。HPTE的cmax显著低于原型药物MXC,但达峰时间与MXC相近,为(5.81±0.46)h,t1/2β也较MXC长,为(31.12±10.91)h;HPTE的V高达(232.55±36.44)L·kg-1,提示其体内分布很广,甚至有特异性组织分布的可能。
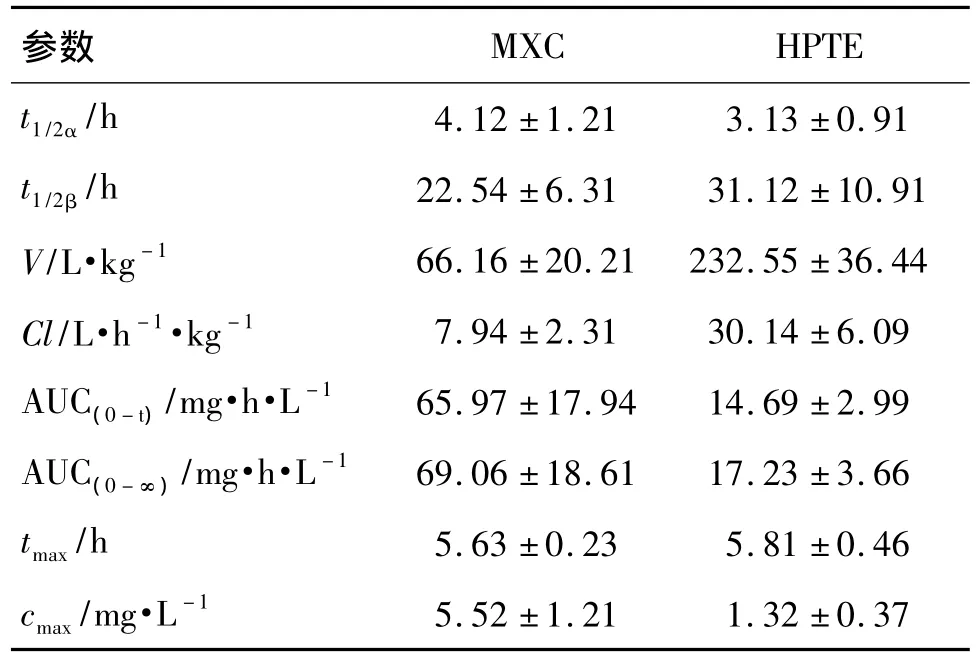
表3 MXC和HPTE的主要毒动学参数Tab.3 Toxicokinetic parameters of MXC and HPTE
3 讨论
目前已报道的MXC的检测方法主要为气相色谱法[5]和气质联用法[6]等,其灵敏度高且能同时分辨多种农药,但仪器和试剂的成本也大,样品的前期处理复杂,对实验条件的要求较高。因此本研究建立HPLC检测法,以乙腈-水作为流动相,采用梯度洗脱来缩短MXC与HPTE两者过长的保留时间差,使MXC与HPTE的保留时间分别提前至8.19和4.26 min,并能与内标氯硝西泮很好地分离。血样预处理方法在不影响MXC和HPTE正常出峰,以及定量下限满足要求的前提下,选择更为省时易行的有机溶剂乙腈沉淀法。建立的方法经济、快速简便,灵敏准确,可用于同时检测血浆样品中MXC及其代谢物HPTE的浓度及进行整体动物的毒动学的研究。
MXC为低毒类农药,临床未见有急性中毒的报道。但有文献报道,羊口服放射标记的MXC 72 h后,其肾上腺,脑,肾,心,肝等部位仍有少量MXC存在[7]。本研究中大鼠ig给予MXC 500 mg·kg-1后,t1/2β长达22.54 h,表明单次染毒后MXC在血浆消除较慢,且MXC全身分布较广,多次染毒后有可能在体内造成蓄积,有必要研究多次染毒后由蓄积引起的慢性毒性作用。
有研究表明,兔ig给予MXC 200 mg·kg-1后,MXC的cmax为3.6 mg·L-1[8],t1/2β为15.12 h,虽比大鼠的t1/2β短,也说明MXC在兔体内的消除较慢。值得关注的是,MXC在兔体内的血浆浓度-时间曲线出现双峰现象,分为0.083~4 h和4~24 h两个时间段[8],呈现出与大鼠较大的种属差别,这可能与兔这类食草动物有其独特的消化吸收过程有关。
体外实验研究结果表明,HPTE对大鼠3β-羟基类固醇脱氢酶和17β-羟基类固醇脱氢酶(参与雄激素生物合成的酶)的抑制作用均为MXC的3倍以上[9]。本研究中,大鼠ig染毒MXC后20 min就能检到代谢产物HPTE,于5.81 h左右达cmax,与原药MXC的tmax非常相近,说明在体内,MXC能较快代谢为HPTE。HPTE的cmax为1.32 mg·L-1,约为MXC的1/4,参照之前文献[9]的报道,提示MXC进入体内后的毒性,很大一部分是通过代谢为HPTE而发挥的;并且总体上来说,HPTE与MXC的浓度比值,有随着时间增加而变大的趋势,如1 h时约为1/6,5 h时约为1/5,而48 h时则约为1/3,同时HPTE的t1/2β为31.12 h,较MXC的22.54 h更长,说明体内HPTE消除较MXC慢。因此,在研究MXC毒性时,HPTE所起的作用不容忽视。为了更好地了解MXC和HPTE的毒性及相互关系,有必要进一步研究二者在体内各组织的分布、毒性的差异及体内暴露浓度与毒性之间的关系。
[1]侯蕾,陈必良.甲氧滴滴涕的生殖毒性及研究进展[J].中国妇幼健康研究,2007,(5):415-418.
[2]Nyagode BA,James MO,Kleinow KM.Influence of dietary coexposure to benzo(a)pyrene on the biotransformation and distribution of14C-methoxychlor in the channel catfish(Ictalurus punctatus)[J].Toxicol Sci,2009,108(2):320-329.
[3]刘伏祥.甲氧滴滴涕的毒性作用及其机制研究进展[J].解剖学杂志,2007,30(3):373-375.
[4]Gupta RK,Aberdeen G,Babus JK,Albrecht ED,Flaws JA.Methoxychlor and its metabolites inhibit growth and induce atresia of baboon antral follicles[J].Toxicol Pathol,2007,35(5):649-656.
[5]夏俊鹏,吴飞,刘红亚.工作场所空气中甲氧滴滴涕的气相色谱测定方法研究[J].中国卫生检验杂志,2007,17(4):588-589,600.
[6]胡小钟,储晓刚,余建新,李晶,黄鑫,林雁飞,等.基质固相分散和气相色谱-质谱法测定浓缩苹果汁中22种有机氯农药和15种拟除虫菊酯农药的残留量[J].分析测试学报,2004,23(5):38-42,47.
[7]Agency for Toxic Substances and Disease Registry.Toxicological Profile for Methoxychlor[M/DL].[2010-05-15]∥http://www.atsdr.cds.gov/toxprofiles/tp.asp?id=778&tid/151
[8]周红宇,肖仲祥,张馨,王萍,胡国新.高效液相色谱法检测兔血浆中甲氧滴滴涕的浓度[J].温州医学院学报,2010,40(4):392-394.
[9]Hu GX,Zhao B,Chu Y,Li XH,Akingbemi BT,Zheng ZQ,et al.Effects of methoxychlor and 2,2-bis(p-hydroxyphenyl)-1,1,1-trichloroethane on3βhydroxysteroid dehydrogenase and 17β-hydroxysteroid dehydrogenase-3 activities in human and rat testes[J].Int J Androl,2010,33:1-7
Toxicokinetics of methoxychlor and its metabolite 2,2-bis-( p-hydroxyphenyl) -1,1,1-trichloroethane in rats
KAN Xin1,2,ZHANG Xiao-yun1,WANG Zhe1,DONG Jie1,WANG Meng-meng1,HU Guo-xin1
(1.Institute of Molecular Toxicology and Pharmacology,Pharmacy School,Wenzhou Medical College,Wenzhou325035,China;2.Pharmacy Department,Wenzhou Third People's Hospital,Wenzhou325000,China)
OBJECTIVETo explore toxicokinetics of methoxychlor(MXC)and its metabolite 2,2-bis-(p-hydroxyphenyl)-1,1,1-trichloroethane(HPTE)in rats.METHODSEight male SD rats were ig given MXC 500 mg·kg-1and plasma was collected at different time points before and after administration.MXC and HPTE concentrations in the plasma were determined by high performance liquid chromatography.The compartment model was fitted and toxicokinetic parameters were calculated by DAS 2.0 software.RESULTSThe toxicokinetic parameters of MXC were as follows:cmaxwas(5.52±1.21)mg·L-1;t1/2αwas(4.12±1.21)h;t1/2βwas(22.54±6.31)h;AUC(0-t)was(65.97±17.94)mg·h·L-1;AUC(0-∞)was(69.06±18.61)mg·h·L-1;Cl was(7.94±2.31)L·h-1·kg-1;and V was(66.16±20.21)L·kg-1.The toxicokinetic parameters of HPTE were as follows:cmaxwas(1.32±0.37)mg·L-1;t1/2αwas(3.13±0.91)h;t1/2βwas(31.12±10.91)h;AUC(0-t)was(14.69±2.99)mg·h·L-1;AUC(0-∞)was(17.23±3.66)mg·h·L-1;Cl was(30.14±6.09)L·h-1·kg-1;and V was(232.55±36.44)L·kg-1.CONCLUSIONThe toxicokinetic profiles of MXC and HPTE in rats are both fitted to two-compartment model.MXC and HPTE may be accumulated easily due to their longer half-life clearance time.
methoxychlor;2,2-bis-(p-hydroxyphenyl)-1,1,1-trichloroethane;toxicokinetics
The project supported by the Key Foster Program in Medicine of Zhejiang Province(07F-04);and by National Natural Science Foundation of China(81102092)
HU Guo-xin,E-mail:wzhhgx@yahoo.com.cn,Tel:13506660881
R99
A
1000-3002(2011)05-0474-05
10.3867/j.issn.1000-3002.2011.05.011
浙江省医学扶植重点建设学科计划(07F-04);国家自然青年科学基金项目(81102092)
阚歆(1984-),女,硕士研究生,主要从事临床药理学与毒理学研究。胡国新(1957-),男,教授,主要从事临床药理学与毒理学研究。
胡国新,E-mail:wzhhgx@yahoo.com.cn,Tel:13506660881
2010-08-26接受日期:2010-12-20)
(本文编辑:付良青)

