1株纤维素降解菌的筛选及产酶条件研究
孟建宇,冯福应,刘向红,郭思文
(内蒙古农业大学生命科学学院应用与环境微生物实验所,内蒙古呼和浩特 010018)
纤维素是地球上分布最广的碳水化合物,同时又是自然界中数量最大的可再生资源[1]。我国农作物秸秆和纤维素废弃物年产量逾6亿t[2],然而由于难以大量被动物分解利用,大部分以堆积、荒烧等形式直接倾入环境,造成极大的污染和浪费。利用微生物降解纤维素因具有经济、有效、节约等优点而成为当今有效地开发利用纤维素资源的热门课题[3-4]。大规模纤维素生物转化工艺的发展,将有效解决或减轻食品和动物饲料的不足、废弃物处理、矿石燃料依赖性等一系列问题[5]。自然界中能够降解纤维素的微生物很多[6],但研究较多的主要是丝状真菌和细菌。而放线菌可耐高温和各种酸碱度,目前许多研究者正致力于放线菌产纤维素酶的研究[7]。近些年关于产纤维素酶菌株的筛选研究很多,但真正高产量的菌株并不多见,纤维素酶的生产依然是低产量高成本的状态[8],进一步选育高产纤维素酶菌株的研究亟待进一步开展。本文从常年堆积秸秆的土壤中筛选到1株高纤维素酶活的纤维素降解菌并对其产酶条件进行了初步研究,为纤维素资源的有效降解和合理利用提供一些基础资料。
1 材料与方法
1.1 材料
1.1.1 样品 采集自呼和浩特市郊区有腐烂秸秆堆积物的土壤。
1.1.2 培养基 羧甲基纤维素钠(CMC-Na)培养基:CMC-Na 15 g,KH2PO41 g,NH4NO31 g,MgSO4·7H2O 0.5 g,酵母膏1 g,(琼脂粉15 g,固体培养基用),H2O 1 000 mL;纤维素刚果红培养基[9]:KH2PO40.5 g,MgSO40.25 g,微晶纤维素1.88 g,明胶2 g,琼脂15 g,样品浸液100 mL,H2O 900 mL,pH 7.0;赫奇逊培养基:KH2PO41 g,MgSO4·7H2O 0.3 g,CaCl20.1 g,NaCl 0.1 g,FeCl30.01 g,NaNO32.5 g,H2O 1 000 mL,pH 7.0。
1.2 方法
1.2.1 菌株的分离与筛选 将样品溶于无菌水中,系列稀释,涂布于纤维素刚果红培养基上,30℃培养,菌落呈红色并且能在周围形成透明水解圈的菌株即能产纤维素酶的菌株。挑选生长快、红色浓郁且水解圈大的菌落分别接种于含处理的滤纸条[9]的赫奇逊培养基中,30℃,140 r/min培养5 d。挑选将滤纸条分解断裂快的培养物在纤维素琼脂培养基上涂板、划线,反复筛选纯化菌株。将产纤维素酶的菌株划线分离纯化,接种至以CMC-Na为唯一碳源的液体培养基中摇床发酵,测定各菌株的纤维素酶活进行复筛。
1.2.2 菌株的鉴定 ①形态和生理生化特征:菌株的生理和生化特征实验测定方法及初步的鉴定见《链霉菌鉴定手册》[10];②16S rRNA序列分析:提取细菌总DNA[11],用凝胶回收试剂盒(北京中科瑞泰)进行纯化。选用细菌通用引物对63F(5′-CAGGCCTAACACATGCAAGTC-3′)和1387R[12](5′-GGGCGGTG(A/T)GTACAAGGC-3′)进行PCR扩增。引物由上海生工生物工程技术服务有限公司合成。反应体系:1μL DNA模板(约50 ng/μL),0.1μL r-Taq酶,2μL 10×Buffer,1.6 μL dNTP(20 mmol/L),引物(20μmol/μL)各0.2 μL,Mg2+终浓度为1.5 mmol/L,补水使总体积至20μL。反应程序:94℃预变性3 min,然后进入以下循环:94℃45 s,55℃30 s,72℃1.5 min,30个循环后72℃延伸5 min。16S rDNA PCR产物经胶回收,纯化产物与pMD19-T(大连宝生物)载体16℃过夜连接,转化E.coliDH5α。转化细胞涂布于含50μg/mL氨苄青霉素的LB平板上,37℃培养16 h。挑取阳性克隆子,用M13(M13+5′-CGCCAGGGTTTTCCCAGTCACGAC-3′、M13-5′-GAGCGGATAACAATTTCACACAGG-3′)引物进行菌落PCR扩增重组质粒检测,将阳性克隆扩培后由北京华大基因有限公司测序。测序结果在GenBank中进行同源性比较,用DNA Star软件的ClustalW法进行相似性比较分析,用Mega3.1的邻接法构建进化树[13]。
1.2.3 粗酶液的制备 在CMC固体培养基上活化菌种,挑取单菌落于CMC液体培养基中30℃,140 r/min振荡摇床培养,培养液于4℃下,5 000 r/min离心30 min,上清液即为粗酶液。加入硫酸铵至70%的饱和度,4℃静置过夜,离心(10 000 r/min,4℃,15 min),收集沉淀,所得沉淀用适量50 mmol/L CMC缓冲液(pH 4.4)溶解后,在相同缓冲液中4℃透析16 h,然后在10 000 r/min,4℃下离心15 min,取上清液待用。
1.2.4 纤维素酶活的测定 本实验采用DNS法[14]对纤维素酶活进行测定。将过滤后的酶液稀释5倍,吸取0.1 mL加入试管,加CMC缓冲液(50 mmol/L,pH 4.4)0.3 mL混匀。放入50℃恒温水浴中糖化30 min,取出后加入DNS试剂0.3 mL,沸水浴中煮沸5 min,在冷水中冷却,用蒸馏水定容至5 mL,在540 nm处比色。酶活定义:在pH 4.4,50℃下,每1 mL酶液在1 min内水解CMC-Na生成1μg葡萄糖的酶活性为1个纤维素酶活力(CMC酶活)单位(U)。酶活的计算:
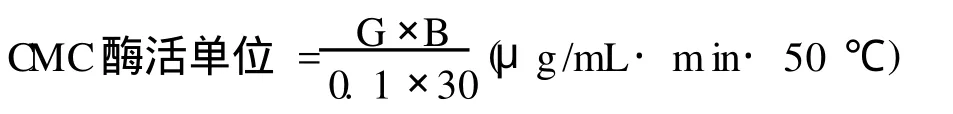
其中,G:样品中葡萄糖含量(μg);B:酶液稀释倍数;0.1:吸取酶液的数量(mL);30为糖化时间(min)。
1.2.5 不同氮源对酶活性的影响 在CMC-Na液体培养基中分别以蛋白胨、硝酸钾、硫酸铵、硝酸铵作为唯一氮源,将L006菌接种于不同氮源培养基中,30℃、140 r/min摇床培养提取粗酶液,按照1.2.4的方法每隔24 h测定酶活性。每组作3个重复。
1.2.6 不同碳源对酶活性的影响 在CMC-Na液体培养基中分别以滤纸、秸秆和CMC-Na作为唯一碳源,将L006菌接种于不同碳源培养基中,30℃、140 r/min摇床培养提取粗酶液,按照
1.2.4 的方法每隔24 h测定酶活性。每组作3个重复。
1.2.7 不同pH对酶活性的影响 用1 mol/L的HCl或NaOH溶液调节培养基的pH值分别为6.5、7.0、7.5,接种L006菌株培养并测定酶活性。每组作3个重复。
2 结果与分析
2.1 纤维素降解菌的筛选与鉴定
通过反复初筛和复筛,最终获得1株分解纤维素能力较强的优良菌株L006。菌落圆形,有凸起,白色,干燥,边缘整齐,中间略带粉色。孢子圆形白色,G+。能使明胶液化,淀粉水解,牛奶胨化,可以利用葡萄糖、果糖、阿拉伯糖、乳糖等。根据16S rRNA序列比较推测细菌间进化关系,构建进化树(图1),进而对未知菌株进行鉴定。发现L006菌株与Actinobacterium220215.seq有97.8%的同源性,与Streptom yces的3个比对菌株都有97.9%的同源性(图2),初步确定其属于链霉菌属。
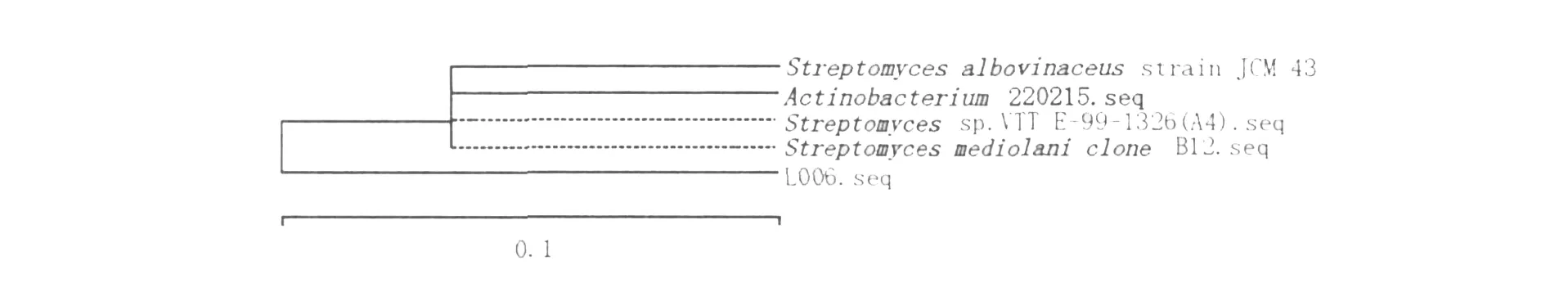
图1 菌株L006的系统进化树Fig.1 Phylogenetic tree of strain L006
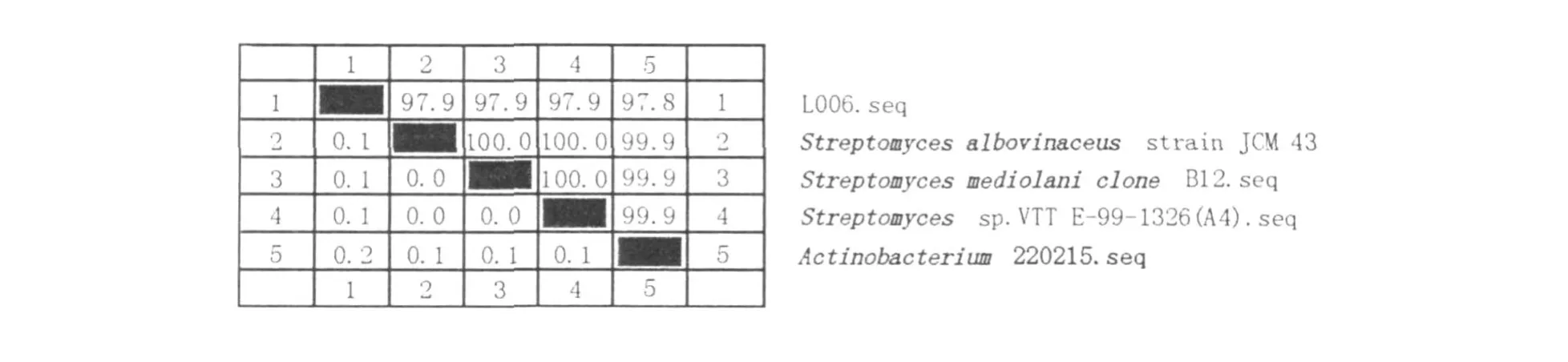
图2 L006菌株与4种比对菌的16S rRNA基因的相似性Fig.2 Similarity of 16S rRNA between L006 and 4 relative species
2.2 生长曲线
将菌种接种到以CMC-Na为碳源的培养基中进行培养,绘制生长曲线(图3)。由图3可见,从24 h开始,菌体的生长开始进入对数期,其OD值为0.757,到60 h时,OD值达到峰值,为1.208。在36~84 h内,菌体繁殖速度快,代谢旺盛,在此期间进行接种和酶活的测定较为理想。从96 h后,由于代谢物的积累和培养基营养物质的缺乏,菌体的生长进入衰退期,生长速率下降。
2.3 不同氮源、碳源对纤维素降解菌产酶的影响
不同碳、氮源对纤维素降解菌产酶的影响较大。在24~96 h内,生长在不同碳、氮源组合的培养基中菌株的酶活性均呈上升趋势,在96 h达到最高峰,96 h后,酶活性均开始下降。当碳源为滤纸(图4)和CMC-Na(图5)时,以蛋白胨为氮源时产酶最佳,酶活性最大值分别为47.9 U/mL和41.5 U/mL,而以硝酸钾为氮源时仅为27.2 U/mL和28.5 U/mL。当碳源为秸秆(图6)时,产酶效果最佳,酶活性远远超过其他碳源的情况。其中仍以蛋白胨为氮源时产酶最好,96 h最高酶活为220.6 U/mL。综合来看,以蛋白胨为氮源、以秸秆为碳源是产酶的最佳条件组合。
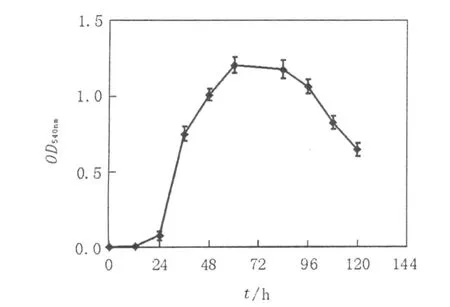
图3 L006的生长曲线Fig.3 The growing curve ofL006

图4 碳源为滤纸时,不同氮源对L006产酶的影响Fig.4 Effects of different nitrogen source on production of cellulase by strain L006 when carbon source was filter paper
2.4 pH对纤维素降解菌产酶的影响
将以蛋白胨为氮源和以秸秆为碳源的培养基pH值调整为6.5、7.0、7.5,找到较适合的pH值,从而综合碳源、氮源和pH值3个因素,找到最适合的产酶条件。从图7可以看出,在培养24 h后菌体在3个pH下的酶活力基本相同。在24~48 h内,pH 6.5和pH 7.5的培养基中菌体生长较为缓慢,酶活变化不明显,而生长在pH 7.0的培养基中的菌体生长较旺盛,酶活值上升趋势较为明显,在48 h时,达到最大值220.1 U/mL。48 h后,pH 7.0的酶活开始下降,而pH 6.5和pH 7.5的酶活呈平稳的上升趋势,在72 h时,pH 7.5的酶活达到最大,最大值为209.1 U/mL。72 h后,pH 7.5酶活力开始下降,而pH 6.5酶活力仍在增长,在96 h时,达到最大值为210.3 U/mL。
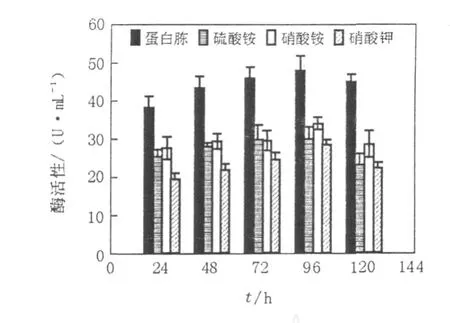
图5 碳源为CMC-Na时,不同氮源对L006产酶的影响Fig.5 Effects of different nitrogen source on production of cellulase by strain L006 when carbon source was CMC-Na

图6 碳源为秸秆时,不同氮源对L006产酶的影响Fig.6 Effects of different nitrogen source on production of cellulase by strain L006 when carbon source was straw
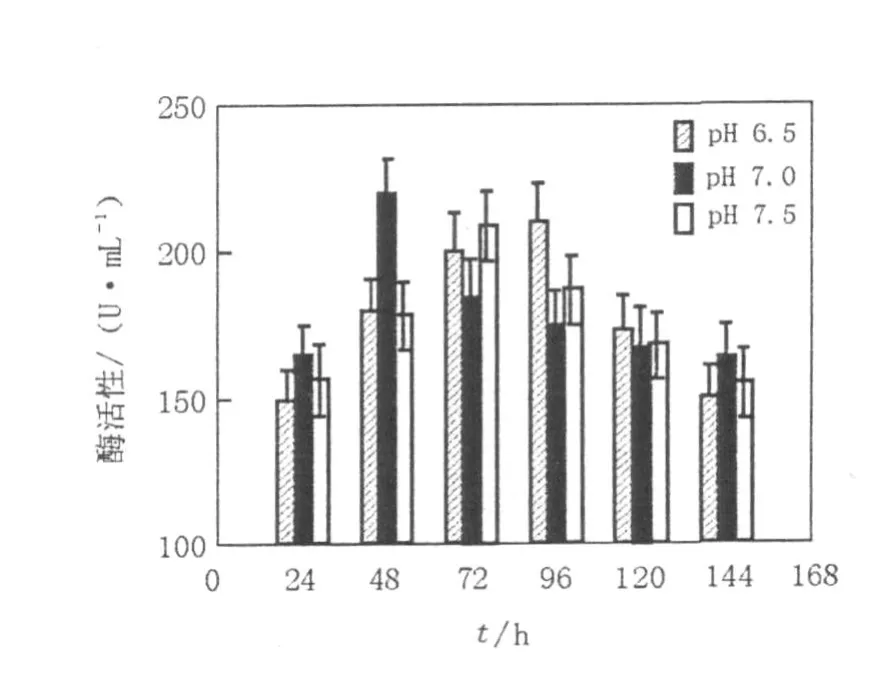
图7 pH值对L006产酶的影响Fig.7 Effects of initial pH on production of cellulase by strain L006
3 讨 论
碳源是微生物生长繁殖所必需的营养物,微生物细胞含碳量约占干重50%,故除水分外,碳源是需要量最大的营养物。氮是组成蛋白质和核酸的主要元素。酶的本质是蛋白质,微生物的生长代谢也离不开氮源。虽然氮源并不作为诱导纤维素酶的诱导物,但对菌体的迅速增长有很重要的作用。设计不同的碳、氮源的培养基培养纤维素降解菌L006,发现以秸秆为碳源、以蛋白胨为氮源的培养基是最佳碳、氮源组合的培养基。在96 h,酶活最大,为220.6 U/mL。碳源中,秸秆为L006菌株最佳碳源,滤纸和CMC-Na次之;氮源中,蛋白胨为最佳,铵态氮和硝态氮次之,铵态氮优于硝态氮。pH值对菌体的生长和产酶也有着巨大的影响。以秸秆为碳源、以蛋白胨为氮源的培养基培养L006菌株,当初始pH=7.0时,产酶最佳,在48 h,其酶活达到最大值220.1 U/mL。
纤维素酶作为一种多组分酶系[2,7],不同生产菌种所产的纤维素酶的作用效果也同样受到温度、酶解时间、酶用量和酶解底物浓度等因素的影响。因此,应综合考虑后确定产酶条件。
[1] 钱林,郑巧利,付瑾,等.1株高效纤维素降解菌株的分离鉴定及其酶学性质[J].微生物学通报,2010,37(4):524-528.
[2] 彭晓光,杨林娥,张磊.生物法降解秸秆木质素研究进展[J].现代农业科技,2010,(1):18-20.
[3] Hill J,Nelson E,Tilman D,et al.Environmental,economic and energetic costs and benefits of biodiesel and ethanol biofuels[J].Proc Natl Acad Sci USA,2006,103(30):11206-11210.
[4] ZengX,Ma Y,Ma L.Utilization of straw in biomass energy in China[J].Renewable and Sustainable Energy Reviews,2007,11(5):976-987.
[5] Adsul MG,Bastawde KB,Varma AJ,et al.Strain improvement of Penicillium janthinellumNC IM1171 for increased cellulase production[J].Bioresource Technology,2007,98(7):1467-1473.
[6] Baldrian P,Valá ŠkováV.Degradation of cellulose bybasidio mycetous fungi[J].FEMSMicrobiology Reviews,2008,32(3):501-521.
[7] 巫小丹,徐尔尼,罗玉芬.微生物法高效综合利用植物秸秆新技术的研究进展[J].作物杂志,2009,(4):9-12.
[8] 王士强,顾春梅,赵海红.木质纤维素生物降解机理及其降解菌筛选方法研究进展[J].华北农学报,2010,25(增刊):313-317.
[9] 高春,孟建宇,冯福应.纤维素降解菌的分离筛选及其酶活研究[J].畜牧与饲料科学,2008,29(4):17-20.
[10] 中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975:13-15.
[11] 奥斯伯F,布伦特R,金斯顿RE,等.精编分子生物学实验指南[M].北京:科学技术出版社,2005:39-40.
[12] MarchesiJR.Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J].Applied and Environmental Microbiology,1998,64(2):795-799.
[13] Kumar S,Tamura K,NeiM.MEGA3:Integrated software or molecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics,2004(5):150-163.
[14] 卢月霞,陈凯.纤维素降解菌的筛选及相互作用分析[J].安徽农业科学,2007,35(1):11-17.

