沙眼衣原体血清型L2体外培养影响因素的研究
张军华,陈丽丽,李忠玉,吴移谋*
(1.南华大学病原生物学研究所,湖南衡阳 421001;2.中南大学湘雅三医院输血科,湖南长沙 410013)
沙眼衣原体(Chlam ydia trachom atis,Ct)是一种专性细胞内寄生,具有独特发育周期的原核型微生物,是目前国内外最常见的性病病原体,与人类疾病相关的有2个生物型,即沙眼生物型和性病淋巴肉芽肿生物型(lymphogranuloma venereum,LGV),LGV的血清型有L1、L2和L3,其中L2进一步被分为L2、L2a、L2b和L2′亚型[1]。LGV引起性病淋巴肉芽肿,又称腹股沟淋巴肉芽肿(Lyphogranuloma inguinale)、第四性病,俗称“鱼口”或者“便毒”。自从2003年荷兰男男性行为人群(men who have sex with men,MS M)中暴发流行LGV以后,相继有许多文献报道欧洲、北美和澳洲出现大量LGV病例,这些病例大多数由血清型LGV L2感染所致[1-4]。血清型LGV L2侵袭力较其他型强,需更长疗程的治疗才能清除病原体和阻止晚期严重后遗症的发生[5]。文献报道,LGV的溃疡损害与艾滋病病毒(Human immunodeficiency virus,H IV)的感染和传播密切相关[6-7],因此,LGV近年来越来越受到广泛的重视。LGV的临床表现缺乏特异性,确诊依赖实验室诊断。但目前尚没有商品化的试剂可以诊断LGV,而病原体的分离培养认为是诊断感染性疾病的“金标准”方法。因此,优化Ct血清型LGV L2的培养条件和比较其在不同细胞中的发育,将对Ct血清型LGV L2相关实验研究及其感染的临床诊断有较重要意义。研究表明Ct血清型LGV L2主要在人和非人类的上皮细胞和成纤维细胞中生存和发育,且其生长情况受细胞类型和培养环境影响[8-12]。本实验选取HeLa、HEp-2、Vero 3种上皮细胞和HepG-2和SGC-7901 2种类上皮样生长细胞培养血清型LGV L2,采用间接免疫荧光法和Real-Time PCR法检测血清型LGV L2在上述5种细胞内的生长情况,并通过设置放线菌酮组和二乙氨基葡聚糖(DEAE-dextran)处理组和不处理组,比较不同培养条件下血清型LGV L2在各细胞内的生长情况,确定LGV L2血清型在体外培养的最佳生长发育条件,为临床标本中血清型LGV L2的分离培养和进一步研究血清型LGV L2的相关实验奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞株 沙眼衣原体血清型LGV L2由南华大学病原生物学研究所保存;HEp-2细胞(人喉癌上皮细胞)、Vero细胞(非洲绿猴肾上皮细胞)、HepG-2细胞(人肝癌细胞)、HeLa细胞(人宫颈癌细胞)和SGC-7901(人胃癌细胞)均由南华大学病原生物学研究所保存。
1.1.2 主要仪器及试剂 细胞培养箱(Sanyo公司);生物安全柜(Haier公司);荧光显微镜(日本Olympus公司)和倒置显微镜(日本Nikon公司);兔抗衣原体属多克隆抗体(D395)由本实验室制备并保存,羊抗兔Cy2抗体购于Sigma公司;放线菌酮、庆大霉素和链霉素购自Sigma公司;Ct核酸定量检测试剂盒购自达安基因诊断公司。
1.1.3 培养基 DMEM培养基、胎牛血清购自Gibco公司,SPG转运培养基参考《分子克隆实验指南》第3版附录部分配制。
1.2 方法
1.2.1 Ct血清型LGV L2体外培养 按照常规方法制备HEp-2细胞单层,弃培养液,用HBSS液洗2次,加入含有终浓度为30μg/mL DEAE葡聚糖的DMEM培养基,37℃温箱孵育10 min;用HBSS液洗2次;将冻存于-70℃的Ct血清型LGV L2标准株在37℃水浴箱1 min内复苏,用SPG稀释后,接种到单层细胞上,每孔200μL,置于37℃温箱孵育,每隔30 min轻轻摇晃1次,孵育2 h后弃去孔内液体,加入含有10%FBS的DMEM完全培养液,置于37℃、5%CO2恒温培养箱中培养,观察被感染细胞和血清型LGV L2包涵体形态的变化。
1.2.2 Ct血清型LGV L2在不同细胞内的生长情况 按常规方法复苏培养HeLa、HEp-2、Vero、HepG-2和SGC-7901细胞于24孔板中,待细胞形成80%左右的单层细胞,按前述方法接种感染复数(multiplicity of infection,MO I)为0.5的Ct血清型LGV L2,于37℃、5%CO2恒温培养箱中分别孵育12、24、36和48 h后,进行间接免疫荧光抗体染色,荧光显微镜下观察包涵体形态,在高倍镜(40×)下随机计数10个视野中IFU总数,取平均数,即为每个视野中的IFU数量;同时采用Real-Time PCR法定量检测血清型LGV L2核酸量。
1.2.3 放线菌酮对血清型LGV L2生长发育的影响 将上述每种单层细胞分为A、B 2组,每种细胞每组12孔。分别感染MO I为0.5的Ct血清型LGV L2,A组细胞用含2μg/mL放线菌酮的DMEM完全培养基培养;B组用不含放线菌酮的DMEM完全培养基培养,于感染后12、24、36和48 h,进行荧光抗体染色,观察包涵体形态,同时采用Real-Time PCR法检测各孔血清型LGV L2核酸量,重复3次。
1.2.4 DEAE葡聚糖对Ct血清型LGV L2感染率的影响 制备上述每种单层细胞分为A、B 2组,每组3孔,A组各单层细胞用HBSS洗涤2次后,分别用含30μg/mL DEAE葡聚糖的无血清DMEM预处理10 min;B组单层细胞同步经HBBS洗涤后用无血清DMEM培养基预处理10 min,然后A、B 2组各单层细胞均用HBSS洗2次,接种MO I为0.5的Ct血清型LGV L2,置于37℃,5%CO2恒温培养箱内孵育36 h,高倍镜下随机计数10个视野中IFU总数,计算每个视野中的IFU数量,同时测定各孔细胞中的血清型LGV L2核酸量。
1.2.5 荧光抗体染色 收集待染色标本,依次用4%多聚甲醛和0.5%的Triton X-100固定和打孔,PBS洗2次后,用含2%牛血清白蛋白的封闭液于4℃孵育过夜,弃封闭液后加入一抗(兔抗衣原体多抗D395)稀释液,于4℃孵育过夜,用PBS洗3次后加入经稀释后的二抗(羊抗兔Cy2),37℃避光孵育1 h,PBS洗涤3次后吹干;用镊子夹出盖玻片,倒扣于滴有8μL左右防荧光淬灭剂的载玻片上,荧光倒置显微镜下观察结果并摄像。
1.2.6 Real-Time PCR检测血清型LGV L2核酸量 Ct核酸定量检测试剂盒(PCR荧光探针法)按照操作说明配好反应体系后,将Real-T ime PCR反应条件反应管置于Agilent Technologies Stratagene Max3000自动荧光检测仪进行反应并分析结果。
2 结果与分析
2.1 Ct血清型LGV L2体外培养

图1 L2感染HEp-2细胞形态变化(200×)Fig.1 Morphologic change of HEp-2 afterL2 infection(200×)

图2 Ct血清型L2包涵体(1 000×)Fig.2 Inclusion bodies ofL2 in HEp-2 cells(1 000×)
将血清型LGV L2接种于HEp-2单层细胞,培养20 h后即可在光学显微镜下观察到细胞形态出现明显变化,未感染细胞呈梭形或多边形(图1A);而感染细胞肿胀,折光性差,感染40 h后,细胞内可见较大包涵体,如箭头所示(图1B)。荧光抗体染色可见明显包涵体(图2)。
2.2 Ct血清型LGV L2在不同细胞内的生长情况
血清型LGV L2分别感染HeLa、HEp-2、Vero、HepG-2和SGC-7901细胞,培养12 h后荧光显微镜下各细胞株内可见绿色荧光小体;培养24 h后,发现各细胞株内血清型LGV L2包涵体均增大,但大小有明显差异;孵育36 h后,HeLa细胞内部分包涵体破裂,其他各细胞株内血清型LGV L2包涵体不同程度增大;孵育至48 h,SGC-7901和HeLa细胞中包涵体基本完全破裂,其他3种细胞内均可见散在荧光小体,说明包涵体裂解释放部分原体(图3)。采用Real-Time PCR定量检测孵育12、24、36和48 h后血清型LGV L2的核酸量,结果显示HeLa细胞感染率最高,SGC-7901和HEp-2细胞次之,Vero细胞和HepG-2细胞感染率最低(图4)。血清型LGV L2感染30 h后,分别计数5种细胞内包涵体数量(表1),采用单因素方差分析比较5种细胞内总体IFU均值差异,F=334 252.515,P<0.001,具有统计学意义,每2种细胞内IFU均数差异采用独立样本t检验分析,均有P<0.001,具有统计学意义,说明细胞类型影响血清型LGV L2的生长发育。
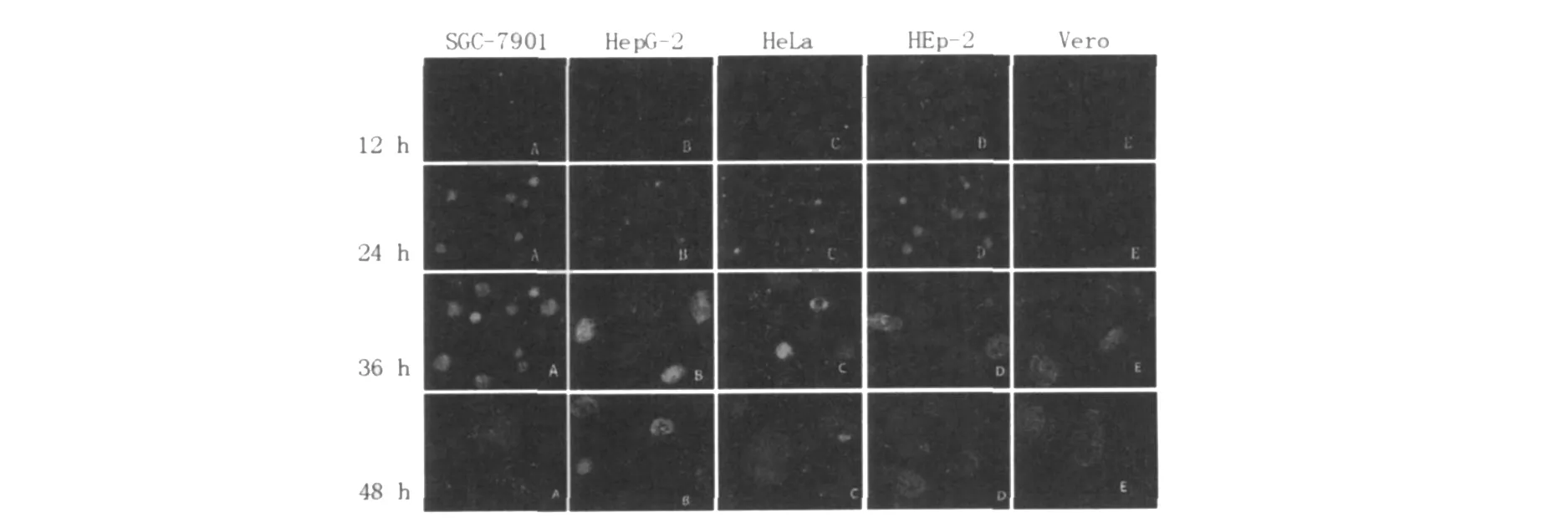
图3 L2在不同细胞中的发育情况(1 000×)Fig.3 The development ofL2 in difference cell lines(1 000×)

图4 Real-T ime PCR检测各细胞内L2核酸量Fig.4 Quantity ofNucleic Acid ofL2 in different cells by Real-Time PCR

表1 感染30 h后5种细胞中血清型LGV L2包涵体数量Table 1 IFU ofLGV L2 in five cell lines after 30h post infection
HeLa组与HEp-2组比较t=1 075.915,P<0.01;与Vero组比较t=999.392,P<0.01;与SGC-7901组比较t=316.887,P<0.01;与HepG-2组比较t=1 266.466,P<0.01。HEp-2组与Vero组比较t=188.227,P<0.01;与SGC-7901组比较t=308.164,P<0.01;与HepG-2组比较t=301.287,P<0.01。Vero组与SGC-7901组比较t=382.571,P<0.01;与HepG-2组比较t=232.415,P<0.01。SGC-7901组与HepG-2组比较t=424.852,P<0.01。
2.3 放线菌酮对血清型LGV L2生长发育的影响
细胞感染血清型LGV L2后,分别用含放线菌酮的DMEM完全培养基和不含放线菌酮的DMEM完全培养基培养。间接免疫荧光染色发现,放线菌酮培养组各细胞内血清型LGV L2包涵体开始裂解时间较对照组早,如在Vero细胞中,放线菌酮组孵育36 h后有散在荧光小点(图5A),说明部分包涵体裂解,而对照组细胞内未见散在荧光小点(图5B)。Real-T ime PCR检测结果显示,含放线菌酮培养组各细胞内血清型LGV L2核酸量较对照组大(图6)。

图5 L2型感染Vero细胞36 h后荧光抗体染色Fig.5 Inclusions bodies ofL2 in Vero cells at 36 h post-infection

图6 Real-T ime PCR检测HeLa细胞内L2核酸量Fig.6 Quantity ofNucleic Acid ofL2 in HeLa cells by Real-Time PCR
2.4 DEAE葡聚糖对血清型LGV L2感染的影响
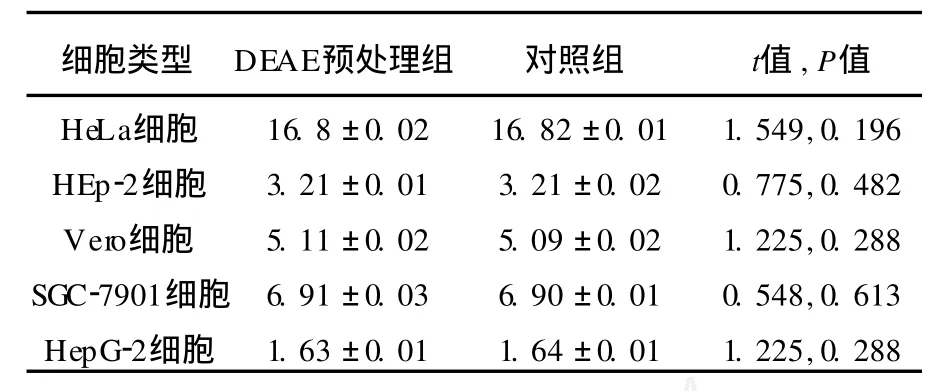
表2 不同处理组5种细胞内血清型LGV L2包涵体数量(IFU/视野)Table 2 IFU ofLGV L2 in five cell lines in different treated groups

图7 Real-T ime PCR检测5种细胞内L2核酸量Fig.7 Quantity ofNucleic Acid ofL2 in Five cell lines by Real-Time PCR
DEAE预处理组和对照组各细胞接种Ct血清型LGV L2,培养30 h后,间接荧光抗体染色,计数IFU,采用独立样本t检验比较IFU均值,发现2组各细胞内IFU没有明显差异(表2)。Real-T ime PCR检测培养12 h后各细胞内血清型LGV L2的核酸量,发现DEAE对血清型LGV L2的感染没有明显影响(图7)。
3 讨 论
人类是血清型LGV L2的唯一宿主,在体内主要感染上皮细胞和巨噬细胞。在体外培养时,血清型LGV L2可在鸡胚卵黄囊中增殖,也可感染人类与非人类的上皮细胞和成纤维细胞[12]。本实验选用了上皮细胞包括HeLa细胞、HEp-2细胞和Vero细胞,另外还选择了类上皮样生长的HepG-2细胞和SGC-7901细胞。用血清型LGV L2分别感染这5种细胞,间接免疫荧光染色结果显示,5种细胞均能感染血清型LGV L2。有文献报道血清型LGV L2完成周期的时间与其他衣原体不一样,其生长速度比其他沙眼衣原体快,感染后约18~24 h可见包涵体[12]。本实验在接种血清型LGV L2大约24 h后,各细胞内均可见到包涵体,与文献报道基本一致[9]。
不同细胞感染血清型LGV L2后,分别于培养12、24、36和48 h后进行间接免疫荧光抗体染色。结果显示,HeLa细胞在培养36 h后,细胞内部分包涵体裂解,48 h时包涵体基本完全裂解;SGC-7901细胞内包涵体在感染后约44~48 h裂解,HEp-2细胞中在48 h左右开始裂解,Vero细胞在48 h未见裂解现象,但是包涵体密度减小,而在HepG细胞内包涵体在48 h时仍较致密,说明血清型LGV L2的生长周期与细胞类型有一定的关系。通过Real-Time PCR定量检测血清型LGV L2核酸量,发现Hela细胞感染率最高,SCG-7901和HEp-2细胞次之,Vero细胞和HepG-2细胞感染率最低,采用单因素方差分析和t检验比较5种细胞内IFU,发现各细胞间有统计学意义,说明血清型LGV L2在感染过程中存在一定的细胞嗜性。
目前国内外在培养血清型LGV L2时,各实验室没有统一的方法。有些文献报道,在接种血清型LGV L2前需用DEAE葡聚糖对宿主细胞进行预处理,以抑制宿主细胞蛋白质的合成,从而优化衣原体的生长代谢环境,增加血清型LGV L2的感染率[12]。但有些文献明确指出,血清型LGV L2具有较强的侵袭性,在接种过程中,不需要采用化学方法和机械辅助增强感染率,在培养过程中也不需要添加放线菌酮[9]。为此本实验比较放线菌酮和DEAE葡聚糖对血清型LGV L2生长情况的影响。结果显示含放线菌酮培养组各细胞内包涵体开始裂解的时间比对照组早,如含放线菌酮培养组HeLa细胞中包涵体在36 h左右开始裂解,而对照组HeLa细胞内包涵体在约40 h才开始裂解;Real-Time PCR结果显示含放线菌酮培养组各细胞内血清型LGV L2核酸量较对照组多,说明放线菌酮可以促进血清型LGV L2的生长。而DEAE葡聚糖处理组与未处理组的各细胞内血清型LGV L2核酸量和IFU没有明显差异,说明DEAE葡聚糖对血清型LGV L2的生长没有明显影响,与Scidmore等[9]报道一致,说明血清型LGV L2较其他衣原体具有更强的侵袭力,无需机械设备或者化学试剂辅助,即可入侵细胞。本实验初步研究了HeLa等5种细胞对血清型LGV L2的敏感性及DEAE葡聚糖和放线菌酮对血清型LGV L2生长发育的影响,为临床标本中血清型LGV L2的分离培养和进一步研究血清型LGV L2的相关实验奠定了基础。
[1] Kapoor S.Reemergence of lymphogranuloma venereum[J].Eur Acad DermatolVenereol,2008,22(4):409-416.
[2] Richardson D,GoldmeierD.Lymphogranulom a venereum:an emerging cause of proctitis in men who have sexwith men[J].Int J STD A IDS,2007,18(1):11-14.
[3] Linus Christerson,Henry JC,de Vries,et al.Typing ofLymphogranuloma VenereumChlamydia trachomatisStrains[J].Emerg InfectDis,2010,16(11):1777-1779.
[4] Georg Stary,Thomas Meyer,Christine Bangert.New Chlamydia trachomatisL2 Strains Identified in a Recent Outbreak of Lymphogranuloma Venereum in Vienna[J].Sexually Trans mitted Diseases,2008,35(4):377-382.
[5] McLean CA,StonerBP,Workowski KA.Treatmentof lymphogranuloma venereum[J].Clin InfectDis,2007,44(Suppl 3):S147-152.
[6] Aral SO,OverM,ManhartL,et al.Sexually Trans mitted Infections-Disease Control Prioritiesin Developing Countries[M].2nd edition.Washington(DC):World Bank;2006,Chapter 17.
[7] Van de LaarMJ,Koedijk FD,Gotz HM,et al.A slow epidemic ofL GV in the Net herlands in 2004 and 2005[R].Euro Surveill,2006,11(9):150-152.
[8] Gordon FB.Quan AL.Isolation of the trachoma agent in cell culture[J].Proc Soc Exp BiolMed,1965,118:354-359.
[9] Scidmore MA.Cultivation and Laboratory Maintenance of Chlamydia trachomatis[M].Curr Protoc Microbiol,2005,Chapter 11:Unit 11A.1.
[10] MA Chernesky.The laboratory diagnosisofChlamydia trachomatisinfections[J].Can J Infect Dis Med Microbiol,2005,16(1):39-44.
[11] J Malathi,G Shyamala,HN Madhavan.Relative susceptibility of six continuous cell lines for cultivation ofChlamydia trachomatisstrains[J].Indian Journal of Medical Microbiology,2004,22(3):169-171.
[12] Miyairi I,MahdiOS,Ouellette SP,et al.Different growth rates ofChlamydia trachomatisbiovars reflect pathotype[J].J Infect Dis,2006,194(3):350-357.

