高产腈水解酶Alcaligenes faecalis UL44菌株的诱变筛选
徐建明,柳志强,徐建妙,张金峰,郑裕国
(浙江工业大学生物工程研究所,浙江杭州310014)
草甘膦是一种安全的灭生性除草剂,具有广谱、低毒和无残留的特点。随着转基因抗草甘膦作物的发展,全球草甘膦的使用面积正以每年20%的速度递增,成为具有典型代表性的农药产品[1]。我国草甘膦的生产工艺主要分为甘氨酸法[2-3]和二乙醇胺-亚氨基二乙酸(Iminodiacetic acid,简称IDA)法[4]。目前国际的主流路线则是IDA法,而亚氨基二乙酸的生产都是采用化学法生产,生产过程采用剧毒的氢氰酸,污染严重、成本高[5],利用微生物酶法生产亚氨基二乙酸具有反应条件温和,环境污染少等特点[6],但其面临的主要问题是腈水解酶酶活不高,需通过菌种改良的方法得到具有较高腈水解酶酶活的菌株。亚氨基二乙酸为白色结晶粉末或白色斜方晶体,无毒,是一种重要的化工中间体。其用途广泛,主要应用于合成农药草甘膦。IDA具有很强的络合能力,能和多种金属离子络合而形成螯合物,同时分子中又含有亚氨基和羧基,化学性质活泼应用广泛[7-8]。离子注入诱变微生物的应用是近些年来发展较快的一种辐射诱变技术[9],它和其他常规的辐射诱变及化学诱变有着明显的差异,其他辐射诱变仅仅是利用能量交换,化学诱变是利用分子基团的交换,而离子注入诱变集物理辐射诱变和化学诱变于一体,因此,离子注入诱变打破了传统诱变方法中多次诱变导致的负突变和抗性饱和。本研究对本实验室从土壤中筛选得到的腈水解酶产生菌Alcaligenes faecalis ZJB09133进行了紫外线和低能离子束诱变,最终选育得到4株可稳定遗传的正突变菌株,酶活最高的菌株UL44较原始菌株在腈水解酶酶活上提高了124.5%。
1 材料与方法
1.1 材料
1.1.1 菌株原始菌株为Alcaligenes faecalis ZJB09133,由本实验室从土壤中筛选得到。
1.1.2 培养基及培养条件①斜面培养基(g/L):酵母膏5,NaCl 10,蛋白胨10,琼脂20,pH 7.0,1×105Pa灭菌30 min,置于30℃,培养24 h;②诱变培养基(g/L):酵母膏5,NaCl 10,蛋白胨10,琼脂20,LiCl 5,pH 7.0,1×105Pa灭菌30 min,置于30℃,培养48 h;③种子培养基(g/L):醋酸铵7,甘露醇2.5,NaCl 1,酵母膏4,K2HPO45,MgSO40.2,pH 7.0,1×105Pa灭菌30 min,正丁腈0.3%(诱导剂,在接种时加入),温度为30℃,培养24 h;④发酵培养基(g/L):醋酸铵7,甘露醇2.5,NaCl 1,酵母膏4,K2HPO45,MgSO40.2,pH 7.0,1×105Pa灭菌30 min,正丁腈0.4%(诱导剂,在接种时加入),温度为30℃,培养38 h。
1.1.3 主要试剂和设备亚氨基二乙腈,亚氨基二乙酸,Alfa Aesar购得;酵母膏、蛋白胨、醋酸铵、磷酸氢二钾等均为市售分析纯;液相色谱仪LC-10AS,日本岛津;往复式水浴摇床ZHWY-110X30,上海智城分析仪器制造有限公司;IBBe-Device等离子注入仪,中国科学院等离子体物理研究所。
1.2 方法
1.2.1 紫外-氯化锂复合诱变诱变处理时先打开紫外灯,预热20 min,以稳定波长。吸取1 mL对数生长期的种子液,加入到装有9 mL无菌水的试管中,梯度稀释至一定浓度。吸取0.1 mL菌悬液均匀地涂布在LB培养基上,将培养皿放入紫外诱变箱中,打开培养皿盖,采用功率15 W紫外灯,照射距离30 cm,对菌悬液进行不同时间的诱变处理。将培养皿置30℃恒温箱避光培养2 d(诱变过程均应在无光或者红光下操作,以避免光复活现象的发生影响诱变效果)。进行菌落记数,按下式计算致死率:

1.2.2 低能离子束诱变[10-11]吸取1 mL对数生长期的种子液,加入到装有9 mL无菌水的试管中,吸取0.1 mL菌液均匀的涂布在无菌培养皿上,于超净工作台中自然干燥,用氮离子(N+)照射处理。诱变后用1 mL无菌水洗涤平皿,吸取0.1 mL诱变后菌液涂布于平板上培养。30℃恒温箱培养2 d。进行菌落记数,计算致死率。
1.2.3 诱变菌株筛选从诱变后的平板挑取单菌落于斜面培养基中,30℃恒温箱培养,24 h后挑取1环接种于种子培养基。24 h后取5 mL接种于发酵培养基中,发酵38 h进行酶活检测。计算正突变率。取酶活最高的菌株为目标菌株。图1为诱变选育的流程。

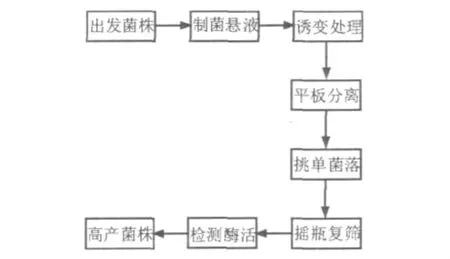
图1 诱变选育流程图Fig.1 Schematic drawing of mutation and screening process
1.2.4 遗传稳定性的测定选取试验中酶活最高的诱变菌株,连续传代5代,测定每一代腈水解酶酶活,比较其变化。
1.2.5 细胞转化取0.2 g摇床培养38 h的发酵液离心得到的菌体,用10 mL pH 8.0的磷酸盐缓冲液制成菌悬液。加入底物亚氨基二乙腈,35℃水浴摇床反应6 h,取1 mL反应液离心,取上清液HPLC分析。
1.2.6 酶活定义35℃条件下,1 min内转化底物得到1 μmol亚氨基二乙酸所需要的酶量定义为1个酶活单位U。
1.2.7 分析方法产物测定:Sil-20A型高效液相色谱仪,色谱柱为Hypersil SAX 5(4.6 mm×250 mm ID);流动相为浓度20 mmol/L的磷酸氢二铵缓冲液(磷酸调pH至4.0),柱温为30℃;检测器为紫外检测器,检测波长为210 nm,以峰面积外标法定量。
2 结果与分析
2.1 菌体生长曲线的绘制
ZJB09133生长曲线见图2。由图2可知,菌体在16 h进入对数生长期,32 h后进入稳定期。根据曲线,选择培养24~28 h的菌体进行诱变。
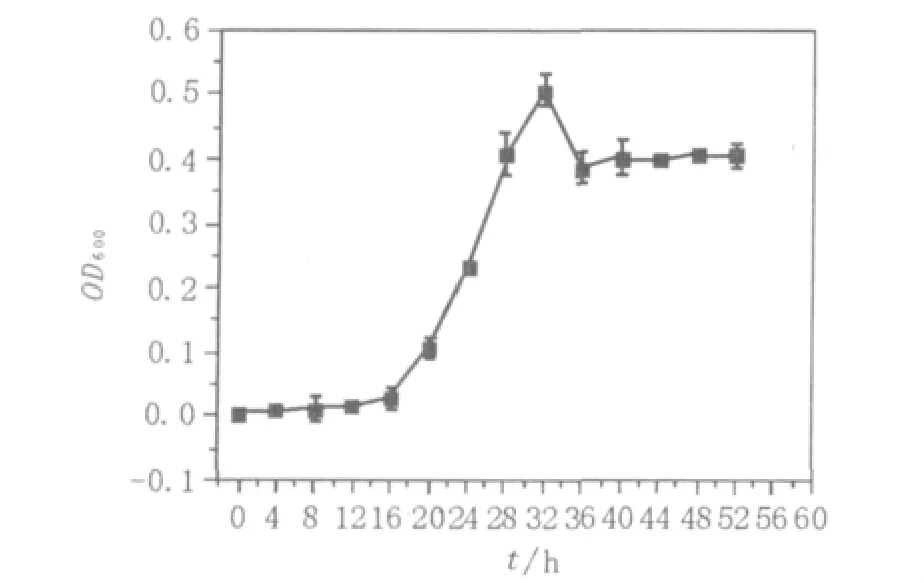
图2 ZJB09133菌体生长曲线Fig.2 Growth curve of ZJB09133
2.2 紫外-氯化锂复合诱变

图3 紫外-氯化锂诱变致死曲线Fig.3 Lethality curve of UV-LiCl mutation
紫外线(UV)的诱变机理是其能引起DNA结构变化。DNA分子强烈地吸收紫外线、可引起DNA链的断裂、DNA分子内部和分子间的交联、核酸与蛋白质的交联、嘧啶水合作用以及形成嘧啶二聚体。本研究对菌体分别照射5、10、15、20、25、30 s,计算致死率,得到诱变剂量与致死率的关系,结果见图3。由图3可知,随着紫外线照射时间的延长,致死率也增大,当照射时间为高于30 s时,致死率高于99%,根据微生物育种研究经验可认为致死率以90.0%~99.9%效果较好,但也有报道认为较低的致死率有利于正突变菌株的产生,而较高的致死率往往导致负突变率的提高[12]。在本研究中当照射时间为15 s时,其正突变率是最高的,达到20%,此时致死率在80%左右。所以选择15 s作为诱变的剂量。
2.3 低能离子束诱变
2.3.1 注入剂量与菌落存活数关系离子束对生物体有能量沉积和质量沉积双重作用,从而使生物体产生死亡、自由基间接损伤、染色体重复、易位、倒位或使DNA分子断裂、碱基缺失等多种生物学效应。氮离子注入量30×2.3×1013、60×2.3×1013、90×2.3×1013、120×2.3×1013、150×2.3×1013ions/cm2,注入能量15 kev,靶室真空度10-3Pa,脉冲注入,绘制剂量与存活量关系图。
如图4所示,粪产碱杆菌细胞随着N离子注入剂量的增加,菌种的存活数先减小后增大,然后又变小,形成典型的“马鞍型”剂量-效应曲线[13]。这种特有的“马鞍型”变化被认为是能量、动量作用下的损伤效应和质量、电荷作用下的保护和刺激效应综合作用的结果[14-15]。
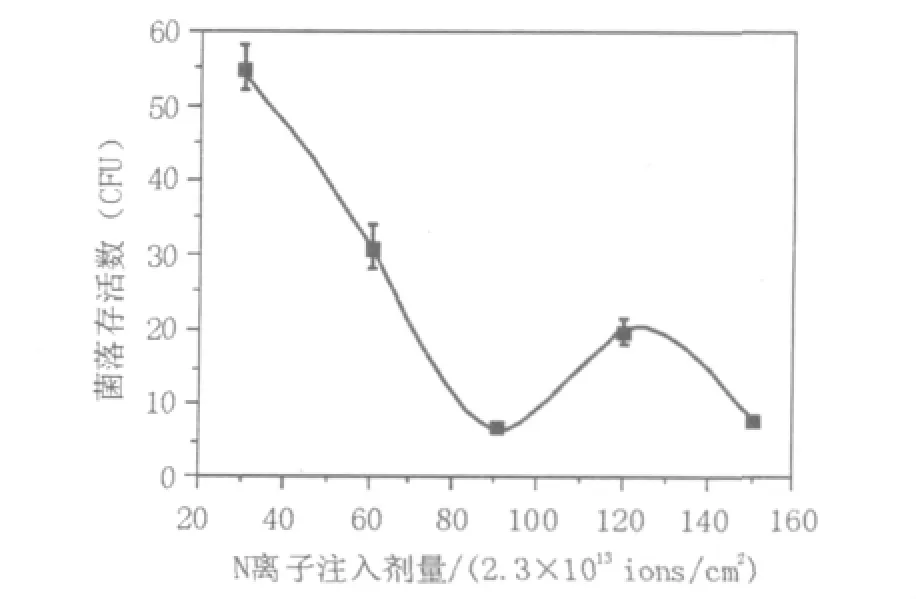
图4 注入剂量与菌落存活数(CFU)的关系Fig.4 The relationship between implantation dosage and amount of colonies surviving
2.3.2 各注入剂量的正负突变率通过每个剂量各挑取50株菌株,计算其正负突变率,结果如图5所示,当剂量为60×2.3×1013ions/cm2其诱变的正突变率最高,达到22%。
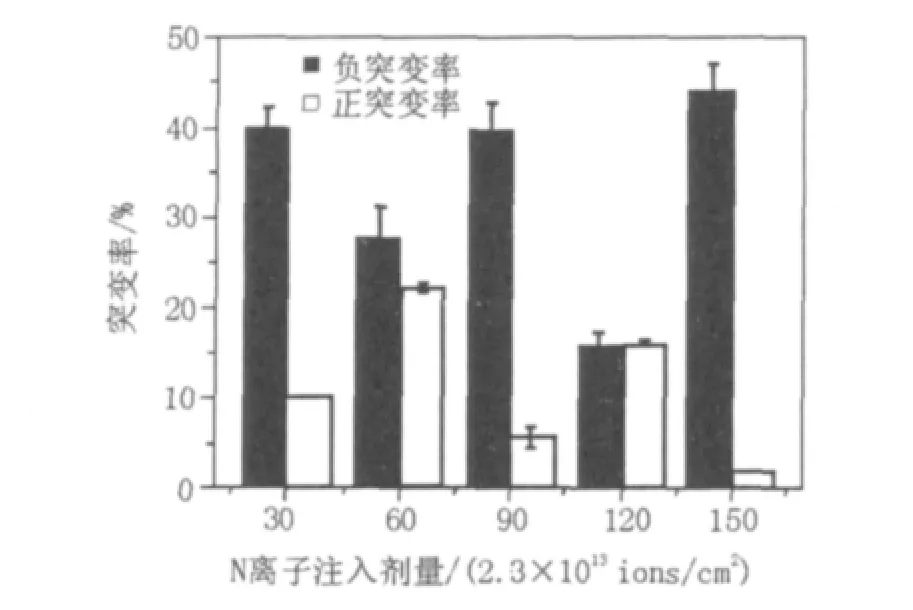
图5 不同注入剂量的正负突变率Fig.5 The positive,negative mutation rate of different implantation dosage
2.4 遗传稳定性的研究
经单独、复合多次诱变,通过筛选从500株诱变株中选取4株酶活最高菌株,分别命名为D121、D132、UL44、UL152,连续5次传代培养,以测定其遗传稳定性,结果见表1。以相对于未传代诱变菌株的酶活变化率作为评价指标。4株菌株酶活变化幅度较小,证明该菌株的遗传性能稳定。

表1 高产菌株传代稳定性的研究Table 1 The assessments of genetic stability
3 结论
现代微生物诱变育种理论认为,当诱变的微生物致死率在70%~75%左右时,产量性状的正突变率往往很高,而更高的致死率下,虽然突变率较高,而正突变率却很低。在本研究中取得了与上述结论相似的结果。当紫外照射时长为15 s时,也就是致死率大约为80%的时候,正突变率是最高的,达到20%。以Alcaligenes faecalis ZJB09133为出发菌株,采用UV-LiCl,离子注入进行诱变处理,当紫外照射时间和离子注入量分别为15 s和60×2.3×1013ions/cm2时,正突变是最高,分别达到20%和22%。
在挑取的所有菌落中,最终得到了4株腈水解酶酶活较高的菌株,且经过连续5代的传代培养,酶活没有明显的下降,其中UL44酶活是最高的,达到74.6 U/g,比初始菌株酶活提高124.5%。
[1] 汤鸣强,尤民生.抗草甘膦酵母菌ZM-1的分离鉴定及其生长降解特性[J].微生物学通报,2010,37(9):1402-1409.
[2] 查正炯,尹应武,谢增勇,等.甘氨酸法制备草甘膦工艺改进[J].农药学学报,2008,10(1):105-108.
[3] 张海滨,张小宏,王建清.降低双甘膦生产能耗改进措施[J].化工中间体,2007,28(4):26-27.
[4] 化学工业出版社组织编写.中国化工产品大全中卷(第2版)[M].北京:化学工业出版社,1998:2064-2065.
[5] 章思规.精细有机化学品技术手册(下册)[M].北京:科学出版社,1991:1158.
[6] 微生物催化亚氨基二乙腈制备亚氨基二乙酸的方法[P].中国专利:CN101629192A,2010,01-20.
[7] 刘长春.亚氨基二乙酸的开发与应用[J].应用化工,2001,30(2):17-18.
[8] 徐克力.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1998.
[9] 余增亮,何建军,邓建国,等.离子注入水稻诱变育种机理初探[J].安徽农业科学,1989,(01):11-16.
[10] Yu Z L.Ion beam application in genetic modification[J].Ieee Transactions on Plasma Science,2000,28(1):128-132.
[11] Yu Z L,Deng J,He JJ,et al.Mutation breeding by ion-implantation[J].Nuclear Instruments&Methods in Physics Research Section B-Beam Interactions with Materials and Atoms,1991,59:705-708.
[12] Jolly C,Cook A J L,Raferty J,et al.Measuring bidirectional mutation.[J].Journal of Theoretical Biology,2007,246(2):269-277.
[13] 邵春林,余增亮.离子束辐照下微生物、植物组织存活模型的研究[J].核技术,1997,20(07):423-430.
[14] 李玉峰,梁运章,余增亮.低能N+注入紫花苜蓿生物学效应初步研究[J].草业科学,2006,23(1):13-17.
[15] 程茂基,陈丽娟,余增亮.N+注入选育黑曲霉益生菌及其突变菌株产酶条件的研究[J].微生物学报,2005,45(04):534-538.

