Pb、Cd单一及复合胁迫对花菖蒲幼苗生长及部分生理指标的影响
付佳佳,韩玉林,李亚亚,许 敏
重金属污染是近年来人们广泛关注的环境问题之一,目前,用植物修复重金属污染土壤是一种较为理想的方法[1-2]。重金属污染的土壤,特别是点源污染源周边的土壤,往往重金属和有机物等多种污染源并存。因此,探求或发现具有一定耐重金属污染或富集重金属能力的植物种类并用于重金属污染土壤的修复和改良,必将有效改善土壤重金属污染的现状,减轻由此而引发的农业生态危机给人类带来的十分严峻的压力,也可带来巨大的社会和经济效益[2-3]。
鸢尾属(IrisL.)植物对重金属具有较好的耐性和富集能力[2-4],其中的黄菖蒲(I.pseudacorusL.)、马蔺〔I.lacteaPall.var.chinensis(Fisch.)Koidz.〕、喜盐鸢尾(I.halophilaPall.)和花菖蒲(I.ensataThunb. var.hortensisMakino etNemoto)等植物对 Pb的抗性很强,并有一定的积累作用[5-6]。花菖蒲为多年生宿根草本植物,观赏价值高,并具有生长快、生物量较大和可反复收割利用等优点,而且对 Pb有一定的积累和耐受能力[7],具备修复重金属污染土壤的优势,是具有 Pb污染修复潜能的植物种类之一,但在 Pb-Cd复合胁迫条件下花菖蒲的适应性、耐性以及对污染物的积累能力等方面尚未见研究报道。
作者对 Pb、Cd单一及复合胁迫条件下花菖蒲幼苗的生长和生理代谢的变化进行了研究,以期为花菖蒲对 Pb、Cd耐性机制的研究及其在污染环境治理中的应用提供理论依据。
1 材料和方法
1.1 材料
供试花菖蒲种子来源于江苏省·中国科学院植物研究所鸢尾种质圃的花菖蒲无性繁殖群体。花菖蒲播种及幼苗培育方法参照文献[2-8]。选取生长一致的花菖蒲幼苗(株高约10 cm)栽植于装有300 mL1/2Hoagland营养液的培养瓶中培养,培养瓶外用黑色塑料膜包裹,每瓶栽种6株幼苗,在1/2Hoagland营养液中预培养1周后用于 Pb、Cd单一胁迫和复合胁迫处理。
1.2 方法
1.2.1 Pb和 Cd胁迫处理方法 实验在江西财经大学资源与环境管理学院植物生理实验室内进行。共设置500m g·L-1Pb单一胁迫、25m g·L-1Cd单一胁迫和500m g·L-1Pb-25m g·L-1Cd复合胁迫3个处理组,对照(CK)则不添加 Pb和 Cd(0m g·L-1Pb,0m g·L-1Cd),各处理均重复3次。分别用去离子水将 Pb(NO3)2和 CdC l2配制成母液,然后加入相应的1/2Hoagland营养液中,每隔4天更换1次培养液,胁迫处理周期为20 d。
1.2.2 生长势和生理指标测定 胁迫处理8 d后,每个处理随机选取2株幼苗,取地上部分和地下部分相同部位用于各项生理指标的测定。将花菖蒲幼苗用自来水冲洗干净,分别称取0.1 g地上部分和地下部分用于测定各项生理指标。用愈创木酚法测定过氧化物酶(POD)活性;用丙酮提取法测定叶绿素和类胡萝卜素的含量[9];用硫代巴比妥酸法测定丙二醛(MDA)的含量[10]。
胁迫处理20 d后取样用于花菖蒲生长势测定。将花菖蒲幼苗用自来水洗净,首先用直尺测量各处理组幼苗的根系长度,然后参照文献[2]的方法计算各处理组花菖蒲幼苗的耐性指数(to lerance index);将幼苗的地上部分(叶片)和地下部分(包括根茎和根系)分开,于80℃烘干至恒质量后,用千分之一电子天平分别称取地上部分和地下部分的干质量。
1.3 数据统计处理
实验数据采用 Excel和 SPSS软件进行处理和分析。
2 结果和分析
2.1 Pb、Cd单一及复合胁迫对花菖蒲幼苗干质量和耐性指数的影响
Pb、Cd单一及复合胁迫处理20 d后花菖蒲幼苗地上部分和地下部分的干质量以及耐性指数见表1。由表1可见,在500m g·L-1Pb单一胁迫条件下,花菖蒲幼苗地上部分和地下部分的干质量与对照(CK)差异不显著(P>0.05),表明500m g·L-1Pb单一胁迫对幼苗生长的抑制作用不显著;在25m g·L-1Cd单一胁迫和500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗地上部分和地下部分的干质量均显著低于对照组和500m g·L-1Pb单一胁迫处理组(P<0.05),其中,在复合胁迫条件下,花菖蒲幼苗地上部分和地下部分的干质量分别比对照下降了35.2%和33.7%。表明25m g·L-1Cd单一胁迫和Pb-Cd复合胁迫对花菖蒲幼苗的生长有显著的抑制作用。
表1 Pb、Cd单一及复合胁迫对花菖蒲幼苗干质量及耐性指数的影响(±SD)1) Table1 Effects of sing le and com b ined stresses of Pb,Cd on dry weigh t and to lerance index of Iris1)ensa ta Thunb.var.ho rtensis Mak ino et Nem oto seed ling(±SD)
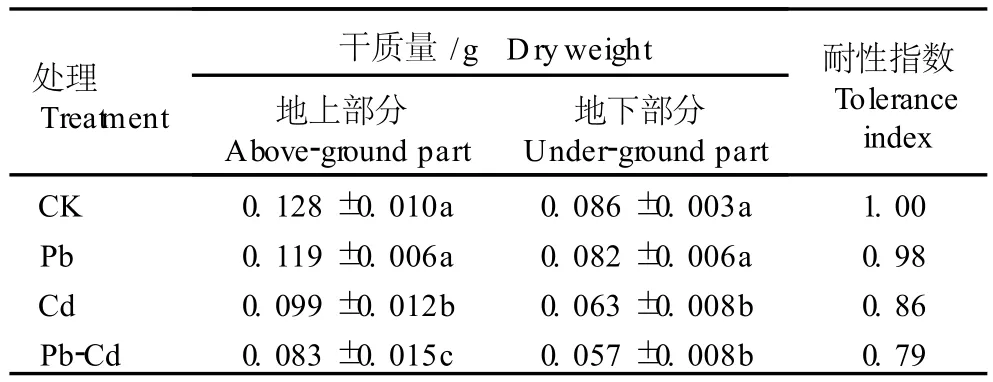
表1 Pb、Cd单一及复合胁迫对花菖蒲幼苗干质量及耐性指数的影响(±SD)1) Table1 Effects of sing le and com b ined stresses of Pb,Cd on dry weigh t and to lerance index of Iris1)ensa ta Thunb.var.ho rtensis Mak ino et Nem oto seed ling(±SD)
1)表中数据为3次重复的平均值 The datum s in this Table are the average of three rep lications.CK:0 mg·L-1 Pb-0 mg·L-1 Cd;Pb:500mg·L-1 Pb;Cd:25mg·L-1 Cd;Pb-Cd:500mg·L-1 Pb-25mg·L-1 Cd.同列中不同的小写字母表示经邓肯氏新复极差检验在0.05水平上差异显著 D ifferent sm all letters in the sam e co lum n ind icate the significant difference at0.05 level by Duncan’s new m u ltip le range test.
处理Treatment干质量/g D ryw eigh t地上部分Above-ground part地下部分Under-ground part耐性指数To lerance index CK 0.128±0.010a 0.086±0.003a 1.00 Pb 0.119±0.006a 0.082±0.006a 0.98 Cd 0.099±0.012b 0.063±0.008b 0.86 Pb-Cd 0.083±0.015c 0.057±0.008b 0.79
由表1还可以看出,在 Pb、Cd单一及复合胁迫条件下,花菖蒲幼苗的耐性指数均不同程度减小。在500m g·L-1Pb单一胁迫条件下,花菖蒲幼苗的耐性指数较对照仅下降了2%,表明花菖蒲幼苗对500 m g·L-1Pb单一胁迫有一定耐受性;而在25 m g· L-1Cd单一胁迫和500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗的耐性指数分别较对照下降了 14%和 21%,说明 25 m g·L-1Cd单一胁迫和500m g·L-1Pb-25 m g·L-1Cd复合胁迫对花菖蒲幼苗的毒性增强,显著抑制了幼苗根系的生长。花菖蒲幼苗耐性指数的这种差异与3种胁迫处理对花菖蒲幼苗地上部分和地下部分干质量的影响效应基本一致。
2.2 Pb、Cd单一及复合胁迫对花菖蒲幼苗部分生理指标的影响
2.2.1 对叶片中光合色素含量的影响 Pb、Cd单一及复合胁迫处理8 d后花菖蒲幼苗叶片中叶绿素和类胡萝卜素的含量见表2。由表2可以看出,在500m g·L-1Pb单一胁迫条件下,叶片中叶绿素 a(Chla)、叶绿素 b(Ch lb)和类胡萝卜素(Car)的含量均显著高于对照(P<0.05),分别为对照的1.36、1.11和1.31倍。在25 m g·L-1Cd单一胁迫条件下,叶片中的 Chla和 Chlb含量分别较对照下降了42.6%和43.7%,而 Car含量比对照增加了15.5%,差异均达到显著水平(P<0.05)。在500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,叶片中的 Chla、Chlb和 Car含量均显著下降,分别较对照下降了55.7%、58.0%和41.5%。表明500m g·L-1Pb单一胁迫处理对花菖蒲幼苗叶片中光合色素的合成具有一定的促进作用,而25m g·L-1Cd单一胁迫及 Pb-Cd复合胁迫对花菖蒲幼苗叶片中光合色素有一定的破坏作用,其中的叶绿素对胁迫处理更敏感。
表2 Pb、Cd单一及复合胁迫对花菖蒲幼苗叶片中光合色素含量的影响(±SD)1)Table2 Effects of sing le and com b ined stresses of Pb,Cd on photo-Msyn akth in e to ic e p t N igm emenot toco sne etde n lint g in( lea ± f S o D f) I1r)is ensa ta Thunb.var.ho rtensis
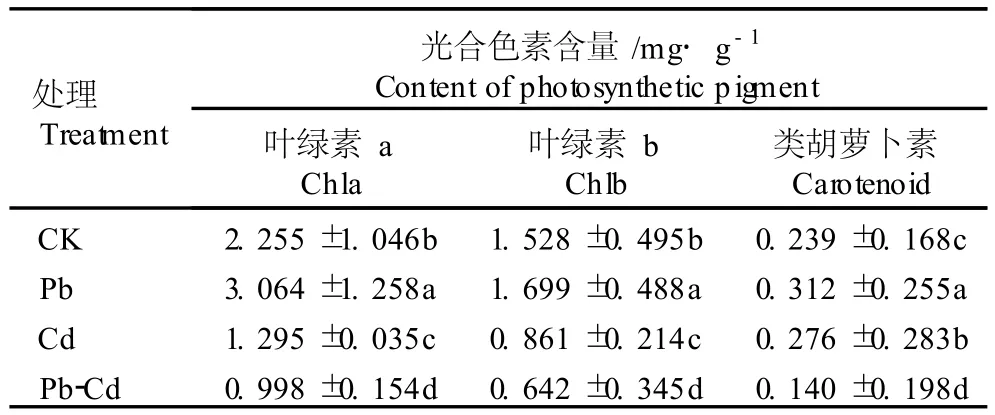
表2 Pb、Cd单一及复合胁迫对花菖蒲幼苗叶片中光合色素含量的影响(±SD)1)Table2 Effects of sing le and com b ined stresses of Pb,Cd on photo-Msyn akth in e to ic e p t N igm emenot toco sne etde n lint g in( lea ± f S o D f) I1r)is ensa ta Thunb.var.ho rtensis
1)表中数据为3次重复的平均值 The datum s in this table are the average of th ree rep lications.CK:0 m g·L-1 Pb-0 m g·L-1 Cd;Pb:500mg·L-1 Pb;Cd:25mg·L-1 Cd;Pb-Cd:500mg·L-1 Pb-25mg·L-1 Cd.同列中不同的小写字母表示经邓肯氏新复极差检验在0.05水平上差异显著 D ifferent small letters in the same column indicate the significant difference at0.05 level by Duncan’s new multip le range test.
处理Treatment光合色素含量/m g·g-1 Content of photosynthetic p igment叶绿素a Chla叶绿素b Ch lb类胡萝卜素Carotenoid CK 2.255±1.046b 1.528±0.495b 0.239±0.168c Pb 3.064±1.258a 1.699±0.488a 0.312±0.255a Cd 1.295±0.035c 0.861±0.214c 0.276±0.283b Pb-Cd 0.998±0.154d 0.642±0.345d 0.140±0.198d
2.2.2 对MDA含量的影响 Pb、Cd单一及复合胁迫处理8 d后花菖蒲幼苗中MDA含量见表3。由表3可知,在500m g·L-1Pb单一胁迫条件下,花菖蒲幼苗地上部分的MDA含量显著低于对照,而地下部分的MDA含量显著高于对照;在25 m g·L-1Cd单一胁迫条件下,地上部分和地下部分的MDA含量均高于对照,较对照分别增加了28.8%和5.9%,但地下部分的MDA含量与对照差异不显著;在500m g· L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗地上部分和地下部分的MDA含量最高,且均与对照有显著差异(P<0.05),分别是对照的1.7和2.7倍。表明 Pb、Cd单一和复合胁迫均能够引起花菖蒲幼苗细胞内活性氧的积累,导致细胞不同程度的膜脂过氧化,表现为MDA含量不同程度的增加。
表3 Pb、Cd单一及复合胁迫对花菖蒲幼苗MDA含量和 POD活性的影响(±SD)1)Table3 Effectso f single1a)nd com b ined stresses of Pb,Cd on MDA con ten t and POD activ ity of Iris ensa ta Thunb.var.ho rtensis Mak ino etNem oto seed ling(±SD)

表3 Pb、Cd单一及复合胁迫对花菖蒲幼苗MDA含量和 POD活性的影响(±SD)1)Table3 Effectso f single1a)nd com b ined stresses of Pb,Cd on MDA con ten t and POD activ ity of Iris ensa ta Thunb.var.ho rtensis Mak ino etNem oto seed ling(±SD)
1)表中数据为3次重复的平均值 The datum s in this Table are the average of three rep lications.同列中不同的小写字母表示经邓肯氏新复极差检验在0.05水平上差异显著 D ifferent small letters in the same column indicate the significant difference at0.05 level by Duncan’s new mu ltip le range test.
处理Treatm en t MDA含量/nmo l·g-1 MDA content地上部分Above-ground part地下部分Under-ground part POD活性/U·g-1·m in-1 POD activity地上部分Above-ground part地下部分Under-ground part0mg·L-1 Pb-0mg·L-1 Cd(CK)0.233±0.028c 0.136±0.058c 6.232±0.218c 2.335±0.173c500mg·L-1 Pb 0.178±0.024d 0.256±0.034b 6.562±0.545c 2.349±0.309c25m g·L-1 Cd 0.300±0.071b 0.144±0.015c 12.437±1.072b 5.938±0.489b500mg·L-1 Pb-25mg·L-1 Cd 0.391±0.094a 0.367±0.038a 15.364±1.142a 8.051±0.714a
2.2.3 对 POD活性的影响 Pb、Cd单一及复合胁迫处理8 d后花菖蒲幼苗的 POD活性也见表3。由表3可见,在500m g·L-1Pb和25m g·L-1Cd单一胁迫以及500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗地上部分和地下部分的 POD活性均高于对照,其中500 m g·L-1Pb单一胁迫处理组的POD活性与对照差异不显著,而25m g·L-1Cd单一胁迫处理组和500m g·L-1Pb-25m g·L-1Cd复合胁迫处理组的 POD活性与对照有显著差异(P<0.05),且在复合胁迫条件下,花菖蒲幼苗地上部分和地下部分的 POD活性最高,分别是对照的2.5和3.4倍。表明 Pb、Cd单一和复合胁迫对花菖蒲幼苗地上部分和地下部分的 POD活性均有较强的诱导能力。
3 讨 论
Pb和 Cd是导致环境中重金属污染的主要重金属元素,对植物而言,当体内的重金属含量超过某一阈值时就会对其生长和代谢产生不利影响,严重时导致植株死亡。植物对重金属污染的耐性因植物种类、重金属元素种类及浓度以及污染方式的不同而有一定的差异,采用耐性指数可以评价植物在不同污染状况下的抗性。本实验结果表明,在500m g·L-1Pb单一胁迫条件下,花菖蒲幼苗的耐性指数较高,达到0.98;而在25m g·L-1Cd单一胁迫和500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗的耐性指数均减小,分别为0.86和0.79。说明花菖蒲幼苗对 Cd单一胁迫及 Pb-Cd复合胁迫的耐受性低于 Pb单一胁迫,表现为花菖蒲幼苗地上部分和地下部分的干质量以及耐性指数显著下降,特别是 Pb-Cd复合胁迫还可进一步加重对花菖蒲幼苗的伤害,对其生长产生严重影响。Zhou等[11]在研究黄菖蒲对Pb和 Cd的耐性时也得出了相似的结果。
叶绿素是植物光合作用的主要色素,其含量高低直接反映植物光合作用能力的强弱,叶片中叶绿素含量低,光合作用弱,对植物的生长不利,而植物受到逆境胁迫后也可导致叶绿素含量下降[11]。Zhou等[11]的研究结果显示,高浓度 Pb胁迫可导致黄菖蒲地上部分叶绿素含量降低。作者的研究结果显示,在500 m g·L-1Pb单一胁迫条件下,花菖蒲幼苗叶片中叶绿素 a和 b的含量均有所提高;而在25 m g·L-1Cd单一胁迫和500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗叶片中叶绿素 a和 b的含量均显著降低,说明500m g·L-1Pb单一胁迫对花菖蒲幼苗叶片叶绿素含量的影响不大,间接反映出对幼苗的正常生长无明显影响;而25m g·L-1Cd单一胁迫和500m g·L-1Pb-25 m g·L-1Cd复合胁迫则可使花菖蒲幼苗的生长受到不同程度的影响,尤其是 Pb-Cd复合胁迫条件下,光合色素的合成受到了显著抑制。Pb单一胁迫处理造成花菖蒲叶片叶绿素含量增加的原因很多,可能由于实验所设置的 Pb的质量浓度较低,不足以破坏叶绿素的合成过程,对叶片中叶绿素酶的活性也没有影响[12-13];或者是由于叶绿素分子中的 Fe2+、Zn2+和Mg2+并没有被 Pb等重金属元素所取代[12]。孙赛初等[14]的研究结果表明,Cd胁迫可引起植物光合色素含量的降低。推测 Cd单一胁迫和 Pb-Cd复合胁迫导致花菖蒲叶绿素含量降低的主要原因有两方面:一方面是由于 Cd对花菖蒲的毒害更重;另一方面是复合胁迫条件下 Pb和 Cd可能具有协同作用,对花菖蒲的毒害作用大于各自的单一胁迫处理。
MDA是植物体内膜脂过氧化的产物,其含量高低反映了细胞膜脂过氧化程度的大小,含量越高表明细胞膜脂过氧化程度越高,细胞膜结构完整性越差。重金属胁迫可诱发生物代谢过程产生自由基,对植物细胞膜具有伤害作用,进而导致膜脂过氧化产物MDA含量明显增加[11,13]。本研究中,在500m g·L-1Pb-25m g·L-1Cd复合胁迫条件下,花菖蒲幼苗地上部分和地下部分MDA含量均显著提高,说明细胞的生物膜已受到伤害,加之叶片中 Chla和 Chlb含量显著下降,花菖蒲幼苗生长受到了显著抑制。表明本研究中采用的 Pb-Cd复合胁迫对花菖蒲幼苗的伤害已经超过了其对 Pb-Cd复合胁迫的耐受性以及抵御 Pb-Cd复合胁迫的诱导防护能力。
生物体自身的保护酶系统能清除自由基、维持细胞膜结构的功能和完整性,进而减轻危害[15-16]。POD是重要的抗氧化酶之一,在植物呼吸代谢过程中起重要作用[16]。在 Pb、Cd单一及复合胁迫条件下,花菖蒲幼苗地上部分和地下部分的 POD活性均高于对照,说明 Pb、Cd单一及复合胁迫均可激发花菖蒲幼苗 POD活性,使其在减轻 Pb、Cd单一及复合胁迫对花菖蒲幼苗伤害的过程中起到了一定的作用。
综合分析表明,花菖蒲幼苗对500m g·L-1Pb单一胁迫具有一定的耐受性,而对25m g·L-1Cd单一胁迫和500m g·L-1Pb-25m g·L-1Cd复合胁迫的耐受性较小,特别是在复合胁迫条件下,Pb和 Cd具有协同作用,加剧了对花菖蒲幼苗生长和代谢的损害。
[1]Chen HM,Zheng C R,Wang SQ,et al.Combined pollution and po llution index of heavymetals in red soil[J].Pedosphere,2000,10(2):117-124.
[2]Han Y L,Yuan H Y,Huang S Z,et al.Cadm ium tolerance and accumulation by two species ofIris[J].Ecotoxicology,2007,16(8):557-563.
[3]蔡美芳,党 志,文 震,等.矿区周围土壤中重金属危害性评估研究[J].生态环境,2004,13(1):6-8.
[4]黄苏珍,韩玉林,谢明云,等.中国鸢尾属观赏植物资源的研究与利用[J].中国野生植物资源,2003,22(1):4-7.
[5]王鸿燕,黄苏珍.Pb胁迫对马蔺种子萌发和幼苗根尖有丝分裂的影响[J].植物资源与环境学报,2009,18(2):53-56.
[6]孙延东,原海燕,黄苏珍.Cd-Cu复合胁迫对黄菖蒲叶片及根系中 Cd和 Cu的累积及其迁移率的影响[J].植物资源与环境学报,2009,18(1):22-27.
[7]韩玉林.鸢尾属(IrisL.)植物铅积累、耐性及污染土壤修复潜力研究[D].南京:南京农业大学园艺学院,2007:35-53.
[8]Han Y L,Huang SZ,Gu JG,etal.Tolerance and accumulation of lead by species ofIrisL.[J].Ecotoxicology,2008,17(8):853-859.
[9]李合生.植物生理生化实验原理和技术[M].1版.北京:高等教育出版社,2000:164-194.
[10]张志良.植物生理学实验指导[M].2版.北京:高等教育出版社,1990:154-155.
[11]Zhou YQ,Huang S Z,Yu SL,etal.The physiological response and sub-cellu lar localization of lead and cadm ium inIrispseudacorusL.[J].Ecotoxicology,2010,19(1):69-76.
[12]Prasad D D K,Prasad A R K.Effect of lead and mercury on chlorophyll synthesis inmung bean seed lings[J].Phytochem istry,1987,26(4):881-883.
[13]Bazzaz FA,Rolfe G L,Wind le P.D iffering sensitivity of corn and soybean photosynthesis and transp iration to lead contam ination[J]. Journal of EnvironmentalQuality,1974,3(2):156-158.
[14]孙赛初,王焕校,李启任.水生维管束植物受镉污染后的生理变化及受害机制初探[J].植物生理学报,1985,11(2):113-121.
[15]仇 硕,黄苏珍,王鸿燕.Cd胁迫对黄菖蒲幼苗4种抗氧化酶活性的影响[J].植物资源与环境学报,2008,17(1):28-32.
[16]Guo TR,Zhang G P,ZhouMX,et al.Effects of alum inum and cadm ium toxicity on growth and antioxidantenzym e activities of two barley genotypeswith different A l resistance[J].Plant and Soil,2004,258(1):241-248.

