NaCl胁迫对海滨木槿叶片生理特性的影响
李会欣,吴 明,方炎明,邵学新,梁 威
(1.中国林业科学研究院亚热带林业研究所,浙江富阳 311400;2.南京林业大学森林资源与环境学院,江苏 南京 210037)
海滨木槿 (HibiscushamaboSieb.et Zucc.)原产热带滨海地区,属锦葵科 (M alvaceae)木槿属 (HibiscusL.)植物,为浙江省珍稀濒危植物[1]。海滨木槿树冠浓密,花形大而色泽艳丽、花色金黄,枝条富有韧性、耐修剪,是十分珍贵的园林绿化树种之一;海滨木槿还具有惊人的抗逆能力[2],不但能耐盐碱和海水浸泡,而且还具有很强的耐旱、耐瘠薄和抗风能力,是一种颇具发展潜力的防护树种。因此,海滨木槿在环境治理和盐碱地改良方面具有十分重要的作用。
在正常的生理代谢中,植物体内的活性氧处于产生和清除的平衡状态。植物受到盐胁迫时,体内会产生大量的活性氧,引起膜质的过氧化伤害。丙二醛(MDA)是膜质过氧化的主要产物,可与生物膜上的蛋白质、酶等结合,破坏生物膜的结构和功能,从而使细胞膜透性增大,膜交换能力下降或丧失。植物本身具有保护机制和自我调节体系,在一定范围内可减轻逆境对植物体的伤害。植物本身的保护机制主要包括 2种保护系统:一是酶促抗氧化保护系统,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等;二是非酶促抗氧化保护系统,包括甜菜碱、维生素 C和类黄酮等非酶类物质[3]。渗透调节物质则主要有脯氨酸和可溶性糖等,构成植物的自我调节体系。二者协同作用共同抵制环境胁迫诱导的氧化伤害。
目前,关于海滨木槿的研究主要集中于形态特征、驯化栽培以及开发利用等方面,但关于NaC l胁迫条件下海滨木槿生理响应方面的研究报道尚不多见。为此,作者比较分析了NaC l胁迫条件下海滨木槿幼苗叶片电解质渗出率、叶绿素含量、MDA含量、脯氨酸含量、可溶性糖含量、SOD活性和 POD活性等生理生化指标的动态变化,探讨了海滨木槿对NaCl胁迫伤害的响应机制,为从生理角度分析海滨木槿的耐盐机制提供实验依据。
1 材料和方法
1.1 材料
供试材料为 1年生海滨木槿扦插苗。选取健康状况良好、生长势基本一致的植株用于实验,植株平均株高(48.17±2.82)cm、平均地径 (0.52±0.14) cm。于 2009年 3月将海滨木槿扦插苗盆栽,每盆定植 1株,置于杭州湾湿地生态站实验大棚内供试。
供试土壤取自杭州湾新围滩地 (围垦 5 a),为粉沙质滨海盐土,含盐量为 0.06%,并含有机质 5.357 g·kg-1、全磷 0.549 g·kg-1和全氮 0.301 g·kg-1, pH 8.7。土壤自然风干,去杂、过筛后装盆 (上口径22 cm、下口径 16 cm、高 26 cm),每盆装土 6.13 kg。
1.2 方法
于 2009年 6月开始进行NaC l胁迫处理,土壤中NaC l终浓度分别设置为 0.0(CK)、2.0、4.0、6.0和 8.0m g·g-1,各处理中的 NaC l均以溶液的形式分 4次浇灌,每次 200mL,每天浇灌 1次,连续浇灌 4 d,对照用清水浇灌。每处理 5株,各 3次重复,共 15株。在NaC l胁迫处理期间用清水合理浇灌,并使土壤含水量保持在田间持水量的 60%~80%,定期测定土壤含盐量并松土,以保持土壤中 NaC l含量的稳定和均匀分布。
分别于NaC l浇灌结束后的第 20、第 35、第 54和第 70天采集扦插苗的叶片 (每株 2~3片,混合取样),立即置于 -70℃液氮中保存,用于各项生理生化指标的测定[4]。
采用乙醇 -丙酮混合法[5]测定叶绿素含量;采用电导率法测定电解质渗出率;采用硫代巴比妥酸显色法测定MDA含量;采用茚三酮显色法测定脯氨酸含量;采用蒽酮比色法测定可溶性糖含量;采用 NBT (氮蓝四唑)光化还原法测定 SOD活性;采用愈创木酚法[6]测定 POD活性。
1.3 数据统计
采用 Excel 2000软件整理实验数据,并采用SPSS 13.0软件进行方差分析。
2 结果和分析
2.1 NaC l胁迫对海滨木槿叶片中叶绿素含量及叶绿素a与 b比值的影响
叶绿素含量不仅是直接反映植物光合能力的重要指标,也是衡量植物耐盐性的重要生理指标之一[7]。叶绿素 a与 b比值 (Chla/Chlb)的高低则可以反映叶绿体中类囊体的叠垛程度,即:叶绿素 a与 b比值越低,类囊体的叠垛程度越低,类囊体膜的稳定性也越差,致使光能在 2个光系统之间的分配受到影响[8]。NaC l胁迫条件下海滨木槿叶片中叶绿素含量和叶绿素 a与 b比值的变化见表 1。
由表 1可知,在 2.0~8.0 m g·g-1NaC l胁迫条件下,海滨木槿叶片中叶绿素含量随胁迫时间的延长均呈现出先升高而后下降再升高的趋势。2.0和 4.0 m g·g-1NaC l胁迫条件下,不同处理时间海滨木槿叶片中叶绿素含量始终高于对照,且在胁迫处理的第35天时叶绿素含量最高,分别较对照组增加了 41%和 53%,且与对照组间差异显著 (P<0.05);而在胁迫处理的第 54天,尽管叶绿素含量有所降低,但也极显著高于对照;在胁迫处理的第 70天叶绿素含量小幅增加,但与对照差异不显著。表明较低质量浓度的NaC l胁迫可显著提高海滨木槿叶片的叶绿素含量,但这一效应与胁迫处理时间较短有关,这一结果与Strogonov[9]的观点一致。而在 6.0和 8.0 m g·g-1NaC l胁迫条件下,在处理的第 35天海滨木槿叶片叶绿素含量高于对照组但差异不显著,在其他处理时间均低于或等于对照,且在处理的第 54天时叶绿素含量最低,分别仅为对照组的 63%和 89%,但在处理的第 70天时叶片中叶绿素含量又略有增加且与对照组间差异不显著 (P>0.05),表明在较高质量浓度的NaC l胁迫条件下经过一段时间的处理,海滨木槿逐渐表现出对NaC l胁迫的适应能力。其中,胁迫处理第 54天 (7月 28日)各处理组叶绿素含量降低可能是由于此时天气最热,高温使酶的活性降低,从而影响叶绿素的合成。
由表 1还可见,在 2.0~8.0m g·g-1NaC l胁迫条件下,海滨木槿叶片的 Chla/Ch lb比值呈先降低后升高的趋势,但变化幅度不大;Ch la/Ch lb比值在处理的第 35天低于对照组,而在第 20、第 54和第 70天均高于对照组。叶绿素 b是与植物抵抗逆境有关的一种光合色素,其相对含量的降低对于提高植物对外界盐胁迫的耐受力有一定的效果[8];叶绿素 b含量下降,使光能捕获量减少,降低了细胞内活性氧的产生,减少了对蛋白质的降解,从而使植物对盐胁迫的耐受性增强。综合分析后认为,在 NaC l胁迫条件下海滨木槿叶片中叶绿素 b的降解速率大于叶绿素 a,导致叶绿素 b的相对含量减少,这一现象可能是海滨木槿为适应NaC l胁迫而表现出的生理响应之一。
2.2 NaC l胁迫对海滨木槿叶片中质膜透性和丙二醛(M DA)含量的影响
盐胁迫对植物危害的一个重要方面是对膜结构和组成的影响,在盐胁迫条件下植物膜系统最先遭到破坏,从而使膜透性增大,细胞内离子外渗,表现为电解质渗出率的提高[3]。电解质渗出率的大小能直接反映植物细胞膜受伤害的程度,即:电解质渗出率越大,质膜受到的伤害也越大。而MDA也是膜质过氧化的主要产物之一,其含量高低也可以反映植物遭受逆境的伤害程度[6]。NaC l胁迫条件下海滨木槿叶片电解质渗出率和MDA含量的变化见表 2。

表 1 不同质量浓度 NaC l胁迫对海滨木槿叶片叶绿素含量和叶绿素 a与 b比值的影响1)Tab le 1 Effect of NaC l stressw ith d ifferen t concen tra tion s on ch lorophy ll con ten tand ra tio of Ch la to Ch lb in lea f of H ibiscus ham abo Sieb.et Zucc.1)
如表 2所示,在 2.0~8.0m g·g-1NaC l胁迫条件下,随NaC l质量浓度的提高和处理时间的延长,海滨木槿叶片电解质渗出率总体上呈现升高的趋势,仅在处理的第 54天各处理组及对照组的叶片电解质渗出率略有降低,且仅在 4.0m g·g-1NaC l胁迫处理的第20天时叶片的电解质渗出率略低于对照组,其余各处理组在各处理时间的叶片电解质渗出率均高于对照组。在 2.0和 4.0m g·g-1NaC l胁迫条件下,在整个实验期间 (70 d)海滨木槿叶片的电解质渗出率与对照组间几乎没有显著差异 (P>0.05),说明质量浓度低于或等于 4.0m g·g-1的 NaC l胁迫处理对海滨木槿叶片的细胞膜并未造成明显伤害。在 6.0和 8.0 m g·g-1NaC l胁迫条件下,各时间段叶片的电解质渗出率与对照组间均差异极显著 (P<0.01);在胁迫处理的第 20、第 35、第 54和第 70天,6.0m g·g-1NaC l胁迫处理组海滨木槿叶片的电解质渗出率分别为对照组的 1.75、1.20、1.25和 1.19倍;8.0m g·g-1NaC l胁迫处理组则为对照组的 1.60、1.44、1.47和 1.38倍,说明在 6.0和8.0m g·g-1NaC l胁迫条件下,海滨木槿叶片的细胞膜受到了较明显的伤害,但随着时间的延长,受害程度减小。
由表 2还可看出,随处理时间的延长,各胁迫处理组及对照组海滨木槿叶片中的MDA含量均表现出先急剧升高后逐渐降低的趋势。在处理的第 20天,各胁迫处理组(2.0~8.0 m g·g-1NaC l)海滨木槿叶片的 MDA含量均与对照组间无显著差异 (P>0. 05),说明此时活性氧对海滨木槿叶片的细胞膜还未造成膜脂过氧化伤害。在处理的第 35天,尽管各处理组和对照组海滨木槿叶片的MDA含量均急剧上升,且表现出随NaC l质量浓度的提高MDA含量逐渐增加的趋势,但 2.0~6.0m g·g-1NaC l胁迫处理组的MDA含量显著高于对照组 (P<0.05),而 8.0m g ·g-1NaC l胁迫处理组的MDA含量极显著高于对照组(P<0.01),并为对照组的 1.53倍,说明在 2. 0~8.0m g·g-1NaC l胁迫条件下海滨木槿细胞内活性氧骤增,MDA含量也随之增加,且 NaC l质量浓度越高,MDA含量增加越明显。而在胁迫处理的第 54和第70天,各处理组和对照组的MDA含量均较大幅度降低,且各处理组的 MDA含量总体上呈现出随NaC l质量浓度的提高而逐渐降低的趋势;在处理的第70天,各处理组的MDA含量与对照组差异不显著,说明经过一定时间的胁迫锻炼,海滨木槿体内的活性氧清除机制逐渐被激活,使MDA含量下降。

表2 不同质量浓度 NaC l胁迫对海滨木槿叶片电解质渗出率和M DA含量的影响1)Tab le 2 Effect of NaC l stress w ith d ifferen t concen tra tion s on electrolyte perm eab ility and M DA con ten t in lea f of H ibiscus ham abo Sieb.et Zucc.1)
2.3 NaC l胁迫对海滨木槿叶片中脯氨酸和可溶性糖含量的影响
渗透胁迫是盐胁迫对植物伤害的重要方面,土壤中含盐量的增加使土壤渗透势下降,导致植物吸收水分困难,而植物体可通过增加渗透调节物质来平衡渗透势以减轻盐胁迫的伤害[10]。脯氨酸是水溶性最高的氨基酸,具有很强的水合能力,其水溶液具有很高的水势,因此脯氨酸在植物的渗透调节中起着重要作用。植物体内的可溶性糖也是渗透调节物质之一,当植物处于逆境时,可溶性糖含量的增加可提高细胞的渗透势,缓解生理干旱。NaC l胁迫条件下海滨木槿叶片脯氨酸含量和可溶性糖含量的变化见表 3。
如表 3所示,随NaC l胁迫时间的延长,各处理组及对照组的海滨木槿叶片中脯氨酸含量总体上呈先急剧增加然后逐渐降低的趋势,但同一处理时间段,各处理组的脯氨酸含量均高于对照组;在处理的第 35天,各处理组的脯氨酸含量均达到最高值;在处理的第 20、第 35和第 54天,随 NaC l质量浓度的提高,脯氨酸含量总体上呈逐渐升高的趋势,其中,与对照组相比,8.0m g·g-1NaC l处理组的脯氨酸含量变化幅度最大。在胁迫处理的第 20天,2.0和 4.0m g·g-1NaC l处理组的脯氨酸含量尽管高于对照组,但差异不显著 (P>0.05),而 6.0和 8.0m g·g-1NaC l处理组的脯氨酸含量极显著高于对照组 (P<0.01);在胁迫处理的第 35和第 54天,2.0~8.0m g·g-1NaC l胁迫处理组的脯氨酸含量均极显著高于对照组 (P<0. 01);而在胁迫处理的第 70天,各处理组的脯氨酸含量尽管也高于对照组,但差异不显著 (P>0.05)。上述结果表明,在NaCl胁迫处理的前中期,海滨木槿叶片中的脯氨酸发挥渗透调节的功能,维持细胞膜的稳定,使其不受破坏;在 NaC l胁迫处理过程的后期,叶片中脯氨酸含量明显降低,有可能是细胞内的保护酶起作用,消除了氧自由基的伤害。说明在 NaC l胁迫条件下海滨木槿具有自我修复功能。
由表 3还可见,随着处理时间的延长,各处理组及对照组海滨木槿叶片中的可溶性糖含量均呈现出先降低后逐渐增加的趋势,其中,在NaC l胁迫处理第35天,各处理组及对照组的可溶性糖含量均达到最低值,且差异不显著。随 NaC l质量浓度的提高及处理时间的延长,各处理组海滨木槿叶片的可溶性糖含量或高于对照组或低于对照组,没有一定的变化趋势,推测可溶性糖在海滨木槿渗透调节过程中可能没有发挥主要作用,这一现象也可能与海滨木槿不同生长期体内的代谢差异有关。
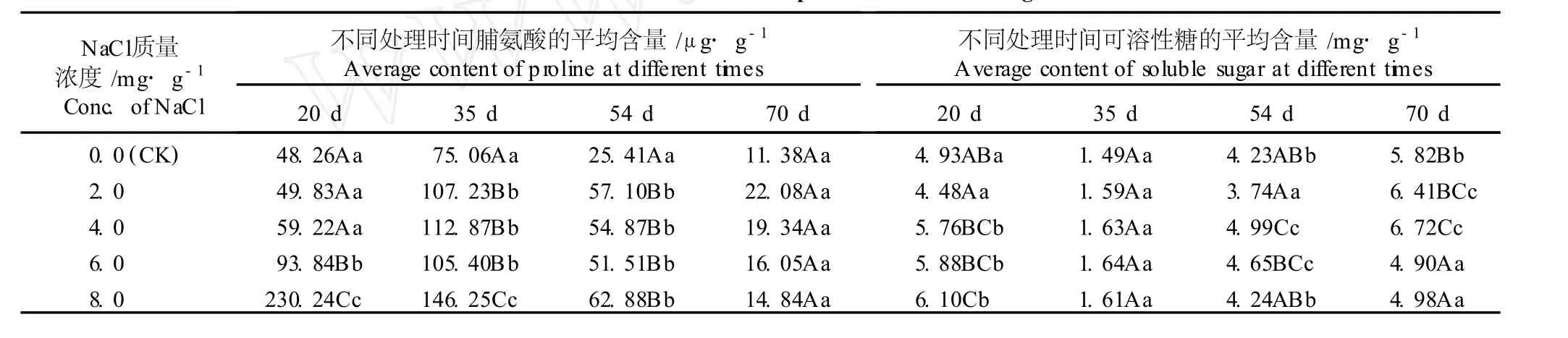
表 3 不同质量浓度 NaC l胁迫对海滨木槿叶片脯氨酸和可溶性糖含量的影响1)Tab le 3 Effect of NaC l stressw ith d ifferen t concen tra tion s on con ten tsof proline and solub le sugar in lea f of H ibiscus ham abo Sieb.et Zucc.1)
2.4 NaC l胁迫对海滨木槿叶片中 SOD和 POD活性的影响
在植物的活性氧清除系统中,重要保护酶包括SOD、POD和 CAT等,其中,SOD是植物体内最主要的一种保护酶,具有清除氧自由基的作用,以减轻逆境对植株的伤害[11];而 POD可以清除植物细胞内产生的过氧化氢,从而减少细胞膜过氧化产物MDA的积累[12]。NaC l胁迫条件下海滨木槿叶片 SOD活性和 POD活性的影响见表4。
如表 4所示,随处理时间的延长,各处理组及对照组海滨木槿叶片的 SOD活性总体上呈先升高后降低的趋势,且各处理组的 SOD活性均高于对照组。在处理的第 20天,2.0~6.0m g·g-1NaC l胁迫处理组的 SOD活性高于对照组,而 8.0m g·g-1NaC l胁迫处理组的 SOD活性则低于对照组,但差异均不显著(P>0.05),说明此时 SOD的活性还未被激活;在处理的第 35天,各处理组及对照组的 SOD活性开始升高,但 2.0~8.0m g·g-1NaC l胁迫处理组的 SOD活性均极显著高于对照组 (P<0.01),分别比对照组提高了 31%、112%、147%和 188%,说明此时受逆境的诱导 SOD活性增强;在处理的第 54天,各处理组及对照组的 SOD活性增加至最高,但 2.0~8.0mg·g-1NaCl胁迫处理组的SOD活性均显著高于对照组 (P<0.05),较对照组分别提高了 21%、8%、15%和 10%;在处理的第 70天,各处理组及对照组的 SOD活性均有所下降,但各处理组的 SOD活性仍极显著高于对照组。上述结果说明,在受到NaC l胁迫后,海滨木槿叶片中的抗氧化酶系统被激活,其中 SOD在清除氧自由基的过程中活性较高、持续时间较长,从而减小了氧自由基对膜的伤害,这可能是海滨木槿耐 NaC l胁迫的主要机制之一。
由表 4还可见,随处理时间的延长,各处理组及对照组海滨木槿叶片的 POD活性总体上呈先大幅度降低然后逐渐提高的趋势,且各处理组的 POD活性基本上均高于对照组。在 2.0m g·g-1NaC l胁迫条件下,海滨木槿叶片的 POD活性在处理的 54 d内均与对照组无显著差异 (P>0.05);而在处理的第 70天,POD活性才极显著高于对照组 (P<0.01),为对照组的 2.0倍。在 4.0m g·g-1NaC l胁迫条件下,在处理的 35 d内 POD活性较对照组略有升高,但差异不显著(P>0.05);而在处理的第 54和第 70天,POD活性极显著高于对照组 (P<0.01),均为对照组的 1. 5倍左右。在 6.0和 8.0m g·g-1NaC l胁迫条件下,叶片的 POD活性均极显著高于对照组(P<0.01),且NaC l质量浓度越高,与对照组的 POD活性差异越大;在胁迫处理的第 20、第 35、第 54和第 70天,6.0和8.0m g·g-1NaCl处理组的POD活性分别是对照组的 1.4、3.3、1.8、1.9和 2.1、3. 9、2.0、2.1倍。由此可见,在 NaC l胁迫条件下,海滨木槿叶片的 POD活性均高于对照组,表明NaC l胁迫激发了 POD的活性,提高了细胞清除活性氧的能力,减少过氧化氢对细胞的伤害,保护了细胞的完整性。
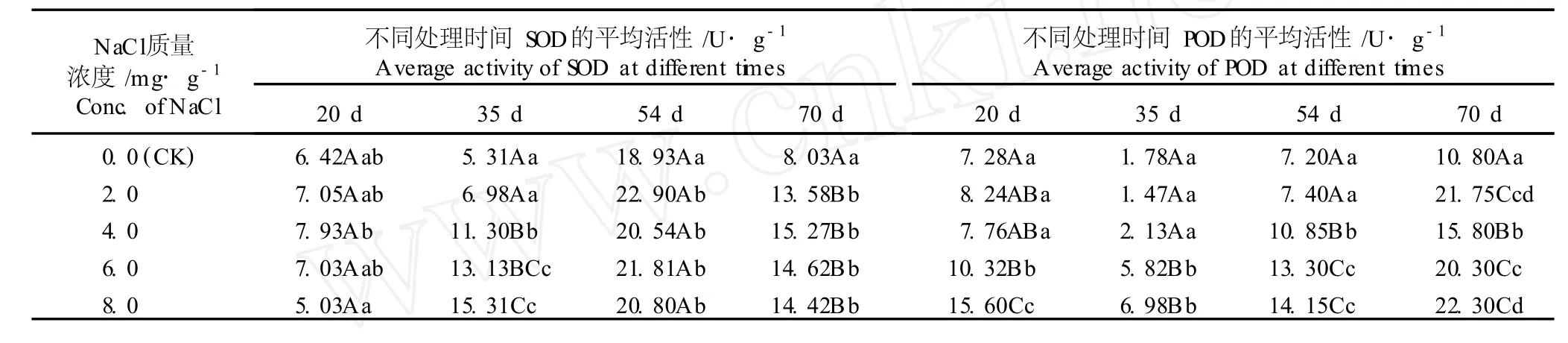
表4 不同质量浓度 NaC l胁迫对海滨木槿叶片 SOD和 POD活性的影响1)Tab le 4 Effect of NaC l stressw ith d ifferen t concen tra tion s on activ ities of SOD and POD in lea f of H ib iscus ham abo Sieb.et Zucc.1)
3 讨论和结论
叶绿体是植物光合作用的场所,也是对盐胁迫最敏感的细胞器[13]。实验结果表明,随 NaC l胁迫时间的延长,海滨木槿叶片中的叶绿素含量呈先升高后降低的趋势;在 2.0和 4.0m g·g-1NaC l胁迫条件下海滨木槿叶片的叶绿素含量高于对照组,而在 6.0和8.0m g·g-1NaC l胁迫条件下,除处理的第 35天外,其他时间段叶片的叶绿素含量均低于对照组。据此可推测:海滨木槿叶片中叶绿素的含量增加可能与低浓度NaC l胁迫条件下植物叶片含水量过低、生长缓慢有关,即产生相对的浓缩效应[14];高浓度 NaC l胁迫条件下叶绿素含量的降低可能是由于在此条件下叶片的叶绿素酶活性增强[15],促进了叶绿素分解,使叶片中叶绿素的合成减少;而在第 35天时各处理组叶片的叶绿素含量高于对照组,可能是由于海滨木槿的生长旺盛,叶绿素合成速率大于分解速率。
电解质渗出率和MDA含量均可反映细胞膜的伤害程度[16-17]。从实验结果中可知,随着 NaC l胁迫时间的延长,2.0和 4.0 m g·g-1NaC l胁迫处理组海滨木槿叶片的电解质渗出率与对照组间几乎没有显著差异,6.0和 8.0m g·g-1NaC l胁迫处理组的电解质渗出率显著高于对照组;在 2.0~8.0 m g·g-1NaC l胁迫条件下,海滨木槿叶片的MDA含量仅在第 35天时显著高于对照组,其他时间段的MDA含量基本与对照组间差异不显著。从伤害程度上来看,2.0~8.0 m g·g-1NaC l胁迫处理对海滨木槿的伤害程度不明显,且随胁迫时间的延长逐渐激发出海滨木槿对NaCl胁迫伤害的自我修复潜力。
渗透胁迫是盐胁迫对植物造成伤害的重要原因之一,为了避免渗透胁迫,植物细胞通过渗透调节来降低胞内水势、保持胞内水分,从而保证植物细胞的正常生理活动,其中脯氨酸和可溶性糖都是重要的渗透调节物质[18]。本实验结果表明,随 NaCl胁迫时间的延长,2.0~8.0m g·g-1NaC l胁迫条件下海滨木槿叶片中脯氨酸含量先急剧增加然后逐渐降低,且除处理的第 70天外,其余时间段各处理组的脯氨酸含量均显著高于对照组,且有随 NaC l质量浓度的提高脯氨酸含量增加的变化趋势;而随 NaC l质量浓度的提高以及处理时间的延长,各处理组海滨木槿叶片中可溶性糖含量的变化没有表现出一定的规律性。这说明在NaC l胁迫条件下,为降低植物组织中水分的外渗及维持植物正常的生理代谢,海滨木槿叶片中的脯氨酸在渗透调节过程中起主要的调节作用,可溶性糖的作用为辅。
SOD和 POD是活性氧清除系统中重要的保护酶[19],不同植物不同盐胁迫下保护酶活性变化方向和幅度不同[20]。实验结果显示,随 NaC l胁迫时间的延长,2.0~8.0m g·g-1NaC l胁迫处理组中海滨木槿叶片的 SOD活性呈先升高后降低的趋势,而 POD活性呈先降低后升高的趋势,结合叶片中MDA含量先增加后降低的变化特点,说明在 NaC l胁迫条件下SOD和 POD活性的增强有效清除了细胞中的活性氧、降低了MDA的含量;而当逆境胁迫超过植物自身的耐性时,可导致氧化酶系统遭到破坏。
综上所述,在NaC l胁迫条件下,海滨木槿叶片中SOD和 POD活性增强,且持续时间较长;随 NaC l胁迫时间的延长,脯氨酸含量和MDA含量降低、叶绿素含量略有增加,表明海滨木槿具有一定的自我修复能力,使自身的受害程度降低,从而逐渐适应NaC l胁迫环境。由此可知,海滨木槿具有较强的耐 NaC l胁迫的能力,经过更进一步的开发研究,可用于滨海滩涂以及盐碱地的改良和绿化。
[1]俞慈英,徐树华.海滨木槿的驯化及开发利用前景[J].林业科学研究,1999,12(2):210-213.
[2]紫 云.海滨奇葩——海滨木槿[J].浙江林业,2003(1):41.
[3]杨 帆,丁 菲,杜天真,等.构树抗氧化酶系统对盐胁迫的响应[J].浙江林业科技,2008,28(1):1-4.
[4]王宇超,王得祥,彭少兵,等.盐胁迫对木本滨藜植物细胞膜透性及生理特性的影响[J].干旱地区农业研究,2007,25(4): 225-229.
[5]彭运生,刘 恩.关于提取叶绿素方法的比较研究[J].北京农业大学学报,1992,18(3):247-250.
[6]李合生.植物生理生化实验原理和技术[M].1版.北京:高等教育出版社,2000:34-56.
[7]任艳芳,何俊瑜.NaCl胁迫对莴苣幼苗生长和光合性能的影响[J].华北农学报,2008,23(4):149-153.
[8]赵 昕,吴雨霞,赵敏桂,等.NaC l胁迫对盐芥和拟南芥光合作用的影响[J].植物学通报,2007,24(2):154-160.
[9]Strogonov B P.Structure and Function of Plant Cells in Saline Habitats[M].New York:Halsted Press,1973:78-83.
[10]李影丽,汪奎宏,许利群,等.舟山新木姜子盐胁迫下生长变化及生理反应[J].浙江林业科技,2008,28(2):48-51.
[11]马翠兰,刘星辉,王湘平.盐胁迫下琯溪蜜柚苗木生理生化特性的变化研究 [J].中国生态农业学报,2007,15(1):99-101.
[12]李 妍.盐胁迫对中华补血草生长和保护酶活性的影响[J].种子,2007,26(12):76-79.
[13]刘建福.NaC l胁迫对澳洲坚果叶片生理生化特性的影响[J].西南师范大学学报:自然科学版,2007,32(4):25-29.
[14]乔慧萍,李建设,雍立华,等.植物盐胁迫生理及其适应性调控机制的研究进展[J].宁夏农林科技,2007,10(3):34-36, 24.
[15]吴 敏,薛 立,李 燕.植物盐胁迫适应机制研究进展[J].林业科学,2007,43(8):111-117.
[16]汪月霞,孙国荣,王建波,等.NaC l胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系 [J].生态学报, 2006,26(1):122-129.
[17]孙国荣,关 旸,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J].草地学报,2001,9(1):34-38.
[18]王树凤,陈益泰,徐爱春.盐胁迫对 2种珍贵速生树种种子萌发及幼苗生长的影响 [J].植物资源与环境学报,2007,16 (1):49-52.
[19]薄鹏飞,孙秀玲,孙同虎,等.NaC l胁迫对海滨木槿抗氧化系统和渗透调节的影响[J].西北植物学报,2008,28(1): 0113-0118.
[20]谢一青,李志真,黄儒珠,等.盐胁迫对Frankia生长和生理生化特性的影响[J].植物资源与环境学报,2006,15(1):9-13.

