一种新型唾液sIgA电流型纳米免疫生物传感器的制备*
王 艳,甄生航,郑 军,马 霄,刘成桂,朱 洋,谢国明
(重庆医科大学检验系临床检验诊断学教育部重点实验室,重庆400016)
0 引言
近年来,由于纳米金(GNPs)除了具备纳米材料共有的比表面积大、表面反应活性高、有宏观量子隧道效应等良好催化性质外,还具有独特的亲水性和生物相容性,因而,被广泛用于生物传感器的制备[3,4]。本研究采用将电化学分析的灵敏性和免疫反应的特异性相结合的免疫传感技术[5]及有放大电流效应的纳米金技术,利用层层自组装将电子介体硫堇和sIgA抗体连接到电极表面,构建了一种新型的唾液sIgA电流型纳米免疫传感器,并初步应用于临床标本的检测。这为建立一种快速、简便、无创唾液sIgA检测新方法奠定了基础。
1 实验
1.1 纳米金的制备
采用鞣酸—柠檬酸钠还原法制备[6],自然冷却后存于棕色瓶中备用,所得金溶胶为酒红色,用透射电子显微镜表征,其平均直径约为20 nm。
1.2 纳米免疫传感器的制备
1.2.1 Nafion—硫堇—纳米金修饰玻碳电极的制备
玻碳电极经0.3μm的Al2O3粉末抛光成镜面,在蒸馏水、无水乙醇、蒸馏水中各超声洗涤10 min,洗净晾干待用。将5%的Nafion溶液用无水乙醇稀释到1%,取10μL滴到预处理后的电极表面,室温晾干成膜,然后,浸入含3 mmol/L 的硫堇醋酸缓冲溶液(Hac-NaAc,0.1 mol/L,pH=6.0)中在-0.4~0.1 V的电压范围内进行CV扫描,扫描速度为50 mV/s,持续扫描至得到稳定的CV图,再浸入0.5 mL纳米金—壳聚糖混合溶液6 h。然后,依次重复吸附硫堇和纳米金,至达到饱和状态。
1.2.2 唾液sIgA免疫传感器的制备
将电极置于唾液sIgA抗体中4℃下浸泡过夜,最后将电极浸入0.25%HRP溶液2 h,以封闭电极上的非特异吸附位点,制备好的电极悬于醋酸缓冲溶液上方,4℃下保存备用。
1.3 纳米免疫传感器对唾液sIgA的检测
用循环伏安法和计时安培法检测,采用三电极系统,Nafion/{Thi/GNPs-CHIT}n/anti-sIgA/HRP(n为自组装层数)修饰的GCE为工作电极,铂丝为对电极,Ag/AgCl电极作为参比电极。在被检标本中孵育8 min后,再在25mL含26 mmol/L H2O2的醋酸缓冲液(pH=6.0)中进行CV检测,其响应电流随标本中sIgA浓度的增加而不断减小。标准曲线中每个浓度重复测量3次,求电流均值,唾液sIgA浓度大于300 mg/L时,需稀释后检测。
2 实验结果与分析
2.1 传感器电极表面层层自组装纳米金颗粒
图1为纳米金层层自组装和sIgA抗体的固定过程。实验中,利用胶体金与硫堇存在强的S—金属配位键作用,反复吸附实现了层层自组装使比表面积急剧增大,极大地提高了传感器中抗体的固定量,从而提高检测的灵敏度和检测下限。
师:同学举例说到生活中有各种各样的长方体形状的物体,那么请同学们不用眼睛看,从学具袋中,摸出一个长方体的模型并观察你手中的长方体,说说你对长方体有什么认识?
同时,本实验用透射电子显微镜对电极修饰进行了表征(见图2),由TEM图可见,与(a)图相比,(b)图加入壳聚糖溶液后纳米金颗粒分散更均匀。
2.2 唾液sIgA免疫传感器电极的电化学性能
如图3所示,用循环伏安法研究了制备过程中不同修饰电极的电化学特性。在图3(a)中,曲线a由于体系中缺少电子媒介体,Nafion膜修饰的玻碳电极在醋酸缓冲液中只有平坦的CV图。曲线b为电极修饰一次硫堇和纳米金,可观察到一对硫堇的氧化还原峰,说明进入膜内的硫堇可以有效地传递电子[7]。曲线c为修饰3层硫堇和纳米金后,电极的峰电流进一步增大。曲线d是修饰电极吸附sI-gA抗体后,峰电流有所下降,是因为蛋白质分子的空间位阻效应,阻碍了电子的传递。最后,用HRP封闭电极上的非特异吸附位点,与曲线d相比曲线e峰电流值有所下降,表明HRP已成功吸附到电极表面。
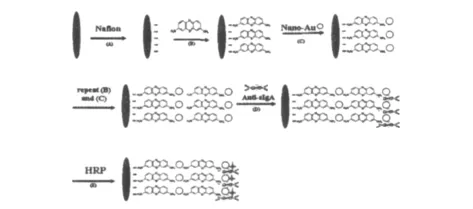
图1 唾液sIgA免疫传感器制作流程图Fig 1 Flow chart of salivary sIgA immunosensor fabrication

图2 纳米金与壳聚糖混合溶液的透射电镜图Fig 2 TEM image of GNPs-CHIT
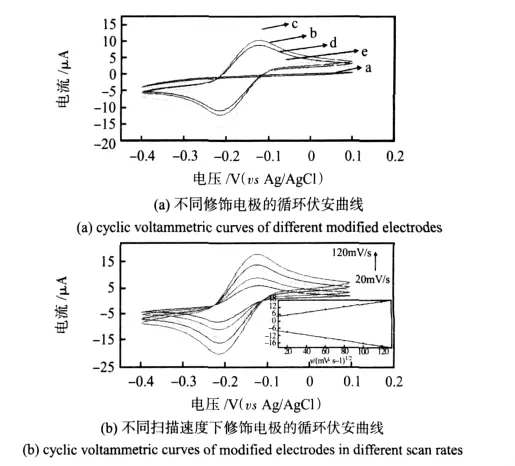
图3 修饰电极的电化学特性Fig 3 Electrochemistry characteristic of modified electrodes
图3(b)是免疫传感器在不同扫描速度下的CV图。由图可知,随扫描速度从20~120 mV/s变化,固定在Nafion膜中的硫堇峰形可逆性好,氧化峰电流ipa和还原峰电流ipc不断增加,ipa/ipc约为1,ipa和 ipc与扫描速度的平方根 v1/2/(mV·s-1)1/2成正比,线性方程为ipa=4.858 13v1/2+0.110024R=0.99644;ipc=-4.862 73v1/2-0.114244 R=-0.99534,表现出明显的扩散电流特征;峰位置基本不变,氧化峰电位和还原峰电位之差为80mV,表明膜中的硫堇能很好地传递电子。因此,抗体修饰膜的存在不影响介体的电化学性质。
2.3 HRP的电化学催化特性
图4为该传感器加入H2O2前后的循环伏安图。曲线a为加入H2O2之前CV图呈现对称的氧化还原峰。加入26 mmol/L的底物之后,还原峰增加,氧化峰减低(曲线b),说明HRP成功地吸附到电极表面后仍保持催化活性。曲线c是该传感器与100 mg/L sIgA标准品发生免疫反应,在含有26 mmol/L底物的缓冲液中得到的CV图,可见峰电流值明显降低,说明固定在电极表面的anti-sIgA与sIgA标准品发生了免疫反应,由于抗原抗体复合物的空间位阻作用,降低了HRP的催化活性,阻碍了电极表面与底物溶液间的电子传递。以上结果说明用HRP封闭电极上的非特异吸附位点简单可行。
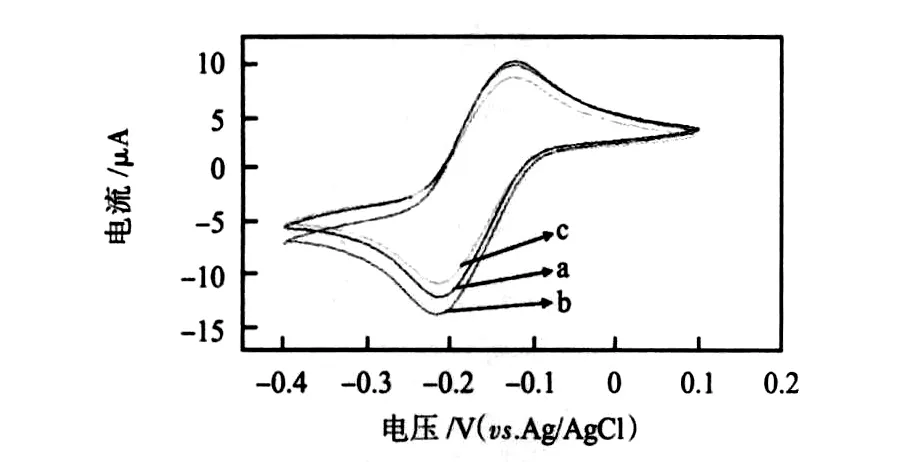
图4 免疫传感器对H 2 O2的循环伏安响应曲线Fig 4 Cyclic voltammetric response curves of immunosensor vs H2 O2
2.4 免疫传感器的响应特性
2.4.1 抗体工作浓度与底物浓度的确定
为了探讨LBL法固定抗体的最适工作浓度,把1 g/L的抗体稀释成不同浓度,观察抗体浓度与抗体固定量的关系。结果表明抗体的固定量随浓度的增加而增大,在抗体浓度达到1g/L时固定量最大,因此,抗体工作浓度选择1g/L。
采用计时电流法对H2O2的浓度对电极的响应性能的影响做了研究。实验结果表明:生物传感器在1.0~26.0 mmol/L之间响应电流线性升高。大于26.0 mmol/L时响应电流开始下降,说明在此范围内固定在电极上的HRP具有强的催化活性。因此,实验中底物量为26 mmol/L。
2.4.2 pH和温度对免疫传感器的影响
pH影响抗体和酶的活性和稳定性,因此,缓冲液的pH值对传感器的性能影响很大。选择醋酸缓冲溶液,在pH为4.5~7.5范围内考察了对催化性能的影响。相同条件下pH为6.0时,传感器的响应电流最大。因此,采用醋酸缓冲液(0.1 mol/L,pH=6.0)作为测定反应液。
温度对免疫反应速率影响很大,在低于最适温度时,温度升高反应速度加快;而高于最适温度时,温度升高反应速度反而减慢,甚至发生蛋白的变性。实验表明:当温度在(37±1)℃,该传感器抗原抗体反应达到平衡的时间最短,而且,响应电流最大。因此,实验测试温度为37℃。
2.4.3 抗原抗体反应时间对传感器的影响
将该电极与100 mg/L的sIgA标准品在室温下依次孵育 2,5,8,10,12,15,18,20 min 后,在25 mL 含有底物—醋酸缓冲液中进行CV检测。结果发现,在开始的8 min内响应电流逐渐降低,8 min后电流趋于稳定,表明电极基本饱和。因此,选择8 min为孵育时间。
2.5 生物传感器的检测范围、检出限、响应时间
如图4该传感器在-0.4~0.1 V范围进行CV扫描时,在-0.21 V处ipc最大,因此,工作电位定为-0.21 V。图5为该传感器对不同浓度sIgA响应的计时电流图。从图中可知,传感器响应速度快,达到95%稳态响应时间不超过20 s。插图为传感器检测sIgA所得结果的拟合曲线。由图可知,传感器的响应电流与sIgA在6.5~300 mg/L之间呈良好的线性关系。电流与sIgA浓度(C)遵循以下关系:i(μA)=8.69093+0.08433C(mg/L),相关系数 R 为0.99233。检出限为3.0 mg/L,表明传感器有较好的检测灵敏度。
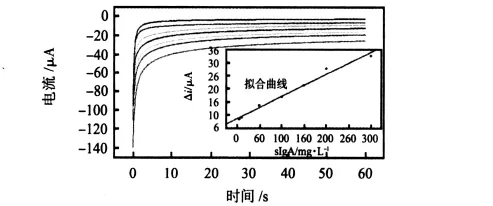
图5 生物传感器对sIgA响应的计时电流图Fig 5 Chronoamperometric current response curves of biosensor vs sIgA
2.6 干扰实验
用该免疫传感器检测唾液中高丰度蛋白IgG,IgM,α—淀粉酶、白蛋白等,将这几种干扰物分别加入到100 mg/L的sIgA标准溶液中,与加入前比较。结果表明:两者响应电流基本无变化。说明该传感器可以有效消除假阳性。
2.7 生物传感器的重复性、稳定性、再生性
用购于Abcam公司的sIgA标准品作为高值检测样本,用生理盐水(8.5 g/L,0.9%)稀释50倍作为低值标准品,重复测量20次,高值、低值的批内 CV分别为2.76%,3.13%;每天上午和下午各测一次,连续10 d,得到的批间CV分别为3.57%,4.39%。该传感器不用时,洗净晾干,悬于醋酸缓冲液上方4℃保存,每隔5 d对同一电极在相同条件进行测量,经过6次测量响应电流下降为初始的86.7%。用过的传感器用0.1 mol/L甘氨酸再生,甘氨酸能使抗原抗体复合物解离,解离后的抗原或抗体分子仍保持原来的理化特性和生物学活性。但结果显示,再生的电极响应电流有下降趋势,再生7次后响应电流下降为开始的75%左右。以上结果表明该传感器具有较好的重复性、稳定性和再生性。
2.8 初步临床应用
利用该传感器检测了30例临床唾液标本,取受试人员自然流出唾液1.0 mL,用生理盐水稀释100倍,每例待检稀释样品取1.0 mL加入24.0 mL底物—醋酸缓冲液中检测,准确反应8 min。同时,采用ELISA方法进行平行检测,结果经线性相关分析后得散点图(图6)。统计结果显示:本法检测结果与ELISA法具有良好的相关性(R=0.98932,P<0.001)。
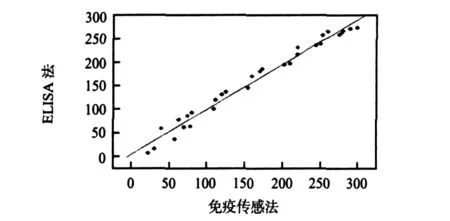
图6 免疫传感器方法与ELISA法相关性分析散点图Fig 6 Scatterplot of correlation analysis on methods of immunosensor and ELISA
3 结论
本研究利用LBL技术将硫堇和纳米金修饰在电极表面,并成功地固定了唾液sIgA抗体,制备了一种新型的唾液sIgA电流型纳米免疫传感器,该传感器制作简单,性能稳定,能够对唾液sIgA进行快速、准确和特异的定量测定,有望在临床推广应用。
[1]Diebel L N,David M D,Liberati M,et al.A comparative study of secretory immunoglobulin A and immunoglobulin G in host defense in an in vitro pneumonia model[J].The American Journal of Surgery,2006,191:386-390.
[2]Jemmott III J B,McClelland D C.Secretory IgA as a measure of resistance to infectious disease:Comments on stone,cox,valdimarsdottir,and neale[J].Behavioral Medicine,1989,15:63-71.
[3]姜先果,诸富根.纳米金膜对巯基化合物的吸附特性研究[J].传感器与微系统,2008,27(1):39-40.
[4]Pingarro J M,Yanez-Sedeno P.Alcohol dehydrogenase amperometric biosensor based on a colloidal gold-carbon nanotubes composite electrode[J].Electrochimica Acta,2008,53(11):5848-5866.
[5]Calvoa E J,Danilowicz C,Lagier C M,et al.Characterization of selfassembled redox polymer and antibody molecules on thiolated gold electrodes[J].Biosensors and Bioelectronics,2004,19:1219-1228.
[6]Frens G.Controlled nucleation for the regulation of theparticlesize in monodisperse gold suspension[J].Nature Phy Sci,1973,241:20-22.
[7]Cheng W L,Jiang J G,Dong S L,et al.Alternate assemblies of thionine and Au-nanoparticles on an amino functionalized surface[J].Chem Commun,2002,16(16):1706-1707.

