四取代羧基酞菁锌与白蛋白共价结合物的制备与光谱性质
肖荣平 柯美荣 黄剑东 张汉辉
(福州大学化学化工学院,福州 350108)
四取代羧基酞菁锌与白蛋白共价结合物的制备与光谱性质
肖荣平 柯美荣 黄剑东*张汉辉*
(福州大学化学化工学院,福州 350108)
通过成酰胺键的方式制备了一系列含羧基酞菁和白蛋白(牛血清白蛋白(BSA),人血清白蛋白(HSA))之间的共价结合物,所涉及到的酞菁分别是α-四(4-羧基苯氧基)酞菁锌(1)和α-四[4-(2-羧基乙基)苯氧基]酞菁锌(3),以及它们相应的β位四取代酞菁锌(化合物2和4).比较了游离酞菁以及它们的白蛋白结合物在磷酸盐缓冲溶液(PBS)中的光谱性质.结果表明,当酞菁被共价固定于白蛋白大分子上之后,展现出比游离酞菁更明显的单体特征吸收,而且结合物中的酞菁光谱特征不受体系pH值变化的影响.羧基在酞菁环上的取代位置,对酞菁与白蛋白结合前后的光谱转变幅度有影响,α位取代比β位取代更有利于光谱的变化.化合物1和3的白蛋白共价结合物在PBS溶液中甚至呈现出单体形式为主的光谱特征,Q带最大吸收波长分别位于697和706 nm附近.
酞菁;白蛋白;共价结合;光谱性质;光敏剂
光动力治疗(photodynamic therapy,简称PDT)有望发展成为治疗肿瘤的一种常规方法.光动力治疗的关键之一是光敏剂,临床上使用的第一代光敏剂主要是以Photofrin®为代表的血卟啉衍生物,但它们存在着有效成分复杂,皮肤光毒副作用大等严重缺陷,因此寻找新型光敏剂的研究工作备受重视[1-2].
由于具有在光疗窗口吸收强度高、光敏化能力强、暗毒性低和易于化学修饰等特点,酞菁衍生物作为第二代光敏剂的研究已引起广泛的重视[3-6].现在已有几种酞菁基光敏剂获准进入临床试用,包括福州大学研制的ZnPcS2P2(即Photocyanine)[7].深入研究酞菁基光敏剂的构效关系和作用机理,寻找提高靶组织选择性的有效方法,是当前该领域的研究热点.最近我们课题组[8]合成了几种具有光敏活性的含羧基酞菁锌,并研究了取代基类型和取代位置对离子光动力抗癌活性的影响.在此基础上,本文利用含羧基酞菁的活性基团羧基,通过成酰胺键的方式制备了一系列高水溶性的、未见报道的酞菁-白蛋白共价结合物,并着重研究了结合物的光谱性质,希望能对构建具有靶向功能的酞菁类光敏剂提供有益启示.白蛋白是一种水溶性的运载蛋白,已有研究表明其可提高抗癌药对某些癌细胞的靶向性[9-11].关于酞菁-白蛋白的复合物已有文献报道[10-16],但大都是通过非共价键的方式结合,对于通过共价键结合的酞菁-白蛋白结合物的研究还极少,共价结合物的光谱性质、光动力活性和构效关系仍有待进一步揭示.
1 实验部分
1.1 仪器与试剂
T6紫外可见分光光度计,北京普析通用仪器有限责任公司;FL900/FS920型稳态和瞬态荧光光谱仪,英国Edinburgh分析仪器公司;Spectrum 2000型傅里叶变换红外光谱仪(采用KBr压片法),美国Pekin Elmer公司;冷冻离心机,Thermo Scientific公司;PB-20 pH计,北京赛多利斯仪器系统有限公司.
N,N′-二环己基碳二亚胺(DCC),96%(w),中国医药集团上海化学试剂公司产品;N-羟基琥珀酰亚胺(NHS),98%(w),Alfa Aesar公司产品;牛血清白蛋白(BSA)系中国医药集团上海化学试剂公司产品,人血清白蛋白(HSA)为美国Sigma公司产品,纯度均为生物化学试剂级;葡聚糖凝胶Sephadex G-100,美国Sigma公司产品;考马斯亮蓝G-250,美国Fluka公司产品;透析袋,分子量为8000-12000,北京沃德塞斯生物公司产品;所用其它溶剂为中国医药集团上海化学试剂公司分析纯产品.
本文所涉及到的四种含羧基酞菁分别为α-四(4-羧基苯氧基)酞菁锌(记为1)、β-四(4-羧基苯氧基)酞菁锌(记为2)、α-四[4-(2-羧基乙基)苯氧基]酞菁锌(记为3)、β-四[4-(2-羧基乙基)苯氧基]酞菁锌(记为4).这四种酞菁均为本实验室所合成[8],其结构如图1所示,化合物1、3是α位四取代化合物,而2、4是对应的β位四取代物.
1.2 酞菁-白蛋白共价结合物的制备
称取α-四(4-羧基苯氧基)酞菁锌(化合物1)6.9 mg和N,N′-二环己基碳二亚胺(DCC)7.9 mg溶于800 μL的二甲基甲酰胺(DMF)中避光搅拌2 h后,加入N-羟基琥珀酰亚胺(NHS)3.5 mg,继续避光搅拌反应4 h,得到羧基酞菁的N-琥珀酰亚胺酯衍生物.
称取牛血清白蛋白(BSA)40.2 mg溶于4000 μL的PBS缓冲液(pH 7.4)中,在冰水浴中充分搅拌使之溶解.然后,将上述得到的羧基酞菁的N-琥珀酰亚胺酯衍生物缓慢地滴加到BSA溶液中,在冰水浴中不断地搅拌,避光反应过夜.
6℃下离心除去不溶的沉淀物,移取上层溶液过凝胶柱(Sephadex G-100,柱长21 cm,柱内径1.8 cm),用PBS缓冲溶液洗脱分离,收集前面的蓝色洗脱液,冷藏待用.将收集液装入透析袋中,用去离子水在4℃下透析两天,期间每12 h换水一次,之后冷冻干燥,-20℃保存.

图1 酞菁的结构示意图Fig.1 Scheme for structures of phthalocyanines

示意图1 酞菁-白蛋白结合物的合成Scheme 1 Synthesis of the albumin conjugate of phthalocyanine(Pc)
其它酞菁-白蛋白共价结合物按上述方法制得.
1.3 酞菁-白蛋白共价结合物的摩尔组成比的测定
结合物中白蛋白的含量用考马斯亮蓝法(简称CBB法)测定[17].酞菁配合物的含量则通过电子吸收光谱法测定:将结合物稀释到DMF溶液中,通过Q带的吸光度来计算酞菁含量.相应酞菁1的摩尔吸光系数为1.79×105mol-1·L·cm-1(686 nm),2为1.94× 105mol-1·L·cm-1(674 nm),3为2.05×105mol-1·L·cm-1(695 nm),4为1.82×105mol-1·L·cm-1(679 nm)[8].
1.4 电子吸收光谱
25℃下,以PBS缓冲溶液(pH 7.4)为参比,用稀释法配制相应浓度的溶液,记录300-800 nm的电子吸收光谱.
2 结果与讨论
2.1 制 备
图1所示的四种酞菁均含有羧基,因此可以利用该活性基团和白蛋白上的自由氨基通过成酰胺键的方式来制备酞菁-白蛋白的共价结合物.合成路线如示意图1所示,首先,通过DCC将酞菁的羧基活化,而后,通过NHS将其进一步转化为琥珀酰亚胺酯衍生物,转化后的中间体是活性物质可以在温和条件下与氨基成酰胺键,该合成路线经常用于制备含羧基的有机分子与含氨基的蛋白质的共价偶联物[18-19].
根据反应原理,反应产物中应包括酞菁-白蛋白结合物和游离酞菁.由于在本实验中,酞菁和白蛋白的投料摩尔比为10∶1(即酞菁充分过量),因此反应产物中应不含游离蛋白或游离蛋白的含量极少.
利用凝胶色谱对目标产物进行分离纯化,并通过测量洗脱组分在相应酞菁Q带最大吸收波长处的吸光度和340 nm处的荧光强度(此为白蛋白的内源荧光,用280 nm光激发)来监控分离过程.图2显示了其中一个结合物(1-BSA)的分离洗脱曲线,10-20 mL对应的洗脱组分既有697 nm的酞菁吸收又有340 nm的白蛋白荧光,且分子量最大,应为酞菁-白蛋白共价结合物,而35-43 mL的洗脱组分只显示有697 nm的吸收而未有340 nm的荧光,应为游离的酞菁1.
对于分离纯化后的结合物,通过电子吸收光谱法和考马斯亮蓝法测定酞菁和白蛋白的含量,求得结合物中二者的摩尔组成比,结果列于表1.从中可见,当酞菁/白蛋白投料摩尔比相同(均为10∶1)时,四种酞菁与两种白蛋白之间形成的共价结合物的组成比基本上是相当的,大约为(6-7)∶1(酞菁/白蛋白),说明本文中羧基苯氧基与羧基乙基苯氧基的区别以及官能团在酞菁环上的位置差异(α位取代和β位取代)对白蛋白负载羧基酞菁的能力没有显著影响,也说明两种白蛋白BSA和HSA之间的差异对共价结合物的组成比没有显著影响.
本文获得的共价结合物的摩尔组成比为(6-7)∶1,即每分子白蛋白负载6-7个酞菁分子,假设每个酞菁的4个羧基全部与白蛋白共价结合,那么白蛋白需要提供24-28个自由氨基,这在理论上是允许的, HSA含有59个赖氨酸残基[20],即可提供59个自由氨基,而BSA则可提供61个自由氨基[21].共价结合物的形成,也可从红外光谱中得到印证:游离酞菁在1695 cm-1处出现可归属于羧基中的羰基伸缩振动的特征吸收峰,而在酞菁-白蛋白共价结合物的红外光谱中,1695 cm-1处的吸收峰强度大幅下降,但在1653 cm-1处出现可归属于酰胺键的羰基伸缩振动的强吸收峰.

图21 -BSA结合物的洗脱曲线Fig.2 Elutionprofilesof1-BSAconjugateasmonitoredabsorbance at 697 nm and fluorescence emission at 340 nm upon excitation at 280 nm

表1 酞菁-白蛋白结合物的摩尔组成比Table 1 Molar ratio of phthalocyanine to albumin in the phthalocyanine-albumin conjugates
2.2 电子吸收光谱与存在状态
电子吸收光谱是抗癌光敏剂产生光动力治疗效应的基础之一.因此,本文着重比较了所制备的酞菁-白蛋白结合物和游离酞菁在模拟生理溶液PBS中的电子吸收光谱,结果列于图3-5和表2.
图3是化合物1在DMF、40%DMF水溶液(体积比)和PBS溶液(pH 7.4)中的电子吸收光谱.从中可见,化合物1在DMF中显示了典型的酞菁单体吸收光谱性质,尖锐且强的Q带最大吸收波长位于686 nm附近,说明化合物1在DMF中以单体形式存在.而在40%DMF水溶液和PBS溶液中,化合物1的吸收光谱发生了明显变化:686 nm附近的吸收显著下降,650 nm附近的吸收则明显上升,而且这样的光谱变化趋势随着体系水含量的增加而加剧.这说明1在含水溶液中形成面对面聚集体[22-23],聚集体的特征吸收峰相对于单体蓝移,位于650 nm附近.

图3 化合物1在DMF(a)、40%DMF/H2O(体积比)(b)和PBS(c)溶液中的电子吸收光谱Fig.3 Electronic absorption spectra of compound 1 in DMF(a),40%DMF/H2O(V/V)(b),and PBS(c) [1]=4 μmol·L-1
在水溶液中形成分子间聚集体,是酞菁这类具有大π键共轭体系物质的普遍特点.聚集体的形成提供了光敏剂激发态的一个非辐射能量衰减的有效途径,缩短了光敏剂激发态的寿命,大幅降低了光敏剂的光敏化能力[24-26].如何避免光敏剂在生理溶液中形成聚集体,一直是该领域的一个重要问题.
化合物2在PBS中的电子吸收光谱如图4所示,从图中可见,其在PBS中亦存在面对面聚集体,聚集体吸收峰位于637 nm附近,而单体吸收峰位于668 nm附近.化合物3和4在PBS中的电子吸收光谱性质分别与化合物1和2相似.四个化合物在PBS中均存在单体-聚集体平衡,聚集的程度有所不同.从单体和聚集体特征吸收强度之比Amonomer/ Aaggregate的大小,可以分析体系中单体与聚集体的相对比例,Amonomer/Aaggregate的值越小,说明聚集程度越大.从表2可知,β位四取代的2和4的Amonomer/Aaggregate分别小于对应的α位四取代物1和3,说明β位取代酞菁化合物在水溶液中更易形成聚集体.这从它们在PBS溶液中的光谱形态也可看出:化合物2和4的聚集体峰的吸收强度大于单体峰的吸收强度,而化合物1和3的情况则刚好相反.换言之,取代基位于α位,较之位于β位,更容易阻止酞菁在模拟生理溶液中形成聚集体.
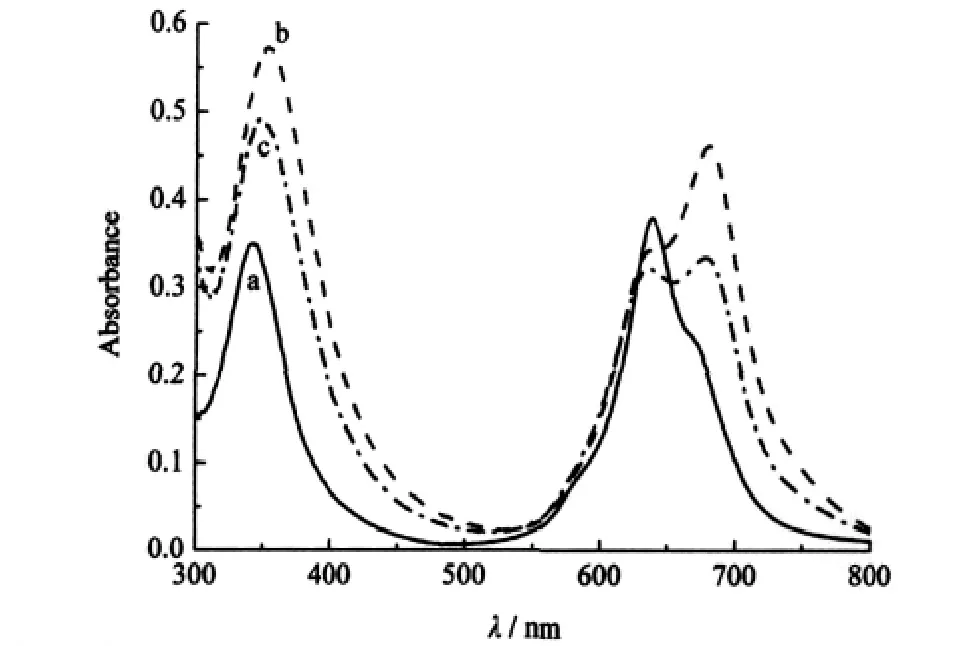
图4 化合物2(a),2-BSA(b)和2-HSA(c)在PBS溶液中的电子吸收光谱Fig.4 Electronic absorption spectra of compound 2 (a),2-BSA(b),and 2-HSA in PBS(c) [2]=6 μmol·L-1
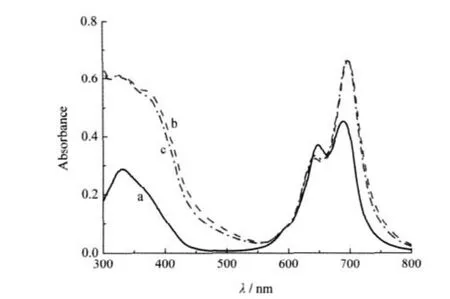
图5 化合物1(a)、1-BSA(b)和1-HSA(c)在PBS溶液中的电子吸收光谱Fig.5 Electronic absorption spectra of compound 1 (a),1-BSA(b),and 1-HSA(c)in PBS [1]=6 μmol·L-1
图5比较了1-BSA和化合物1在PBS溶液中的电子吸收光谱,从中可见,前者在650 nm附近的聚集体吸收峰下降,而在690 nm附近的单体吸收峰明显增强,Amonomer/Aaggregate为2.18,明显大于游离酞菁1的相应值(1.22,见表2).1-HSA的情况与1-BSA相似.这说明共价键合在白蛋白上的酞菁,相比于游离酞菁,在模拟生理溶液中更不易发生聚集现象.不仅如此,1-BSA(或1-HSA)在PBS溶液中的酞菁单体吸收峰还呈现出较强且相对尖锐的特点,说明1-BSA(或1-HSA)中的酞菁1主要以单体形式存在.
化合物3和化合物1均为α位四取代酞菁配合物,两者与白蛋白的共价结合物具有类似的电子吸收光谱特征,3-BSA和3-HSA在PBS溶液中亦表现出酞菁以单体形式为主的电子吸收光谱特征(见表2).这些实验结果可为解决酞菁光敏剂在生理溶液的聚集问题提供有益的启示.

表2 酞菁-白蛋白结合物在PBS溶液中的电子吸收光谱数据Table 2 Electronic absorption spectroscopic data of Pc-albumin conjugates in PBS
化合物2、4是β位四取代酞菁配合物,分别是α位四取代物1、3的位置异构体,它们与白蛋白的结合物也显示了酞菁的存在状态由聚集体向单体转化的趋势,但是转化程度较相应的α位取代物小(见图4和表2).尤其是4-BSA和4-HSA,在PBS溶液中仍然显示出酞菁以聚集体为主要存在形式的电子吸收光谱特征(即Amonomer/Aaggregate小于1).
造成这些差异的原因可能是:羧基酞菁锌通过形成酰胺键与白蛋白共价结合后,酞菁被固定在蛋白肽链中的不同位置的自由氨基上,只能在此氨基附近的狭小空间活动,有效地阻止了酞菁环之间的π-π堆积,因此酞菁-蛋白共价结合物中的酞菁比未与蛋白共价结合的游离酞菁的单体程度都要明显提高.而酞菁上的β位取代基比相应α位取代基具有更为伸展的空间排列,当形成酞菁-蛋白共价结合物后,β位取代的羧基酞菁比α位取代的羧基酞菁更有机会与邻近的酞菁产生π-π相互作用,从而增大了形成聚集体的趋势.
2.3 pH值的影响
本文还进一步考察了体系pH值对酞菁及其白蛋白结合物的电子吸收光谱性质和存在状态的影响.
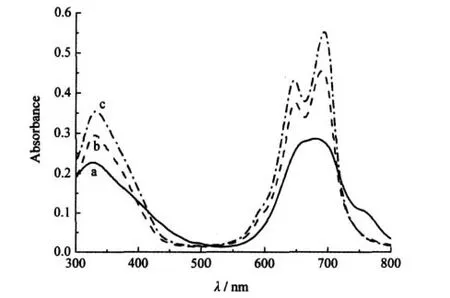
图6 化合物1在pH值为2.0(a),7.4(b)和12.0(c)的PBS溶液中的电子吸收光谱Fig.6 Electronicabsorptionspectraof1inPBSwith pH=2.0(a),pH=7.4,(b)andpH=12.0(c) [1]=6μmol·L-1)
图6为化合物1在pH值为2.0、7.4和12.0的磷酸盐缓冲溶液中的电子吸收光谱.如图6所示,对于α位四取代酞菁配合物1,在pH=2.0的磷酸盐缓冲溶液中呈现出高度聚集的特征吸收(600-800 nm之间的吸收峰宽化)特性,随着体系pH值的提高,发生较明显的解聚作用(表现为酞菁单体的特征吸收峰相对尖锐而且吸收强度增强).这应该是由于羧基COOH在pH值较高的环境下脱质子化成为COO-,带负电荷基团之间的排斥作用,促使了酞菁环之间的解聚.
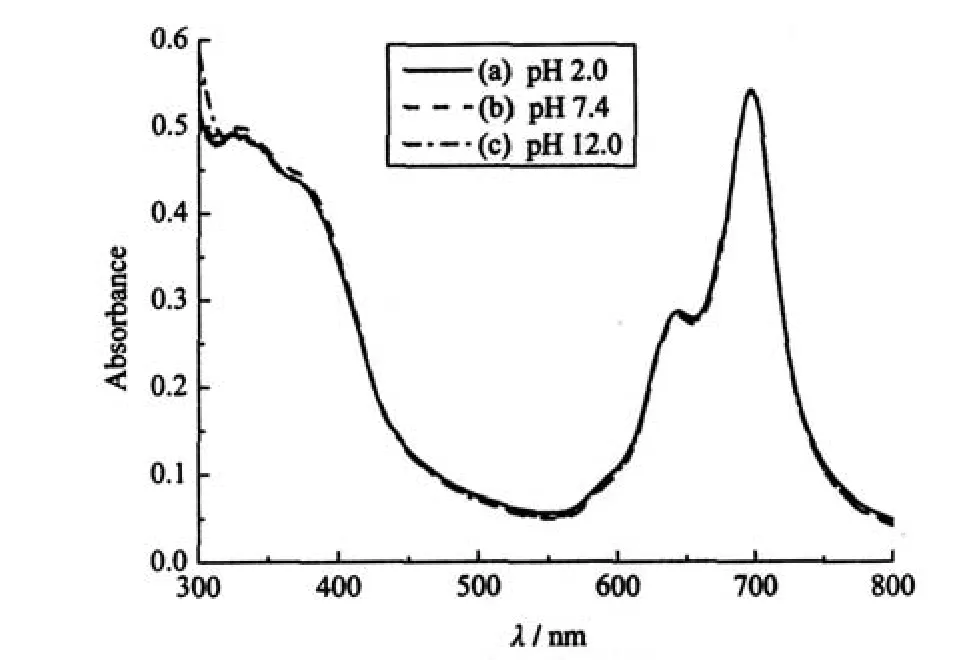
图7 结合物1-HSA在pH值为(a)2.0,(b)7.4和(c)12.0的PBS溶液中的电子吸收光谱Fig.7 Electronic absorption spectra of 1-HSA in PBS with(a)pH=2.0,(b)pH=7.4,and(c)pH=12.0 [1]=5 μmol·L-1
但是,当酞菁1通过共价结合的方式负载到白蛋白大分子上后,体系pH值的改变几乎不影响其电子吸收光谱性质和存在状态(见图7),酞菁1仍然保留着以单体为主的存在状态.这说明共价结合物(1-HSA)的光谱性质在较大范围内不受体系pH值的影响,是一个pH值不敏感体系.人体内有些组织的环境为酸性或碱性,如胃液具有较强的酸性,而肠道则呈现弱碱性,因此设计pH值适应范围宽的光敏剂有实际意义.
本文中其它几种酞菁与白蛋白的共价结合物也表现出相似的、不受pH值干扰的光谱性质.
游离的酞菁和酞菁-白蛋白共价结合物对体系pH值的不同响应,从一个侧面也说明结合物中酞菁分子通过形成酰胺键固定在白蛋白大分子上了.
3 结 论
利用含羧基酞菁的羧基和白蛋白的氨基,通过成酰胺键的方式,制备了一系列高水溶性的、未见报道的酞菁-白蛋白共价结合物.结果表明:(1)四种含羧基的酞菁锌在PBS溶液中存在单体-聚集体平衡,相对而言,α位取代的酞菁1和3,较β位取代的酞菁2和4,以更多的单体形式存在;(2)当酞菁小分子共价结合到白蛋白大分子上后,其在PBS溶液中展现出比相应游离酞菁更显著的单体特征吸收,而且酞菁-白蛋白共价结合物的这种光谱特征不受环境酸碱度变化的影响.也即,羧基酞菁小分子通过成酰胺键的方式固定在白蛋白分子网格上后,其光谱特征受到一定程度的保护;(3)对于α位取代的酞菁1和3,其与白蛋白的共价结合物在PBS溶液中展现出以单体为主的电子吸收光谱特征,这是一个有利于产生光动力治疗效应的性质,且这种有利的光谱性质不受pH值变化的影响,这对于设计pH值适应范围宽、蛋白质靶向介导的高效光敏剂具有一定的启发意义.进一步生物活性测试正在进行中.
1 Dolmans,D.E.J.G.J.;Fukumura,D.;Jain,R.K.Nat.Rev. Cancer,2003,3:380
2 Huang,Z.Technol.Cancer Res.Treat.,2005,4:283
3 Detty,M.R.;Gibson,S.L.;Wagner,S.J.J.Med.Chem.,2004,47 (16):3897
4 Huang,J.L.;Huang,J.D.;Liu,E.S.;Chen,N.S.Acta Phys.-Chim. Sin.,2001,17(7):662 [黄金陵,黄剑东,刘尔生,陈耐生.物理化学学报,2001,17(7):662]
5 Yu,K.C.;Cheng,H.;Jin,L.ChinesePhotograph.Sci.Photochem., 2003,21(2):138 [俞开潮,程 红,金 玲.感光科学与光化学, 2003,21(2):138]
6 Chen,H.W.;Chen,J.C.;Chen,N.S.;Huang,J.L.;Wang,J.D.; Huang,M.D.Prog.Biochem.Biophys.,2009,36(9):1106 [陈宏炜,陈锦灿,陈耐生,黄金陵,王俊东,黄明东.生物化学与生物物理进展,2009,36(9):1106]
7 Huang,J.L.;Chen,N.S.;Huang,J.D.;Xue,J.P.;Liu,E.S.;Yang, S.L.Sci.China Ser.B,2001,44(2):113
8 Ke,M.R.;Huang,J.D.;Weng,S.M.J.Photochem.Photobiol.,A, 2009,201:23
9 Stehle,G.;Wunder,A.;Schrenk,H.H.;Hartung,G.;Heene,D.L.; Sinn,H.Anti-Cancer Drug.,1999,10:785
10 Sharman,W.M.;van Lier,J.E.;Allen,C.M.Adv.Drug Rev., 2004,56:53
11 Lang,K.;Mosinger,J.;Wagnerova,D.M.Coord.Chem.Rev., 2004,248:321
12 Jiang,X.J.;Huang,J.D.;Zhu,Y.J.;Tang,F.X.;Ng,D.K.P.; Sun,J.C.Bioorg.Med.Chem.Lett.,2006,16:2450
13 Zhu,Y.J.;Huang,J.D.;Jiang,X.J.;Sun,J.C.Inorg.Chem. Commun.,2006,9:473
14 Huang,J.D.;Lo,P.C.;Chen,Y.M.;Lai,J.C.;Fong,W.P.;Ng,D. K.P.J.Inorg.Biochem.,2006,100:946
15 Lin,W.;Peng,Y.R.;Chen,K.Z.;Wen,J.B.Chin.J.Anal.Chem., 2006,34(3):411 [林 伟,彭亦如,陈奎治,翁家宝,徐国兴.分析化学,2006,34(3):411]
16 Alarcón,E.;Edwards,A.M.;Garcia,A.M.;Muñoz,M.;Aspée,A.; Borsarelli,C.D.;Lissi,E.A.Photochem.Photobiol.Sci.,2009,8 (2):255
17 Wen,J.K.;Han,M.Medicinal molecular biology:theory and study technique.Beijing:Science Press,1999:219 [温进坤,韩 梅.医学分子生物学:理论与研究技术.北京:科学出版社,1999:219]
18 Wei,J.;Huang,J.L.Macromolecules,2005,38:1107
19 Lu,X.Q.;Shi,H.Y.;Wang,M.H.Chin.J.Immunol.,2009,25 (3):346 [卢希勤,施海燕,王鸣华.免疫学杂志,2009,25(3): 346]
20 Liu,T.;Zhang,G.F.;Zhou,W.B.;Su,Z.G.Chin.J.Anal.Chem., 2007,35(1):43 [刘 涛,张贵锋,周卫斌,苏志国.分析化学, 2007,35(1):43]
21 Mao,W.X.;Su,Y.;Tang,J.W.Chin.J.Org.Chem.,2006,26 (5):707 [毛文学,苏 勇,唐经武.有机化学,2006,26(5):707]
22 Li,X.Y.;He,X.;Ng,A.C.H.;Wu,C.;Ng,D.K.P. Macromolecules,2000,33:2119
23 Liu,W.;Jensen,T.J.;Fronczek,F.R.;Hammer,R.P.;Smith,K. M.;Vicente,M.G.H.J.Med.Chem.,2005,48:1033
24 Jori,G.J.Photochem.Photobiol.A,1992,62:371
25 Ng,D.K.P.C.R.Chimie,2003,6:903
26 Huang,J.D.;Liu,E.S.;Yang,S.L.;Xue,J.P.;Chen,N.S.; Huang,J.L.Chem.J.Chin.Univ.,2002,23(12):2287 [黄剑东,刘尔生,杨素苓,薛金萍,陈耐生,黄金陵.高等学校化学学报, 2002,23(12):2287]
February 19,2010;Revised:April 8,2010;Published on Web:June 9,2010.
Preparation and Spectroscopic Properties of Covalent Albumin Conjugates of Zinc Phthalocyanines Tetrasubstituted with Carboxyl Moieties
XIAO Rong-Ping KE Mei-Rong HUANG Jian-Dong*ZHANG Han-Hui*
(School of Chemistry and Chemical Engineering,Fuzhou University,Fuzhou 350108,P.R.China)
A series of covalently bound albumin(bovine serum albumin(BSA)and human serum albumin(HSA)) conjugates of phthalocyanines functionalized with carboxyls were prepared and resulted in amide bonds.The phthalocyanines are tetra-α-(4-carboxyl phenoxy)phthalocyanine zinc(1)and tetra-α-[4-(2-carboxyl-ethyl)phenoxy] phthalocyanine zinc(3)as well as their corresponding tetra-β-substituted counterparts(compounds 2 and 4).The spectroscopic properties of these phthalocyanines and their bioconjugates in phosphate buffer saline solution(PBS) were investigated.The phthalocyanines that are covalently bound to the albumins have a more obvious monomeric absorption characteristic than the corresponding free phthalocyanines.Moreover,the spectroscopic characteristics of the phthalocyanines in the bioconjugates are not affected by solution pH.The substitution position of the carboxyl moieties on the phthalocyanine ring has an effect on the spectroscopic transformation of these macromolecules after conjugation with the albumins.Substitution at the α-position of the phthalocyanine ring leads to more prominent spectroscopic changes than that at the β-position.Both 1-albumin and 3-albumin in PBS show monomeric phthalocyanine spectra with Q-band maxima at about 697 nm and 706 nm,respectively.
Phthalocyanine; Albumin;Covalent conjugate;Spectroscopic property;Photosensitizer
[Article] www.whxb.pku.edu.cn
*Corresponding authors.Email:jdhuang@fzu.edu.cn,hhzhang@fzu.edu.cn;Tel:+86-591-22866235.
The project was supported by the National Natural Science Foundation of China(20872016),Natural Science Foundation of Fujian Province,China (C0710033)and Program for New Century Excellent Talents in Fujian Province University,China(XSJRC2007-18).
国家自然科学基金(20872016)、福建省自然科学基金(C0710033)和福建省高等学校新世纪优秀人才计划(XSJRC2007-18)资助项目
O644

