人骨形态发生蛋白2基因治疗大鼠牙槽骨缺损的实验研究*
西安交通大学口腔医院(西安710004)
王 敏 程 政 姚天华 代 泉 郭秀全
骨形态发生蛋白2(BMP-2)是启动骨修复过程的关键因子。大量的研究已证实hBM P2在体内能诱导骨的形成,在体外对骨髓基质细胞(MSCs)有强烈的骨诱导活性,而且能够使诱导性骨细胞向确定性骨细胞转化[1]。我们拟通过以重组腺相关病毒为载体,介导h BMP-2治疗大鼠的实验性牙槽骨骨缺损。
材料和方法
1 实验动物和主要试剂 采用雌性成年SD大鼠30只,体重280~300g(西安交通大学医学院动物中心提供);高效表达人骨形态发生蛋白2腺病毒载体构建及目的蛋白的检测按作者早先的方法[2];Rabbit antiprotein试剂盒(北京博奥森生物技术有限公司提供)。
2 动物模型的建立及分组 所有的动物采用10%水合氯醛腹腔注射,麻醉剂量为0.4ml/100g。于下颌11牙间牙槽嵴处切开,分离牙龈及骨膜,暴露牙槽骨。用5号裂钻(3×105r/min)制作出贯通唇舌侧约2.0mm×2.0mm大小的人工骨缺损区。用0.9%生理盐水反复冲洗创伤面严密止血后,随即分成2组。实验组植入浸有 r AAV-hBMP2-GFP病毒液50u1(感染滴度3.6×1011/ml)的明胶海绵块;对照组植入浸有AAVGFP空病毒溶液50μl(感染滴度 3.6×1011/ml)的明胶海绵块。所有动物严密关闭伤口,术后前3d饮用水中加青霉素80万单位。术后除对照组2只动物意外死亡外,其余动物伤口均愈合良好。术后15d、30d、60d实验组分别处死动物5只,对照组分别处死动物4只,获取包括骨缺损及下颌11在内的骨组织块样品备用。
3 观察项目(1)X线检查:术后摄下颌11正位X片,应用计算机图像分析软件测定骨缺损区平均密度值(密度值范围0~1)。(2)组织学观察:各组一半样品用OCT包埋,-27℃切片(每个样品取2张切片),厚度16μm,载玻片上晾干,4%多聚甲醛固定 20min(室温),-20℃保存。从-20℃取出晾干,室温下浸0.3%TritonX-100溶液40min,水洗,PBS洗2~3次,羊血清封闭1h(37℃),浸于Rabbit anti BMP2(1∶100)溶液,4℃过夜(18h左右),PBS洗1h(换液3次以上),羊抗兔二抗-FITC(1∶50稀释),37℃2h,PBS洗1h(换液3次以上),甘油PBS封片,荧光显微镜观察,照相。各组一半样品10%甲醛液固定,PL脱矿,石蜡包埋,切片(每个样品2张切片),HE染色,普通光镜观察,照相。
4 统计学处理 应用SPPS13.0统计软件包对数据进行统计分析。实验数据以均数±标准差表示(±s),两组间比较采用t检验。
结 果
1 各组骨密度值检测结果见附表。两组样本牙槽骨缺损处的骨密度值随时间的增加而增高;在 15d、30d、60d,实验组样本牙槽骨缺损处骨密度值(0.062,0.236,0.456)均高于对照组(0.054,0.158,0.216),其中 30d、60d两组有显著性差异(P<0.05,P<0.01)。
附表 术后骨密度值检测结果(±s)
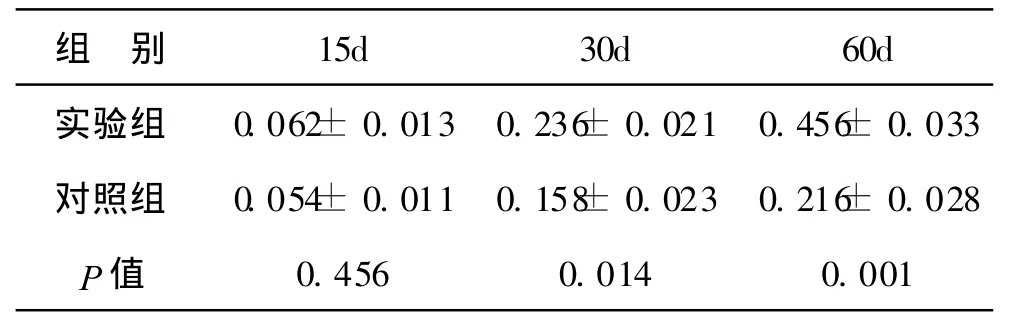
附表 术后骨密度值检测结果(±s)
?
2 组织学观察 ①免疫组化染色冰冻切片观察:两组样品术后 15d均可见绿色荧光蛋白(图1,图2);实验组30d和60d样品骨缺损区周边组织中绿色荧光强度较对照组明显加强(图3、图4)。②HE染色切片观察:实验组:术后 15d,牙槽骨缺损区周围组织成纤维细胞和毛细血管生长活跃,周边有骨样组织和少量的新生骨形成(图5);术后 30d,新骨形成增多向中心聚集;术后60d,缺损区几乎被新生骨组织充填,新生骨钙化加强(图6)。对照组:术后 15d,骨缺损区周边成纤维细胞和毛细血管生长活跃,术后30d,骨缺损区纤维组织弥散,周边可见成骨细胞和少量骨样组织;术后 60d,骨缺损区边缘有少量新骨沉积,腔内被纤维组织充满。

图1 实验组术后 15d GFP表达(30×)

图2 对照组术后 15d GFP表达(30×)

图3 实验组术后 30d GFP表达(30×)

图4 实验组术后 60d GFP表达(30×)

图5 实验组缺损区新生骨组织(HE×40)
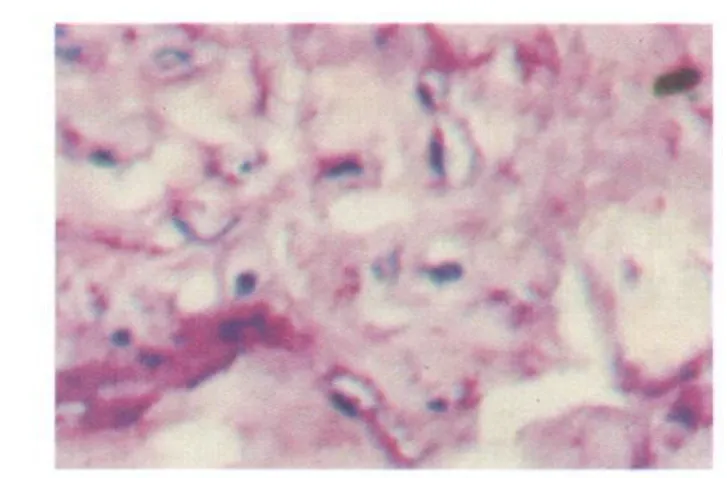
图6 实验组新生骨组织钙化加强(HE×40)
讨 论
虽然BMP-2在体内外均可诱导骨的形成,但由于生长因子价格昂贵、用量大、半衰期较短、易扩散、易降解等原因均限制了其应用。目前,基因治疗是骨缺损修复研究的热点之一,已有学者应用BMP-2进行局部基因治疗[3,4]。局部基因转导 BMP-2可以使基因产物向局部和靶向持续或缓慢的释放,减小全身副作用,同时内源性合成的蛋白质可能比外源重组的蛋白质具有更大的生物学活性[5]。本实验结果显示:两组样品15天冰冻切片染色后均发现牙槽骨缺损区周边组织有绿色荧光,表明 GFP基因已成功转染至牙槽骨缺损区周边的组织细胞,同时也表明目的基因 hBMP2也成功转染;实验组30天和60天绿色荧光强度明显比对照组增强,说明被转染h BMP2的组织细胞持续分泌hBMP2;实验组牙槽骨缺损处术后15天时就有骨样组织出现,术后30天有新生骨形成,60天缺损区几乎被新骨充满,新骨形成时间明显早于对照组,且成骨量也明显多于对照组,说明基因hBM P2已发挥成骨作用。推测其新骨发生机制:携带hBMP2目的基因的重组腺相关病毒液进入牙槽骨缺损区后,hBM P2基因迅速被转染给骨缺损区周边组织细胞,并成功表达 h BMP2。当局部h BMP2浓度达到一定程度后,牙槽骨缺损区周边结缔组织中未分化的、有活力的间充质细胞、骨膜基质细胞、骨膜细胞[6],还有牙周膜细胞开始向成骨细胞转化,成骨细胞再不断增殖并形成胶原蛋白,促进新骨基质形成及新骨沉积。因此我们认为,本实验应用重组腺相关病毒载体介导h BMP2基因治疗牙槽骨缺损是成功的。
在基因治疗中,载体的选择最为关键。本试验以重组腺相关病毒为载体介导 hBMP2基因直接植入大鼠体内,使hBMP2基因直接插入宿主细胞。这种方法操作简单,创伤小,费用低,但对载体的安全性、转染的靶向性和效率要求很高。近几年,重组腺病毒相关病毒载体以其明显的优势[7]倍受瞩目:(1)对宿主没有致病性;(2)能稳定转染宿主细胞,具有较长时期的基因表达能力;(3)极低的免疫原性;(4)有广泛的宿主群,可转染分化及未分化细胞。重组腺相关病毒的这些优势使其成为基因治疗载体研究的热点并很有希望用于临床基因治疗。重组腺病毒相关病毒介导人骨形态发生蛋白2目的基因治疗大鼠牙槽骨缺损的成功,为临床基因治疗牙周病骨缺损提供了实验和理论依据。今后我们将在诸如修复作用是否有剂量依赖性及与病毒滴度的关系等方面进行更深一步实验研究。
[1] Troen B R.Molecular mechanisms underlying osteoclast formation and and action[J].Exp Gerontol,2003,38:605-614.
[2] 程 政,王 敏,石剑峰,等.p AAV-hBM P2-IRES质粒的构建及病毒包装[J].临床口腔医学杂志,2009,25(1):13-15.
[3] Matsumoto A,Yamaji K,Kawani M.Effect of aging on bone formation induced by recombinant human bone morphogenetic protein-2 combined with fibrous collagen membrances at subperiosteal sites[J].Periodontal Res,2001,36:175-182.
[4] 岳 冰,汤亭亭,陆 斌,等.老年大鼠骨缺损的骨形态发生蛋白2的基因治疗[J].中华创伤杂志,2005,21(8):611-616.
[5] Kang R,Ghivizzani SC,Muzzonigro TS,etal.Orthopaedic applicationsof gene therapy [J].Clin Orthop,2000,375:324-327.
[6] 翟 波,刘丹平.骨形态发生蛋白基因治疗骨缺损 [J].中国组织工程研究与临床康复,2007,2(41):8333-8336.
[7] Kapturczak M H,Flotte T,Atkinson M A,etal.Adenoassociated virus(AAV)as a vehicle for therapeutic genedelivery:improvements in vectors design and viral production enhance potential to prolong graft survival in pancreatic islet cell transplantation for the reversal of type 1 diabetes[J].Curr Mol Med,2001,1:245.

