解偶联蛋白2在PM2.5致心肌细胞损伤中作用机制的初步探讨
郑贵浪 吴家兴
[摘要] 目的 初步探讨解偶联蛋白2(UCP2)在PM2.5致心肌细胞损伤中的作用。 方法 培养大鼠心肌细胞株H9C2细胞,给予siRNA和(或)PM2.5刺激,48h后检查肌酸激酶(CK)和乳酸脱氢酶(LDH),RT-PCR及Western Blot检测UCP2基因转录及蛋白水平,比色法检测线粒体的活性氧(ROS)和ATP酶的活性。 结果 与PM2.5组相比,PM2.5+siRNA组心肌细胞CK和LDH明显升高(969±21 vs 747±29U/mL,1071±59 vs 877±47U/L),ATP酶活性下降明显(24.7±4.7 vs 40.2±4.9U/mgprot),细胞内ROS明显增多(90.2±6.2 vs 69.2±6.3U/Well),差异均有统计学意义(P<0.05)。结论 PM2.5可以导致UCP2基因表达代偿性增多及心肌细胞损伤;RNA干扰沉默UCP2基因,会导致心肌损伤进一步加重;提示UCP2在PM2.5致心肌损伤过程中可能起着保护作用。
[关键词] 解偶联蛋白2;PM2.5;H9C2;心肌细胞;线粒体;活性氧;ATP
[中图分类号] R730.2 [文献标识码] A [文章编号] 2095-0616(2015)01-40-05
[Abstract] Objective To investigate the effect of UCP2 during the injury procedure of PM2.5 on the rat myocardial cells H9C2. Methods Rat cardiomyocytes H9C2 cell lines were cultured, after 48 hours of given PM2.5 and (or) siRNA stimulus, creatine kinase (CK) and lactate dehydrogenase (LDH) were detected. The expession of UCP2 in transcription and translation levels was detected by RT-PCR and Western Blot respectively. Mitochondrial reactive oxygen species (ROS) and ATP enzyme activity were determinated by colorimetric detection. Results Compared with the PM2.5 group, CK and LDH were elevated (969±21 vs 747±29 U/mL,1071±59 vs 877±47 U/L), ATP activity decreased (24.7±4.7 vs 40.2±4.9 U/mgprot), intracellular ROS increased (90.2±6.2 vs 69.2±6.3 U/Well) in the PM2.5+siRNA group. And the differences were statistically significant (P<0.05). Conclusion PM2.5 can lead to myocardial cell damage and increased expression of UCP2 gene, and the silence of UCP2 by RNAi lead to aggravating injury of H9C2 cells, indicating that UCP2 may play an protective effect during the injury procedure of H9C2 caused by PM2.5.
[Key words] UCP2; PM2.5; H9C2; Myocardial cells; Mitochondria; ROS; ATP
近年来,大气污染备受关注,其中颗粒物是城市大气污染的重要物质。根据粒径大小可将其分为空气动力学直径介于2.5~10μm粗颗粒物(PM10)和空气动力学直径小于2.5μm的细颗粒物(PM2.5)。PM2.5与人体健康关系最密切。PM2.5化学成分复杂,包括无机成分、有机成分、微量重金属元素、元素碳等,主要来自于人类活动如工业生产及交通运输工具尾气排放、工业生产及取暖的燃烧释放、吸烟的烟雾释放等[1]。
动物试验及临床流行病学调查显示,PM2.5与
人类心血管疾病有密切关系。PM2.5可促进心肌细胞变性和间质细胞增生,进而导致以心肌间质纤维化为主要表现的心肌重构[2-3];可以通过氧化应激反应损伤血管黏膜,引起血管通透性及血液黏度增加,加速主动脉和冠状动脉粥样硬化和斑块破裂过程[4-5];可以诱发心律失常、心肌缺血甚至心跳聚停等[6-7]。我们前期研究也表明,PM2.5可以导致H9C2心肌细胞线粒体损伤,导致活性氧(reactive oxygen species,ROS)产生过多,ATP合成减少,线粒体膜电位损害。解偶联蛋白(uncoupling proteins,UCPs)是线粒体内膜上能够通过转运H+降低线粒体膜电位蛋白家族,与细胞内的ATP及ROS有着密切的关系[8-9]。在5种同类物中,UCP2分布最广泛,体内和体外的研究发现,UCP2可以通过降低膜电位,减少ROS产生进而保护神经细胞组织[10]。
然而,UCP2在PM2.5导致的心肌细胞损伤过程中作用如何?目前研究甚少。本课题拟通过RNA干扰技术,沉默H9C2心肌细胞的UCP2表达,检测PM2.5毒染心肌细胞的ROS、ATP改变及心肌细胞损伤指标,初步探讨UCP2在PM2.5导致的心肌细胞损伤过程中的作用。
1 材料与方法
1.1 RNA干扰片段
由上海吉凯基因公司合成2条RNA干扰片段和1条阴性对照RNA干扰片段,分别为siRNA1,siRNA2和ncRNA。siRNA1序列为:上游,5-GCA CUG UCG AAG CCU ACA A dTdT -3';下游,5-UUG UAG GCU UCG ACA GUG C dTdT -3。siRNA2 序列为:上游,5- CCU CAU GAC AGA CGA CCU C dTdT -3;下游,5- GAG GUC GUC UGU CAU GAG G dTdT -3。ncRNA序列为:上游,5- UUC UCC GAA CGU GUC ACG UTT -3;下游,5- ACG UGA CAC GUU CGG AGA ATT -3。
1.2 siRNA转染步骤
(1)转染前1d,5×104H9C2细胞接种在24孔板上,0.5mL完全培养基,转染前细胞汇合达到70% ~ 80%;(2)在50μL无血清培养基加入2μL的siRNA,柔和混匀;(3)混匀lipofectamine试剂,用50μL无血清培养基稀释1μL的lipofectamine试剂,轻轻混匀,室温放置5min;(4)将稀释好的siRNA和lipofectamine试剂混合,轻柔混匀,室温放置20min,以便形成siRNA-ipofectamine复合物;(5)将100μL的siRNA-ipofectamine复合物加到含400μL完全培养基的细胞孔中,来回轻柔摇晃细胞培养板;(6)细胞在37℃,5%CO2培养箱中,培养24h,检测转染后UCP2的表达情况。用siRNA-CY3(广州瑞博公司)转染,通过荧光显微镜进行效率验证,计算转染效率。本实验转染效率达到80%左右,说明该转染步骤是可行的。
1.3 预实验筛选
UCP2基因有效的干扰片段:将H9C2细胞随机分成5组,即control组,lipo组,siRNA1组,siRNA2组,ncRNA组,分别给予同体积培养基、lipofectamine、siRNA1、siRNA2和ncRNA刺激,转染步骤同1.2;转染后48h检测UCP2转录水平表达,步骤同1.4。
1.4 RT-PCR检测UCP2基因表达
用TRIzol法提取H9C2细胞的总RNA,然后逆转录成cDNA,再以cDNA为模板进行扩增。根据读取的CT值对基因进行相对定量。RT-PCR反应体系为:forward/reverse引物各0.25?L,SYBP Green PCR master mix 5?L,cDNA模板4μL。PCR进行45个循环,条件为:95℃,5min,95℃,15s,60℃ 30s。UCP2引物为:5- GGG CAC CTG TGG TGC TAC CTG-3(sense),5-ATG AGC TTT GCC TCC GTC CGC-3(antisense);看家基因18s-RNA引物为:5-CCA TCC AAT CGG TAG TAG C -3(sense),5-GTA ATG GCG GGT CAT AAG-3(antisense)。
1.5 Western Blot检测UCP2蛋白表达
用2×SDS裂解细胞,12000g/min 离心5min,提取总蛋白,然后用BCA法迅速进行蛋白浓度定量。提取的总蛋白,加入2×SDS蛋白上样缓冲液(按1∶1的比例),100℃煮沸5min,-20℃保存备用。配置10% SDS-PAGE分离胶,5%的浓缩胶,微量进样器吸取30?g样品缓慢加入样品孔中,用100V进行浓缩胶电泳20min,140V在分离胶中电泳40min。然后转膜、封闭,加入一抗(proteintech 公司,货号:11081-1-AP) 4℃过夜,PBST洗膜,加入二抗37℃反应1h,用化学发光法(ECL)显影。
1.6 PM2.5的采样及其配制
选取湛江市区汽车流量大、污染较重的地区为采样点。用PM2.5采样仪采集PM2.5,超声震荡,洗脱颗粒物,冷冻真空干燥成干粉,-20℃保存备用。配制:称取一定量PM2.5干粉,经紫外线照射后加入培养基溶液混匀,配制成终浓度为10,50,100μg/mL的溶液进行预实验。根据预实验结果,本实验选用50μg/mL作为细胞毒染剂量。
1.7 H9C2细胞处理及分组
H9C2细胞株购自中国科学院典型培养物保存委员会细胞库,用10%小牛血清培养液,在37℃培养箱静置培养;1~3d更换一次培养液。PBS轻柔冲洗,适量0.25%胰酶溶液消化等常规操作,进行传代及实验。当细胞生长至70%左右密度时,将细胞随机分成三组,分别为NC组,PM2.5组及PM2.5+siRNA组,每组3个样本。三组细胞分别给予常规的培养基,50μg/mL的PM2.5培养基,含PM2.5(50μg/mL)与siRNA(80nmol/L)的培养基刺激。48h后检测相关指标。
1.8 肌酸激酶(CK)和乳酸脱氢酶(LDH)、ROS、线粒体ATP酶活力检测
(1)H9C2细胞受刺激后48h,收集细胞培养基上清液,按照试剂盒说明采用比色法进行检测CK和LDH浓度。乳酸脱氢酶(LDH)试剂盒(比色法),货号A020-1;肌酸激酶(CK)测定试剂盒(比色法),货号A032;试剂盒购自南京建成生物工程研究所。
(2)按照活性氧检测试剂盒进行操作,购自碧云天,货号S0033。简要步骤为:各组细胞经过处理后,按照试剂说明用1∶1000无血清培养液稀释DCFH-DA。去除细胞培养液,加入适当体积稀释好的DCFH-DA。37℃细胞培养箱内孵育20min,然后用无血清细胞培养液洗涤细胞3次。用荧光分光光度计检测[12],激发波长488nm和535nm。
(3)ATP酶可分解ATP生成ADP及无机磷,测定无机磷的量可判断ATP酶活力的高低。按照试剂盒采用比色法检测ATP酶活力(购自南京建成生物工程研究所,试剂盒货号:A016-1)。
1.9 统计学处理
所有计量资料均以()表示,并采用SPSS18.0统计软件进行统计分析。方差齐时,采用单因素方差分析进行统计,两组间比较采用LSD法分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 干扰片段的筛选
control组,lipo组,ncRNA组,siRNA1组和siRNA2组间UCP2基因mRNA相对含量有显著差异(F=3244,P<0.05);control组,lipo组和ncRNA组两两之间差异无统计学意义(0.983±0.07,0.975±0.06,0.976±0.06;P>0.05);与control组相比,siRNA1组,siRNA2组UCP2基因mRNA相对含量均显著下降(0.983±0.07 vs 0.556±0.11,0.369±0.12,P<0.05);其中siRNA2组下降尤其明显,故选择siRNA2作为UCP2基因的干扰片段进行后续的实验。
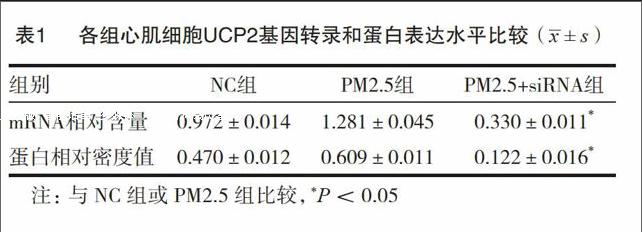
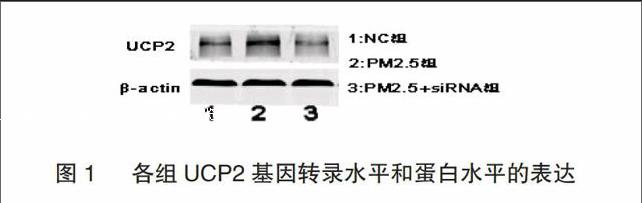
2.2 各组UCP2基因转录水平和蛋白水平的表达
NC组,PM2.5组及PM2.5+siRNA组间UCP2基因mRNA相对含量及UCP2蛋白条带相对密度值均有显著差异(F1=899,F2=1057;两者P<0.05);UCP2基因mRNA相对含量及UCP2蛋白条带相对密度值在PM2.5组明显升高,而在PM2.5+siRNA组明显降低,与NC组相比较,两差异均有统计学意义(两者P<0.05)。
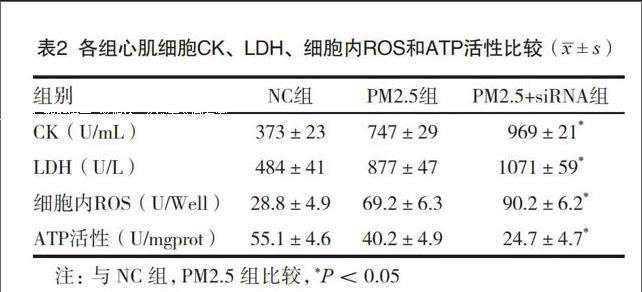
2.3 各组H9C2细胞CK及LDH水平
CK和LDH是反映心肌细胞损伤的重要指标。本实验发现,CK和LDH水平在PM2.5+siRNA组最高,在PM2.5组其次,在NC组最低,两指标在三组间的差异显著,均有统计学意义(FCK=429,P<0.05;FLDH=106,P<0.05)。
2.4 各组H9C2细胞ROS和细胞内ATP的水平
细胞ROS水平和ATP活性是反映线粒体功能的重要参数。本实验发现,PM2.5+siRNA组心肌细胞内ROS含量明显高于PM2.5组,PM2.5组的ROS明显高于NC组,三组两两之间差异均有统计学意义(FROS=86,P<0.05);而NC组ATP活性高于PM2.5组,PM2.5组ATP活性高于PM2.5+siRNA组,三组两两之间差异均有统计学意义(FATP=31,P<0.05)。见表2。
3 讨论
近年来,环境污染越来越受到重视。PM2.5作为大气污染的重要物质,可作为载体吸附有毒重金属、酸性氧化物、有机污染物、细菌和病毒等多种组分,严重危害人体健康。多项流行病学调查研究显示PM2.5不但可增加高血压、冠心病、糖尿病患者的心血管疾病发病率和死亡率,亦可增高健康人群心血管疾病发病率和死亡率[11-12]。PM2.5可诱发、加重人体的心血管病变,这一认识被越来越多的学者所认同。本实验通过培养大鼠心肌细胞株,给予PM2.5刺激,发现CK和LDH明显升高,提示PM2.5可以导致心肌细胞损伤。这与国内外学者发现的PM2.5对心血管系统的毒性作用相一致[13-15]。
线粒体是重要的细胞器,是细胞生物氧化和能量合成的重要部位,细胞能量的80%来源于线粒体的呼吸功能。此外,线粒体也是ROS产生的重要部位。正常的线粒体功能,是维持细胞内充足ATP合成和低浓度的ROS的必备条件。线粒体的功能障碍,常常导致线粒体产生过多的ROS和ATP的生成不足或过多消耗,导致细胞或机体的过氧化损伤和能量缺乏。解偶联蛋白(UCPs)是线粒体上的质子转运蛋白,属于线粒体阴离子通道家族。UCPs基因有高度的保守性,有6个家族成员,在人仅表达UCP1-5。UCP2基因位于11号染色体,与UCP3紧密连锁,相隔仅6000bp。UCP2蛋白广泛表达于各种组织细胞,现在多数认为其是保护性因素[16-18]。在神经系统中的保护方面,UCP2可以通过解偶联作用,将H+转运入线粒体,降低膜电位,减少ROS产生,维持细胞内的ATP水平,达到保护细胞的作用[19-20]。
我们前期的实验发现,PM2.5可以通过损害心肌细胞的线粒体,破坏线粒体膜电位和线粒体的超微结果,导致线粒体ROS产生过多,ATP合成减少,进而损害细胞。然而,UCP2是否在PM2.5损害心肌细胞的线粒体的过程中起着保护作用,目前研究很少。RNA干扰是研究基因的流行技术。本实验通过设计UCP2基因的干扰片段,进行预实验,筛选出siRNA2作为干扰序列进行进一步研究。siRNA2导致了UCP2基因在转录和蛋白均出现低水平的表达,为探讨UCP2的在PM2.5毒性过程的作用提供了基础。
本实验发现,通过RNA干扰沉默UCP2的表达,会导致细胞内ROS产生增多和细胞内ATP含量的减少,后者更进一步导致细胞的损害,表现为CK和LDH的明显升高。PM2.5导致的UCP2过表达可能是细胞的代偿反应,抑制UCP2表达将促进细胞的进一步损害。这就间接地表明,UCP2可能是PM2.5导致心肌细胞损害过程中的保护因素。然而,本实验也存在明显不足:(1)仅仅采用了沉默基因方法,没有尝试过表达UCP2,再观察UCP2的作用;(2)指标检测方面没有将线粒体膜电位及线粒体肿胀度,线粒体生物修复功能等方面加以研究UCP2的作用。
综上所述,PM2.5可以导致心肌细胞损伤,代偿性引起UCP2表达增加;RAN干扰UCP2表达后,会导致细胞内ROS过度增多及ATP活性下降,从而加重细胞的损害;这一结果间接地表明,UCP2基因在PM2.5导致的心肌细胞损伤过程中可能起着保护作用。
[参考文献]
[1] Wichmann HE. Daily mortality and fine and ultrafine particles in Erfurt, Germany part I: role of particle number and particle mass[J]. Res Rep Health Eff Inst, 2000(98): 87-94.
[2] Vallejo M. Ambient fine particles modify heart rate variability in young healthy adults[J]. J Expo Sci Environ Epidemiol, 2006, 16(2): 125-130.
[3] 郑灿军, 王菲菲,郭新彪. 大气PM_(2.5)对原代培养大鼠心肌细胞的毒性[J]. 环境与健康杂志, 2006(1): 17-20.
[4] Urch B. Acute blood pressure responses in healthy adults during controlled air pollution exposures[J]. Environ Health Perspect, 2005,113(8):1052-1055.
[5] 董晨, 宋伟民,施烨闻.PM_(2.5)颗粒物引起血管内皮细胞氧化损伤的研究[J]. 卫生研究, 2005(2):169-171.
[6] Mills NL.Ischemic and thrombotic effects of dilute diesel-exhaust inhalation in men with coronary heart disease[J]. N Engl J Med, 2007,357(11): 1075-1082.
[7] Berger A. Runs of ventricular and supraventricular tachycardia triggered by air pollution in patients with coronary heart disease[J]. J Occup Environ Med, 2006,48(11): 1149-1158.
[8] Mailloux RJ,Harper ME.Uncoupling proteins and the control of mitochondrial reactive oxygen species production[J]. Free Radic Biol Med,2011,51(6):1106-1115.
[9] Basu Ball W.Uncoupling protein 2 negatively regulates mitochondrial reactive oxygen species generation and induces phosphatase-mediated anti-inflammatory response in experimental visceral leishmaniasis[J]. J Immunol, 2011,187(3): 1322-1332.
[10] Conti B. Uncoupling protein 2 protects dopaminergic neurons from acute 1,2,3,6-methyl-phenyl-tetrahydropyridine toxicity[J]. J Neurochem, 2005,93(2):493-501.
[11] Schneider A. Changes in deceleration capacity of heart rate and heart rate variability induced by ambient air pollution in individuals with coronary artery disease[J]. Part Fibre Toxicol, 2010,7: 29.
[12] Lipsett MJ. Long-term exposure to air pollution and cardiorespiratory disease in the California teachers study cohort[J]. Am J Respir Crit Care Med, 2011,184(7): 828-835.
[13] Liu Y. Inhalation of diesel exhaust does not exacerbate cardiac hypertrophy or heart failure in two mouse models of cardiac hypertrophy[J]. Part Fibre Toxicol, 2013,10: 49.
[14] Wagner JG. PM2.5-induced cardiovascular dysregulation in rats is associated with elemental carbon and temperature-resolved carbon subfractions[J]. Part Fibre Toxicol, 2014,11: 25.
[15] 段军.可吸入颗粒物对大鼠心脏交感神经分布和神经生长因子表达的影响及β受体阻滞剂的干预作用[D].北京:北京协和医学院,2012:20-22.
[16] Azzu V. The regulation and turnover of mitochondrial uncoupling proteins[J]. Biochim Biophys Acta, 2010,1797(6-7): 785-791.
[17] Baffy G. Uncoupling protein-2 and cancer[J]. Mitochondrion, 2010,10(3): 243-252.
[18] Brand MD. Mitochondrial uncoupling protein 2 in pancreatic beta-cells[J]. Diabetes Obes Metab, 2010,12 (Suppl 2): 134-140.
[19] Diano S. Uncoupling protein 2 prevents neuronal death including that occurring during seizures: a mechanism for preconditioning[J]. Endocrinology, 2003,144(11): 5014-5021.
[20] Mattiasson G. Uncoupling protein-2 prevents neuronal death and diminishes brain dysfunction after stroke and brain trauma[J]. Nat Med, 2003,9(8): 1062-1068.
(收稿日期:2014-10-17)

