强化生物除磷系统胞内聚合物测定方法优化
由 阳,彭永臻,,王淑莹,刘秀红
(1.哈尔滨工业大学 市政环境工程学院,哈尔滨150090,youyang1979@sina.com.cn;2.北京工业大学 环境与能源工程学院,北京100124)
多聚脂肪酸(PHA)、糖原和多聚磷酸盐(poly-P)是强化生物除磷系统(EBPR)中聚磷菌(PAO)体内的主要能量和物质贮存方式,聚磷菌在厌氧条件下吸收废水中的碳源,贮存PHA,分解体内的多聚磷酸盐,把正磷酸盐释放到水体中,释放能量,分解糖原.在好氧状态下,聚磷菌分解PHA 并释放出能量,用以细胞合成和糖原积累,大量吸收水体中的正磷酸盐,在体内贮存多聚磷酸盐颗粒[1].可见,多聚磷酸盐是PAO 体内磷以及能量的贮存物质;PHA 为细胞生长和糖原合成提供前体;糖原水解的过程中为脂肪酸转化成PHA 提供还原力.因此,PHA、多聚磷酸盐以及糖原的贮存能力是直接影响系统除磷性能的关键因素.准确定量这3 种物质对研究和评价强化生物除磷系统非常重要.
PHA 的测定分为提取和测定两步[2-3].测定有分光光度法和气相色谱法两种,其中分光光度法的灵敏度比气相色谱法要低很多.糖原的定量方法包括把聚合物水解成葡萄糖和测定葡萄糖量两个步骤[4].定量葡萄糖有高效液相色谱和化学分析两种方法,其中高效液相色谱灵敏度高.正磷酸盐的测定一般采用国标方法.本研究将色谱法和化学分析手段相结合,对强化生物除磷系统内的这3 种多聚物的测定方法进行了优化,试图找到准确快捷、在实验室简单易行的测定方法.
1 实 验
1.1 PHA 的测定
PHA 是在细胞质中被一层膜物质包围的大约0.2 到0.5 μm 的颗粒[5].在聚磷菌体内,细胞内贮存的PHA 是一种典型的共聚物,这种共聚物主要由3-羟基丁酸(3HB)和3-羟基戊酸(3HV)单体组成,还有一少部分的3-羟基,2 烷基丁酸(3H2MB)和3-羟基,2-甲基戊酸(3H2MV).
本研究中PHA 测定采用的方法[6-7]为:从EBPR 反应器中取得活性污泥后,按1%(体积分数)的比例与甲醛混合以抑制污泥中微生物的活动.混合液经离心后上清液去除,然后以磷酸盐混合液清洗样品,再次离心后上清液再次去除.之后样品在-36 ℃,0.076 mbar 下冷冻干燥(Labconco,American)脱水20 h.用天平(Mettler,Switzerland)称取冻干污泥30 mg 和PHB、PHV 标准品一起放入有胶塞并配有螺旋扣塑料帽的玻璃管中,加入2 mL 氯仿和2 mL 酸化甲醇酯化液(酯化液为含有4%,10%,20%硫酸的甲醇).紧紧密封盖子后放入干式恒温器(Sanyo,Japan)中,在100 ℃下消解2,4 或20 h.冷却到室温后加入1 mL 的纯水(Millipore,American),混合后剧烈震荡以去除氯仿相中的残渣.静沉1 h 以实现相的分离,然后以移液器(Gilson,France)吸出下层的氯仿相放入另一个小瓶中,以硫酸钠干燥后,3 μL上色谱分析.PHB 和PHV 的标准样品采用美国西格玛公司产品(sigma,cat NO.81329,403105),分别准确称取0.5,1,1.5,2,2.5,3.0 mg标准样品放入消解瓶中,其他测定步骤跟污泥样品测定相同,上气相色谱分析后做得标准曲线PHB 为:y =221.529 0 x -95.518 3,回归系数为0.999 15.PHV 标线为:y=353.560 4 x+10.403 8,回归系数为0.999 13.
气相色谱(hp 6890N,American)配备HP INNOVAX 色谱柱(30 m length×320 μmID×0.25 μmfilm),进样口温度200 ℃,分流比为1∶25,氮 气 做 载 气,FID 检 测 器 工 作 温 度 为250 ℃,炉温采用程序升温,150 ℃保持1 min,然后以10 ℃/min的速度升到250 ℃并保持1 min.
1.2 糖原的测定
糖原是一种分支状的聚合体,它由葡萄糖单体以糖苷键连接而成.它的定量方法包括把聚合物水解成葡萄糖和测定葡萄糖量两个步骤.然而区别葡萄糖是糖原水解产生的还是其他碳氢化合物水解产生的是不可能的,所以,目前大多研究都不是定量糖原,而是定量总碳水化合物.定量葡萄糖有高效液相色谱和化学分析两种方法,其中高效液相色谱灵敏度高,但是对色谱柱的选择和维护要求比较高,费用很高.
本实验中糖原测定的前几个步骤与PHA 测定的步骤相同,污泥样品经预处理,清洗,20 h 冻干后,准确称量30 mg 放入带胶塞和螺旋塑料盖的玻璃瓶中.然后加入5 mL 0.4,0.6 或0.8 mol/L HCl,在恒温培养箱(Sanyo,Japan)中100 ℃下消解1,3,5 或7 h,冷却后以0.25 μm 的膜过滤.取样品2 μL 以葡萄糖氧化酶法试剂盒(北京北化康泰临床试剂有限公司)测定样品中的葡萄糖含量.
1.3 多聚磷酸盐的测定
聚磷菌贮存在体内的多聚磷酸盐颗粒又叫做异染颗粒,它是由正磷酸盐单体以酯键结合形成的线性或环形聚合物.多聚磷酸盐的测定基本分为3 个步骤:1)样品的干燥脱水.2)生物质消解使多聚磷酸盐颗粒转化成正磷酸盐.3)正磷酸盐的测定.
本实验先测得反应器上清液中正磷酸盐质量浓度,再使用纯水清洗污泥样品,采用冻干机干燥,准确称量0.45 mg 后放入250 mL 锥型瓶中,加入100 mL 纯水和40 mL 5%(质量分数)过硫酸钾溶液[8],盖塞包紧后放入压力灭菌锅(Sanyo,Japan)后于110,120 和130 ℃中分别加热20,30,40 min,冷却后移至250 mL 容量瓶中定容,取出少量以钼锑抗光度法测定正磷酸盐质量浓度.污泥中聚磷的含量既为消解后正磷酸盐与消解前正磷酸盐浓度之差.试剂空白和标准溶液系列也经同样的消解操作.标准曲线为y =104.59x -0.015 9,回归系数为R2=0.999 6.
本实验中利用的活性污泥样品都来自于有PAOs 富集的、以丙酸为唯一碳源的EBPR 反应器.富含PHB 的污泥采自SBR 反应器厌氧阶段末端,富含多聚磷酸盐颗粒和糖原的污泥取自SBR 反应器好氧阶段末端.
2 结果与讨论
2.1 PHA 的测定优化
以不同酸化甲醇体积分数提取PHB 的提取物结果见图1.可以看出,PHB 的提取量受酸化甲醇体积分数影响很大,4%的酸化甲醇取得了最大回收量.这个结果与很多研究是一致的[2],另外,10%和20%酸化甲醇的样品在大于10 h 消解时,提取物的量都有下降趋势,这是由于过大的酸化甲醇体积分数引起样品中的3HB 片段的进一步降解,产生了另外一些更简单的有机物,导致提取的PHB 的量减少.所以,4%的酸化甲醇体积分数是最合适的.从图中还可以看出,消解生物质产生3HB 单体需要一定的反应时间,在2 h 时,提取物的量很少,而当反应时间达到11 h 后,提取物的量有大幅度的提高,而4%酸化甲醇的样品甚至在11 ~20 h 之间还有提高,这说明足够的反应时间是必要的.虽然Adrian[2]等人认为2 h 的反应时间就可以提取细胞内的大部分PHB,但是本研究经过多次重复实验表明,只有达到充足的反应时间才能达到最大的回收量.

图1 不同消解时间提取PHB 的比较
以不同酸化甲醇体积分数提取PHV 提取物的结果见图2.
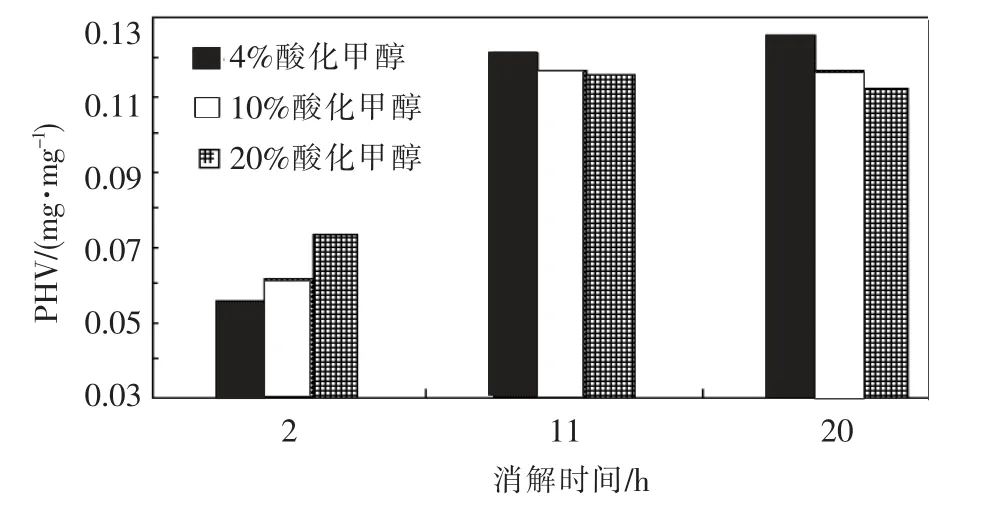
图2 不同消解时间提取PHV 的比较
与PHB 相比,PHV 的提取受酸化甲醇体积分数变化的影响不大,20%酸化甲醇的提取物在消解大于10 h 时,还是会有量的减少,这说明在这个体积分数下,PHV 也会发生降解.4%和10%酸化甲醇的样品在消解20 h 时都能达到最大回收,所以,这两个体积分数比较适合提取PHV.同样,PHV 的消解反应需要至少11 h 的时间.
为了检测4%的酸化甲醇和消解20 h 提取PHB、PHV 方法的准确度,采用加标回收实验的方法进行考察.取5 份冻干后的污泥样品放入消解瓶后再加入PHB 和PHV 纯品,进行加标回收实验,结果见表1.

表1 加标回收实验结果
从表1 可知,以4%的酸化甲醇和消解20 h 来提取PHB 和PHV,准确度很好,说明这一方法的测量值接近于真值,系统误差小,加标回收率分别为98.6%~102.1%和97.1%~102.5%.
2.2 糖原的测定优化
样品经预处理、冻干、消解成葡萄糖后,可以通过多种方法测定葡萄糖含量.国际上EBPR 系统糖原的测定多采用高效液相色谱法HPLC[9-10].本研究初始阶段试图应用配有C18柱(waters,American)的液相色谱(waters,American)分离葡萄糖,使用折光率检测器,0.6 mL/min,0.004 mol/L H2SO4做流动相,但经多次实验,C18 柱无法把葡萄糖和消解液中的其他物质分离开,这可能是因为消解液的离子间力太强,阻碍了葡萄糖的分离.后期实验采用氧化酶法葡萄糖试剂盒[11]测定葡萄糖含量,在不同消解时间和盐酸浓度下糖原的提取结果见图3.

图3 不同消解时间和盐酸浓度下糖原的提取
从图3 可以看出,消解时间对糖原的提取量影响很大,在相同HCl 浓度下,不同的消解时间下提取的糖原量有很大不同,以0.6 mol/L HCl为例,消解时间为1 h 回收到的糖原量为0.028 947 mg/mg,随着消解时间不断增加,回收到的糖原量也不断增加,到消解5 h 时,回收量已经达到0.105 3 mg/mg.但是继续增加消解时间并不能进一步增大回收量反而会由于样品的进一步消解导致葡萄糖回收量的减少.此外,消解HCl浓度对葡萄糖回收量的影响也很大,当消解时间很短时,回收量会随着HCl 浓度的增加而增加;当消解时间为3 或5 h 时,回收量先增加再减少;而当消解时间为7 h,回收量会随着HCl 浓度的增加而减少.总体来说,以0.6 mol/L 的盐酸消解5 h 可以达到最大的葡萄糖回收量.
为了研究此方法的精密度,还进行了精密度实验,取4 个污泥样品,分别平行测定6 次,同时附空白,结果见表2.从表2 可知,当取样量控制在氧化酶法要求的线性范围内时所得的相对标准偏差和变异系数都比较小,说明测定值与它们的均值的差距较小,偶然误差小,因而实验结果的精密度较好.
2.3 多聚磷酸盐颗粒的测定优化
提取的聚磷酸盐颗粒的量与不同消解时间和消解温度的关系可见图4,由图可见,聚磷酸盐颗粒的提取量受消解时间和温度影响很大,过高的消解温度(130 ℃)并不能显著提高多聚磷酸盐的提取效率,对于把磷酸盐聚合物降解成正磷酸盐这一反应来说,120 ℃的反应条件已经足够,而110 ℃明显不能使反应充分进行.同样,足够的反应时间是必要的,20 min 不能使反应完全,反应基本是在30 min 时达到最大回收量,40 min 是多余的,因此,120 ℃,30 min 是消解多聚磷酸盐颗粒的最佳反应条件.
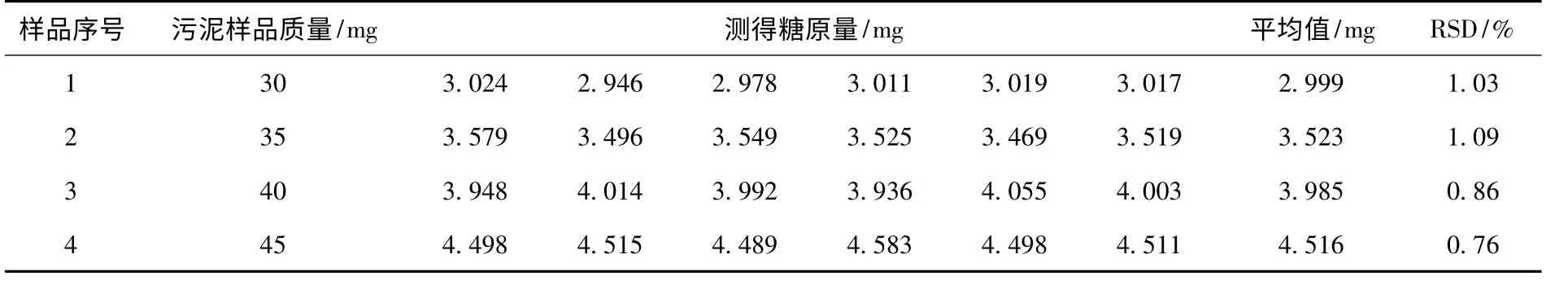
表2 精密度实验结果
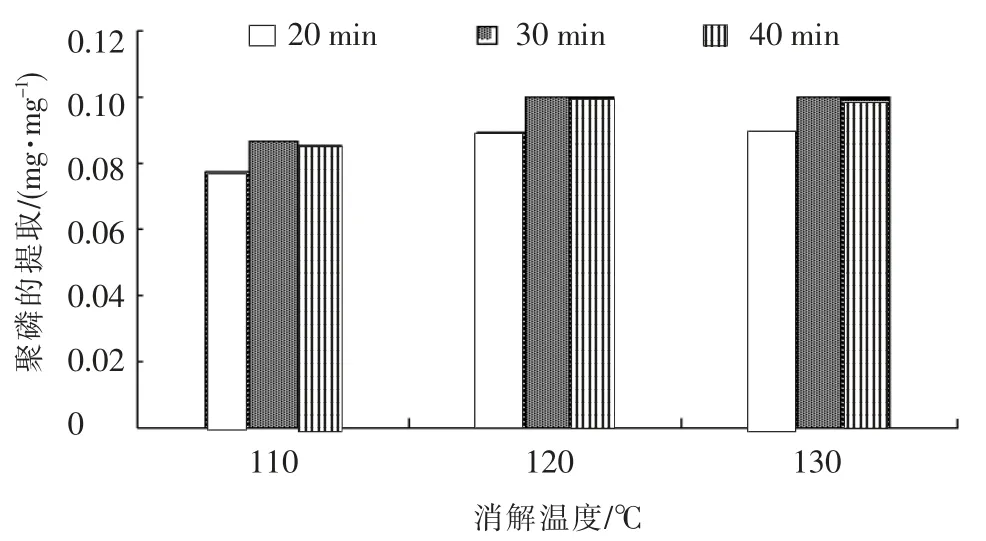
图4 不同消解时间和消解温度下聚磷的提取
为考察冻干污泥量与其相对应的多聚磷酸盐质量浓度的相关性,分别取30 ~50 mg 的10 个样品,测得多聚磷酸盐质量浓度,同与其对应的取样量进行线性回归分析,结果见表3.
整理表3 中的数据得出消解污泥量与消解液中P 含量之间存在相关性,含P 量y=0.101 x-0.042 6,相关性R2=0.994,可见消解污泥量x 与消解液中总P 量y 存在较好的相关性,本方法可行.
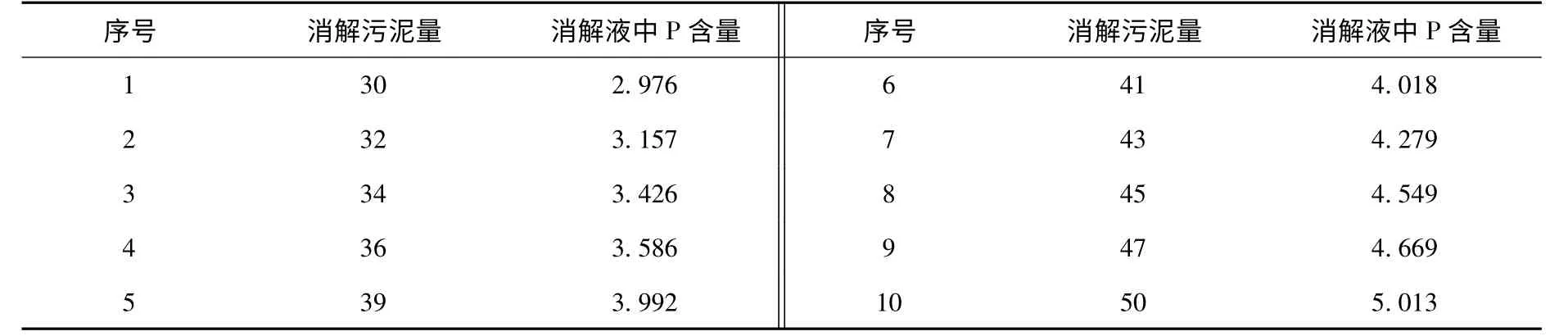
表3 消解污泥量与消解液中含P 量的分析结果 mg
3 结 论
1)对强化生物除磷系统胞内聚合物的测定方法进行了优化,其中PHA 采用化学物质提取,气相色谱定量;多聚磷酸盐颗粒采用过硫酸钾氧化,抗坏血酸法测定;糖原采用稀盐酸消解,葡萄糖试剂盒法比色测定.
2)经过方法优化和精密度、准确度分析,4%酸化甲醇消解20 h 是提高PHA 回收量的最佳条件.糖原在0.6 mol/L HCl 条件下消解5 h 提取量最大.在120 ℃、氧化30 min 条件下多聚磷酸盐颗粒可以最大回收.
[1]MINO T,LOOSDRECHT van M C M,HEIJNEN J J.Microbiology and biochemistry of the enhanced biological phosphate removal process[J].Water Res,1998,32(11):3193-3207.
[2]OEHMEN A,KELLER-LEHMANN B,RAYMOND J.Optimisation of poly hydroxyalkanoate analysis using gas chromatography for enhanced biological phosphorus removal systems[J].Journal of Chromatography A,2005,1070:131-136.
[3]陈银广,陈坚,堵国成,等.生物可降解塑料PHB 提取的研究进展[J].化工进展,1998,1:41-45.
[4]OEHMEN A,ZENG R J,YUAN Zhiguo.Anaerobic metabolism of propionate by polyphosphate-accumulating organisms in enhanced biological phosphorus removal systems[J].Biotechnology and Bioengineering,2005,91(1):43-53.
[5]SUDESH K,ABE H,DOI Y.Synthesis,structure and properties of poly hydroxyalkanoates:Biological polyesters[J].Prog Polym Sci,2000,25:1503-1555.
[6]LU Huabing,OEHMENA A,VIRDIS B.Obtaining highly enriched cultures of Candidatus Accumulibacter phosphates through alternating carbon sources[J].Water Research,2006,40:3838-3848.
[7]OEHMEN A,YUAN Zhiguo,BLACKALL L L,et al.Comparison of acetate and propionate uptake by polyphosphate accumulating organisms and glycogen accumulating organisms[J].Biotechnology and Bioengineering,2005,91(2):162-168.
[8]陈国梅.钼酸铵分光光度法测定城市污泥中的总磷[J].中国给水排水,2006,22(2):85-86.
[9]PHILIP L B,ROBERT E,MICHAEL W,et al.Identification of some of the major groups of bacteria in efficient and nonefficient biological phosphorus removal activated sludge systems[J].Applied and Environmental Microbiology,1999,65(9):4077-4084.
[10]LU Huabing,KELLER J,YUAN Zhiguo.Endogenous metabolism of Candidatus Accumulibacter phosphatis under various starvation conditions[J].Water Research,2007,41:4646-4656.
[11]AHN J,SCHROEDER S,BEER M.Ecology of the microbial community removing phosphate from wastewater under continuously aerobic conditions in a sequencing batch reactor[J].Applied and Environmental Microbiology,2007,73(7):2257-2270.

