柄海鞘对锌的生物富集作用
姜爱莉,于 贞,王长海
(烟台大学 海洋学院,山东 烟台264005,jal9035@163.com)
固着性的滤食性生物对一些重金属离子有高度富集作用,同时其由于自身代谢的混合氧化系统存在缺陷,其体内化合物的释放与鱼类或甲壳类相比就慢得多,结果造成其体内较高的富集程度[1-2],对海洋环境中重金属的生物地球化学循环起着重要作用.由于滤食性动物对重金属具有很高的累积能力,且能够可靠地反应周围环境的重金属水平,作为指示生物广泛用于监测近岸水域的重金属污染[3-5],对它们的研究和应用也受到日益重视.滤食性生物对重金属的累积包括两条重要途径:对颗粒态的消化作用和对溶解相的吸收作用.由于它们具有很高的滤水能力,对溶解态重金属的吸收可能是机体累积重金属的一个非常重要的来源.很多学者研究了双壳类动物对重金属的富集作用,特别是牡蛎和贻贝[6-8].柄海鞘作为黄渤海重要的固着性滤食动物,其生物量大,滤水能力强,在沿海海域的重金属生态系统中占据重要角色,而目前关于这方面的研究报道很少.
本文利用半静态的生物富集动力学模型[9-10],研究了柄海鞘对不同质量浓度Zn2+的富集作用,用以估计Zn2+在生物体内的富集程度并对人类的潜在威胁进行预测,以期为海洋环境质量的评价和改善提供重要参考资料.
1 实 验
1.1 实验材料
实验用柄海鞘采自污染较轻的烟台近海,实验前在实验室流水驯养两周以上,选择湿重8.0~9.5 g,生长良好的生物个体进行实验.实验海水经沉淀、砂滤和0.45 μm 膜过滤处理,符合国家一类海水标准(GB3097-1997),pH7.5 ~7.9,盐度为32‰左右,Zn2+质量浓度(18.84 ±3.68)μg/L.实验期间水温控制在(20±2)℃.
根据《中华人民共和国海水水质标准》(GB3097-1997)3 类水质标准和近几年黄渤海水域的重金属污染状况的不同倍数设置4 个Zn2+质量浓度梯度:0.1,0.5,1.0 和2.0 mg/L.
用ZnSO4·7H2O 配制5.0 mg/mL 的Zn2+溶液(蒸馏水配制),向实验海水中加入一定量的Zn2+溶液,使海水中最终Zn2+含量达到设定值.
1.2 半静态双箱式生物富集动力学模型的实验方法
实验分富集和排出两个阶段进行,各进行40 d.
富集阶段:在12 个0.6 m3的长方形玻璃钢水槽中进行,其中加入0.5 m3含不同质量浓度Zn2+的海水,每个水槽中放入120 只海鞘.实验采用半静态的方法,即每两天换一次同质量浓度的实验海水,以保持水体Zn2+质量浓度基本恒定.水槽中分别充氧,保证实验过程中水体含氧量不低于6.5 mg/L.实验温度为(20±2)℃.每天早晚用硅藻(Nitzschia closterium)喂生物各1 次.为避免重金属通过生物放大作用进入海鞘体内,投喂时将海鞘从实验水槽中取出,分别放入30 L 的硅藻溶液中(密度约为5×106/mL-1)30 min.第0,2,5,9,13,18,23,19,35,40 天分别从各实验组取出柄海鞘4 只,取出后迅速冷冻,备分析.每个质量浓度设3 个平行样.
排出阶段:富集实验结束后,将每个水槽中剩下的柄海鞘分别置于0.2 m3的玻璃钢水槽中,流水暂养,每天喂以硅藻两次.第0,2,5,9,14,20,26,33,40 天各取海鞘4 只,迅速冷冻备分析.
1.3 生物样品的处理
实验过程中取出的海鞘解冻后,用不锈钢剪刀进行解剖,将柄海鞘分为背囊、生殖腺、消化腺和其他部分,准确称重后,用均质器匀浆,微波消化.
1.4 重金属的测定
按照海洋监测规范GB17378-1998,采用火焰原子吸收分光光度法测定水体和生物体内Zn2+含量.
1.5 半静态双箱模型描述[4]
半静态双箱式生物富集动力学模型是研究重金属的生物累积和生物有效性的动力学模型,特定金属的生理学参数可通过实验来测定,然后综合估算动物体内的重金属质量浓度.
实验过程中,由于一开始生物对金属的富集速率比较快,取样频率也相对高一些.实验的两个阶段用方程描述为
富集过程:
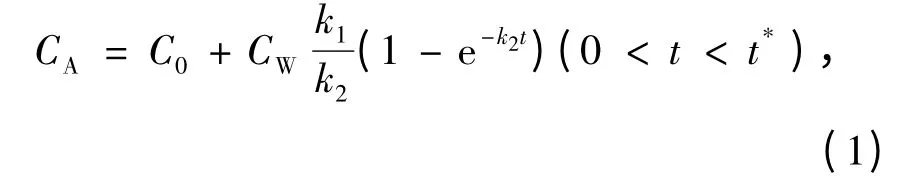
排出过程:
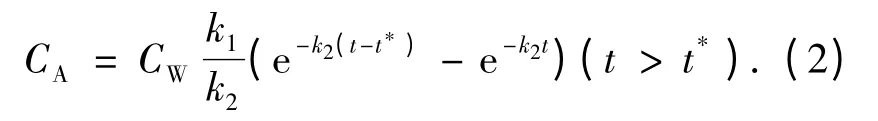
式中:t*为富集阶段结束的天数(d),即40 d,C0为实验开始前生物体内金属的含量(μg/g).
由式(1)和(2)对富集和排出实验中动物体内重金属质量浓度的检测结果进行非线性拟合,即可得到k1和k2的值.
生物富集因子(FBC)可用下式得到:
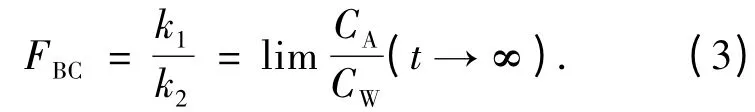
生物的半衰期用公式表示为

富集达到平衡时,生命体内金属含量QAmax可表示为

即使没有达到浓度平台,双箱模型也可用来计算理论平衡状态下的动力学参数.
2 结果与讨论
2.1 柄海鞘不同组织对锌的富集和排出作用
柄海鞘不同部分中的锌含量与时间的关系见图1 ~5,对富集过程和排出过程分别进行拟合,得到其富集动力学参数,见表1,2.
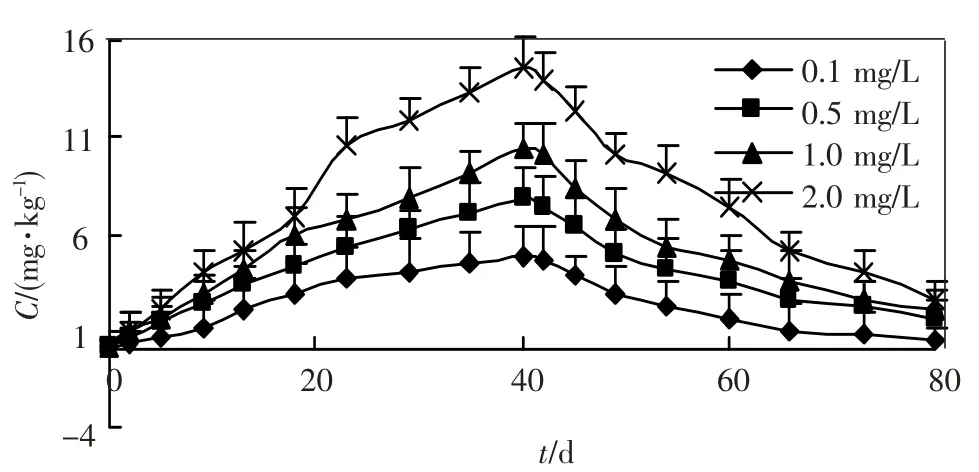
图1 柄海鞘整体对锌的富集和排出作用
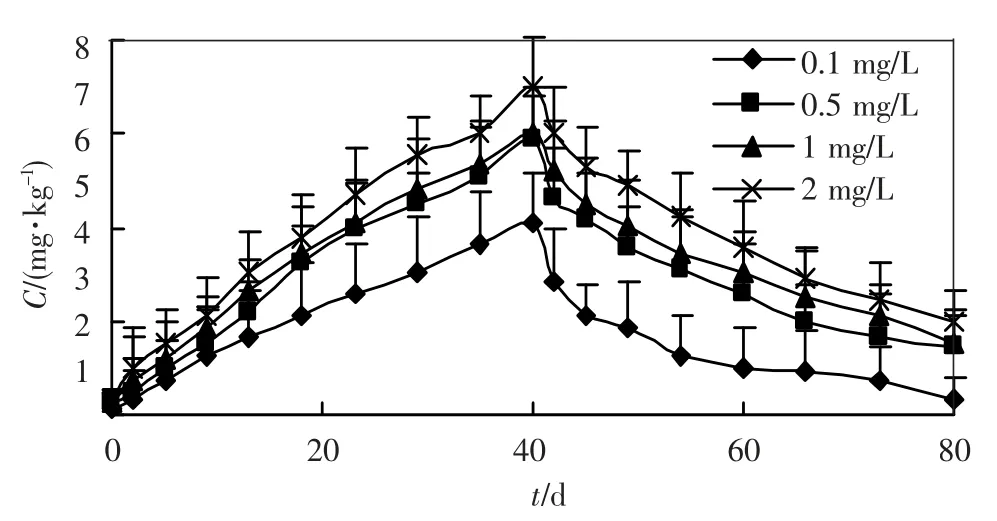
图2 柄海鞘外背囊对锌的富集和排出作用
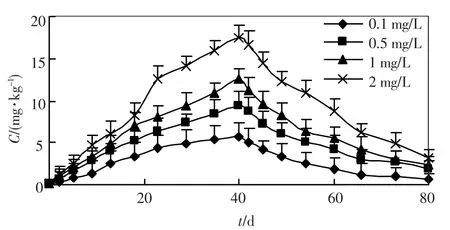
图3 柄海鞘消化腺对锌的富集和排出作用
将柄海鞘暴露于被锌污染的养殖水体后,便不断富积水体中的锌,其体内的锌含量随时间增加而增加.到 40 d 投药结束时,柄海鞘体内的锌是海水中锌质量浓度的4 8.1 倍(0.1mg/L)、15.6倍(0.5mg/L)、10.5倍(1.0 mg/L)和7.2 倍(2.0 mg/L).随着海水中锌质量浓度升高,柄海鞘体内锌的含量也上升,但是富集倍数却呈下降趋势.
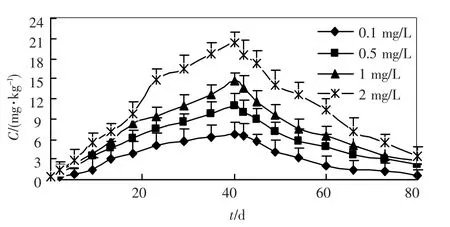
图4 柄海鞘生殖腺对锌的富集和排出作用

图5 柄海鞘其他部分对锌的富集和排出作用
柄海鞘移入新鲜海水中后,体内的锌迅速排出,10 ~20 d 后排出速度有所降低,到排出实验结束,柄海鞘体内的锌含量分别为0.490 mg/kg(0.1 mg/L)、1.580 mg/kg (0.5 mg/L)、2.006 mg/kg(1 mg/L)和2.529 mg/kg(2 mg/L).外背囊中锌含量的排出率明显低于其他器官.
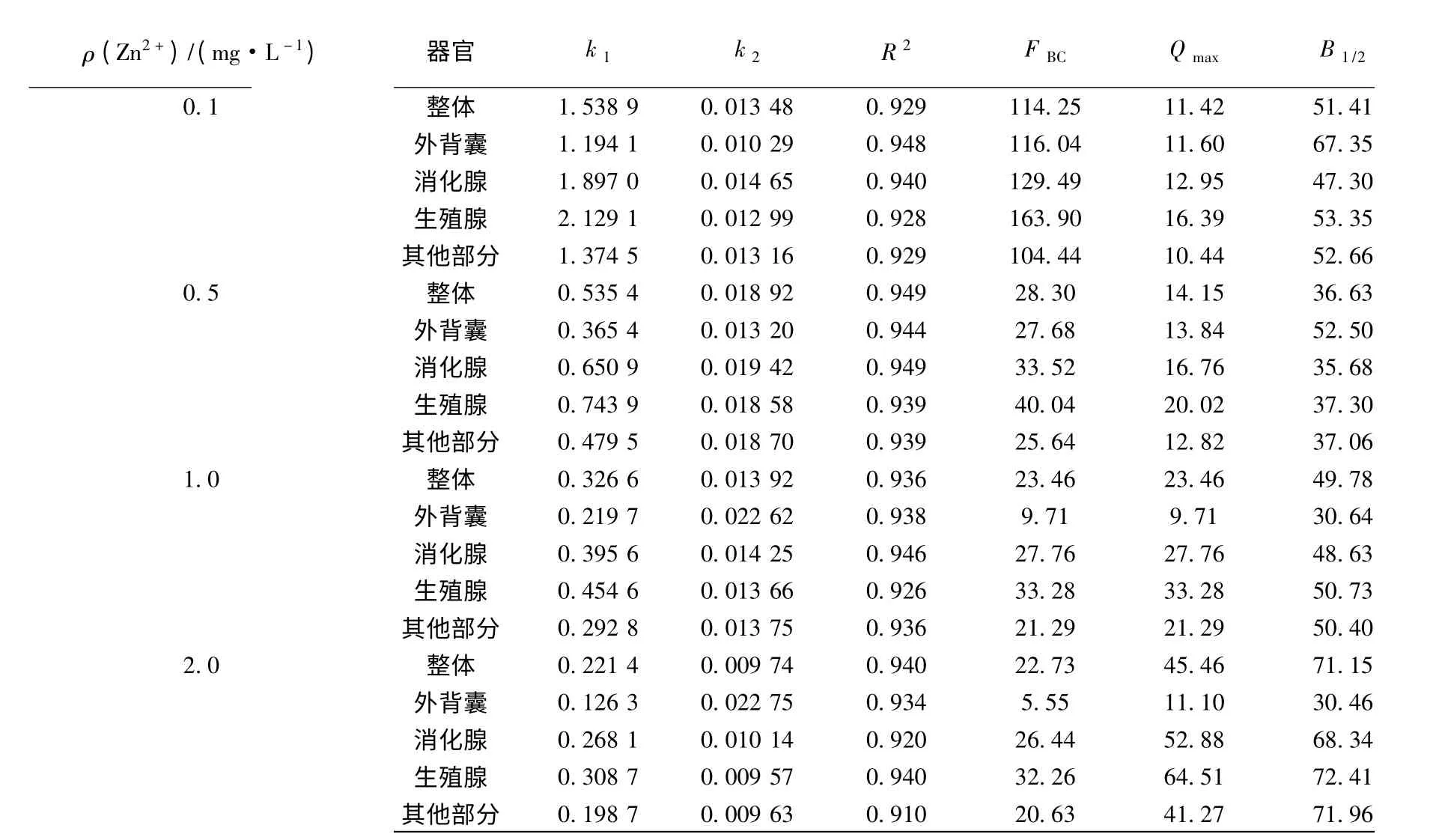
表1 富集过程柄海鞘对锌的富集动力学参数

表2 排出过程柄海鞘对锌的富集动力学参数
回归分析结果表明,在富集阶段,柄海鞘不同器官对锌的吸收速率常数k1均随着外部水体质量浓度的增大而减小,如在0.1 mg/L 的溶液中,柄海鞘整体对锌的吸收速率常数为1.538 9,随着水体中锌质量浓度的增加,k1值分别降低为0.535 4(0.5 mg/L)、0.326 6(1.0 mg/L)和0.221 4(2.0 mg/L).在排出阶段也表现出相似的趋势.
在本实验的净化排出阶段,由于采用的是流水系统,可认为生物在这一阶段只排出体内已富集的金属,而从水体中重新吸收的金属近似为零,所以利用方程(2)进行曲线拟合得到的k2值比吸收阶段得到的k2更加真实可靠.
随着海水中Zn2+质量浓度的提高,海鞘体内各部分的锌含量各有不同程度提高,各部分的锌含量依次为:生殖腺>消化腺>其他部分>外背囊.各部分对锌的富集系数FBC基本是随着外部水体Zn2+质量浓度的增大而减少.其中外背囊对锌的富集系数随质量浓度变化较小,而消化腺、生殖腺和其他部分的富集系数变化则比较明显.各部分对锌的富集系数依次为:生殖腺>消化腺>其他部分>外背囊.各部分对锌富集的平衡状态下生物体内金属含量QAmax也随着外部水体质量浓度的增大而增大.
排出阶段柄海鞘排出一半体内己富集的锌所需的时间,即生物学半衰期B1/2为11.36 ~23.98 d,随暴露溶液质量浓度的提高而增加.与富集速度相比,排出速度略高,有利于海鞘将进入体内的金属锌尽快排出体外,减少过量的金属锌对机体的危害.
2.2 富集平衡时柄海鞘富集Zn2+的最大量QAmax
通过曲线拟合得到的吸收速率常数k1,排出速率常数k2,得到生物体富集金属达到平衡时,体内富集金属的最大量QAmax.QAmax与外部水体质量浓度的关系如图6 和表3 所示.可以看出,富集平衡时,生物体内的锌含量与外部水体的锌质量浓度基本成正相关.
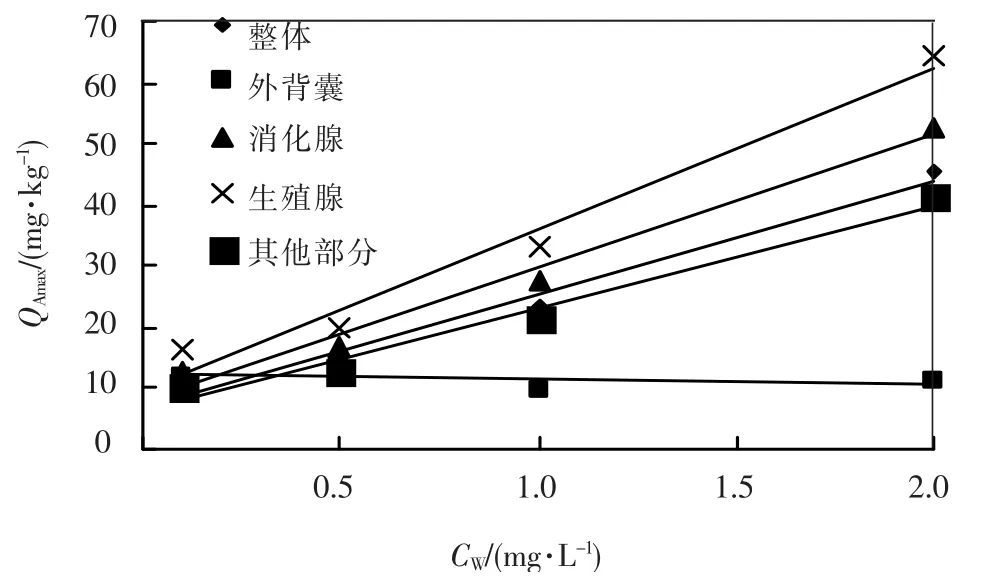
图6 柄海鞘体内锌含量与水体中Zn2+质量浓度的关系

表3 柄海鞘体内锌含量与水体中Zn2+质量浓度的关系(QAmax=aCW+b)
2.3 讨论
重金属在生物体内的富集程度取决于生物对重金属的吸收速率与排出速率,当吸收速率>排出速率,重金属在生物体内富集;相反,则不会出现富集现象.
柄海鞘属于固着性滤食动物,海水中的重金属在海鞘过滤海水的同时进入海鞘体内.溶解态重金属进入柄海鞘体内的大致途径为:海水中的Zn2+随海水从柄海鞘的入水管孔通入“萼杯”内消化管的前端,在柄海鞘的呼吸器官——咽腔进行初步吸附.因而这部分的锌含量较高,而柄海鞘一旦进入不含Zn2+的海水中,此部分的锌含量减少最快.经过滤的海水进入咽底壁,经纤毛规律性摆动,集中到咽上沟,运行到食道,进入咽腔下方的胃和肠.经过柄海鞘代谢后,部分排出体外,部分富集到生殖器官,另有部分经柄海鞘的体内转移作用,与外背囊进行结合贮存.这也是柄海鞘为避免过量重金属的毒害作用而具有的自身保护作用.因而在柄海鞘的外背囊中,锌含量缓慢增加;进入排出阶段后,有部分黏附在外背囊上的锌被流水冲刷掉,而结合在外被囊中的锌的释放速度则明显低于其他器官,表现为柄海鞘排出体内富集的锌所需的生物学半衰期B1/2高于其他器官.
同一种生物的不同器官,对重金属的富集系数往往不同.实验发现,柄海鞘的不同部分对重金属的富集作用有所差异,不同器官中的重金属含量依次为:生殖腺>消化腺>其他部分>外背囊.柄海鞘为滤食性动物,生殖腺与其他器官的物质交换很少,所以,在柄海鞘的生殖腺内金属锌的含量高于消化腺.对于其他水生生物来说,肝、鳃是鱼、虾、蟹体内重金属富集的主要部位,孙琪等测定了上海地区罗氏沼虾微量元素[11],证实虾头微量元素含量高,认为这与虾的肝、卵巢等器官对微量元素积累有关.刘长发从天津污水鱼塘中采集了养殖的各种鱼,测定其鳃、肝、肾、肌肉等部位中的铜、铅蓄积量,结果[12]是:不同种鱼铜铅蓄积量差异不大,但铜铅在不同部位中的蓄积量显著不同,肌肉中蓄积量明显低于鳃肝肾.二龄或三龄贻贝[13],各部位砷含量的高低为:内脏>生殖腺,鳃>体液.Cu、Pb、Ni 和Cr 在毛蚶体内含量分布顺序为[14]:鳃、外套膜、闭壳肌、内脏、肌肉;沼虾、河蟹对水体中的重金属有很强的富集能力,特别是肝胰脏、鳃、肾[15-16].因为肝的解毒作用,组织内可诱导产生大量束缚重金属的金属硫蛋白(MT),使肝成为体内蓄积重金属的主要部位;相比之下,肌肉对重金属的亲和力远比肝、鳃弱[17].但是上述结果多是自然水域中生物体内的重金属调查结果,与本实验相比,水体金属质量浓度较低,且生物体暴露时间长于本实验,因而与本实验通过回归分析得到的结果有所差异.
Rainbow[18]指出,海洋生物对重金属的富集实际上取决于金属进出生物体的速率.相对的速率变化决定了生物对特定金属的富集,并认为可以从调节型一直排列到强的净积累型,各类型之间都有过渡形式.研究表明,同是滤食性动物,牡蛎体内锌的富集量很高,而贻贝的富集量很低,这是由于牡蛎能富集高质量浓度的颗粒锌,而贻贝则会排出大量颗粒锌.因此,牡蛎是锌的强积累者,贻贝是锌的弱积累者或为不完全调节者.根据这个观点,我们认为柄海鞘是Zn 的强的净积累者.
从海鞘对锌的富集和排出过程可以发现,柄海鞘的生殖腺和外背囊中可蓄积大量的重金属,而且积累和排出速度缓慢,滞后于生长海域中的重金属情况;而消化腺中的锌可较准确地反映海水中的污染状况,因而作为海洋污染指示方面,海鞘的消化腺是一较理想的指标,而生殖腺和外背囊则可反映较长一段时间内的海水污染状况.
3 结 论
1)柄海鞘的不同组织对锌富集的吸收速率常数k1均随着外部水体质量浓度的增大而减小,排出速率常数k2为0.01 ~0.07.
2)柄海鞘的不同组织对锌的富集系数FBC基本是随着外部水体质量浓度的增大而减少.
3)富集平衡时,柄海鞘不同组织中的金属含量与外部水体的Zn2+质量浓度基本成正相关.
4)排出阶段锌在柄海鞘体内的生物学半衰期为11.36 ~23.98 d.
5)在柄海鞘的不同器官中的锌含量依次为:生殖腺>消化腺>其他部分>外背囊.
[1]REDDY R,PIUAI B R,ADHIKARI S.Bioaccumulation of copper in post-larvae and juveniles of freshwater prawn Macrobrachium rosenbergii(de Man)exposed to sub-lethal levels of copper sulfate[J].Aquaculture,2006,252:356-360.
[2]YANG R Q,ZHOU Q F,JIANG G B.Butyltin accumulation in the marine clam Mya arenaria:An evaluation of its suitability for monitoring butyltin pollutin[J].Chemosphere,2006,63:1-8.
[3]CINZIA A,FRANCESCA B,ROBERTA F,et al.Effects of exposure to sublethal copper concentration on glyoxalase system enzymes in specimens of Scapharca inaequivalvis[J].Biochem Sys Ecol,2006,34:275-281.
[4]TOMICIC C,DROZ P O.Age differences in biological monitoring of chemical exposure:A tentative description using a toxicokinetic model[J].Int Arch Occup Environ Health,2009,82:669-676.
[5]CAIHUAN K,WANG W X.Trace metal ingestion and assimilation by the green mussel Perna viridis in a phytoplankton and sediment mixture[J].Marine Biology,2002,140(2):327-335.
[6]李学鹏,励建荣,段青源,等.泥蚶对重金属铜、铅、镉的生物富集动力学[J].水产学报,2008,32(4):592-600.
[7]励建荣,李学鹏,王丽,等.贝类对重金属的吸收转运与累积规律研究进展[J].水产科学,2007,26(1):51-55.
[8]BAINES S B,FISHER N S,KINNEY E L.Effects of temperature onuptake of aqueous metals by blue mussels Mytilus edulis from Arcticand temperate waters[J].Marine Ecology-Progress Series,2006,308:117-128.
[9]王亚炜,魏源送,刘俊新.水生生物重金属富集模型研究进展[J].环境科学学报,2008,28(1):12-20.
[10]CROISETIERE L,HARE L,TESSIER A,et al.Modeling cadmium exchange by an aquatic moss(Fontinalis alecarlica)[J].Environmental Science&Technology,2005,39(9):3056-3060.
[11]孙琪,金恩汝,沈明飞.上海地区罗氏沼虾常量、微量元素及蛋白质测定[J].上海预防医学杂志,1996,8(5):215.
[12]刘发义,吴玉霖.重金属污染物在海洋生物体内的积累和解毒机理[J].海洋科学,1988,5(3):299.
[13]李春娣,颜文,龙爱民,等.Cu 暴露条件下翡翠贻贝(Perna viridis)消化腺内金属和类金属硫蛋白的变化[J].环境科学,2007,28(8):1788-1795.
[14]乌兰,谢骏,王广军,等.金属蛋白酶对奥尼罗非鱼生长、消化率及非特异性免疫功能的影响[J].南方水产,2007,3(3):8-13.
[15]CHANDRAN R,SIVAKUMAR A A,MOHANDASS S,et al.Effect of cadmium and zinc on antioxidant enzyme activity in the gastropod,Achatina fulica[J].Comp Biochem Physiol Part C,2005,140:422-426.
[16]BEBIANNO M J,COMPANY R,SERAFI A,et al.Antioxidant systems and lipid peroxidation in Bathymodiolus azoricus from Mid-Atlantic Ridge hydrothermal vent fields[J].Ecotoxicol Environ Saf,2005,75:354-373.
[17]ZAUKE G P.Toxicokinetic models as predictive tools in biomonitoring metals in zooplankton:A synthesis of ideas[J].Hydrobiologia,2008,614:3-18.
[18]DALLINGER R,RAINBOW P S.Ecotoxicology of Metals in Invertebrates[M].Boca Raton:Lewis Publisher,1993.

