外界条件对纳米TiO2 光催化性能的影响
赵淑梅,李玉胶,朱春城,周育红
(1.黑龙江省教育学院 化学系,哈尔滨150080;2.哈尔滨师范大学 化学化工学院,哈尔滨150025;3.哈尔滨工业大学 化学系,哈尔滨150001,yuhong806@yahoo.com.cn)
随着工业的迅猛发展,其中排放出来的一些难以降解的污染物成为环境污染问题之一,所以,研究一些新型的催化剂来降解这些污染物已成为目前研究的热点之一[1-4].TiO2半导体因其无毒、成本较低,具有良好的光催化性能,越来越受到关注,TiO2半导体多相光催化在有机和无机污染物的应用上得到了肯定,在环境治理方面有着不可估量的应用前景.但在实际应用中还存在着许多弊端,由于TiO2的光催化降解不仅受制于自身的光催化活性,也受环境因素影响,实际应用中存在局限.目前关于TiO2光催化活性方面研究较多的是就催化剂本身性质的影响因素进行研究,比如通过掺杂一些元素等改善催化剂本身的活性来提高光催化性能.而除了催化剂本身性质外,一些外界条件也影响着其催化活性,其中环境因素包括光照强度、pH 值及温度都会对光催化降解造成影响[6-10],本文就这几个影响因素进行讨论,通过改善外界条件来进一步提高光催化活性.
1 实 验
1.1 样品的制备
TiO2的制备:A 液,取10 mL 钛酸丁酯于35 mL无水乙醇中,在磁力搅拌下搅拌30 min,再超声30 min 使其完全溶解,分散均匀.B 液,取1.7 mL的盐酸和4 mL 去离子水混合均匀,超声20 min.
在磁力搅拌下,将B 液缓慢滴入到A 液中,再在磁力搅拌器下搅拌3 h,形成浅黄色透明溶胶.将所得溶胶超声30 min,然后于室温下静置,陈化后得到湿凝胶,将所得湿凝胶放入80 ℃烘干箱中干燥12 h,干燥后的干凝胶经研磨后置于500 ℃的马弗炉中煅烧2 h,随炉冷却至室温得TiO2粉末.
掺铁TiO2的制备:按上述步骤制备A 液,将上述B 液中的去离子水换成硝酸铁溶液(与钛酸丁酯的摩尔比为0.002∶1),其他过程同上,制备掺杂Fe3+的TiO2粉末.
1.2 光催化降解实验
称取50 mg 样品,加入到甲基橙溶液(20 mg/L)中,在不同光源、pH 值及环境温度下降解甲基橙,每隔10 min 取样,样品经过离心分离后在UV2600 紫外-可见分光光度计上测定在460 nm处的吸收光谱的变化,根据吸光度A 计算样品对甲基橙的降解率,得出光催化反应的最佳条件.
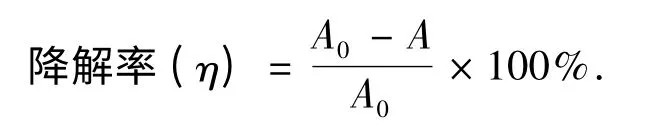
式中:A0为起始吸光度;A 为吸光度.
2 结果及讨论
2.1 催化剂的XRD 表征
X 射线粉末衍射采用荷兰飞利浦PW1700 X光衍射仪,测定条件是Cu 靶,40 kV/40 mA,石墨单色器.研究证明,在受同样外界条件下,锐钛矿型TiO2的光催化活性明显高于金红石型,二者价带位置相同而导带位置不同.从XRD 谱图上可以看出(图1),实验所得粉末分别在衍射角2 θ 为25.27°,37.8°,48°出现了较强衍射峰,这正是锐钛矿(101)、(004)、(200)面的衍射峰,显示了得到的样品主要是锐钛矿型,没有金红石相的出现.
从谱图上也可以看出,XRD 衍射峰窄而尖锐,表明晶粒生长较完全.另外,可以看到Fe3+的特征峰并没有出现,这说明少量掺杂的Fe3+已经均匀地分散在TiO2之中了,并没有改变催化剂的晶体结构.
2.2 扫描电镜分析
SEM 通过北京中科科仪技术公司的KYKYEM3900 型高性能扫描电子显微镜测得,图2 为TiO2与掺Fe3+TiO2的SEM 图对比,可以看出用溶胶凝胶法制备的TiO2粉体的颗粒粒径大小约是20 ~50 nm,都已达到了纳米级.而从图对比来看掺Fe3+样品的颗粒更加细小、均匀,这是由于Fe3+(0.64 Å)的离子半径与Ti4+(0.61 Å)的离子半径十分接近,Fe3+很容易进入TiO2的晶格中,取代了其中的一些Ti4+而引起TiO2晶格的畸变,这就降低了结晶度,抑制了晶粒的生长,使晶体颗粒得到细化,光催化活性进一步提高.

图1 纯TiO2 与掺铁TiO2 粉末的X 射线衍射图

图2 样品的SEM 照片
2.3 光照强度对光催化反应的影响
图3 为光强度对光催化活性的影响,主要讨论紫外光范围内的强度大小,同等条件下,3 种光源紫外光强度的大小顺序为:高压汞灯>日光灯>太阳光.从图3 可以看出,随着光照强度的增加,光催化活性也逐渐增强,甲基橙的降解率逐渐升高,这是由于光催化反应的活化能来源于光子的能量,光强越大,光激发产生的电子(e-)和空穴(h+)也就越多,相对地,产生的活化电子和空穴也就越多,而这些活化的电子和空穴穿过界面时可以各自还原和氧化吸附在表面上的物质,在TiO2半导体上形成氧化了的电子给体和还原了的电子受体,电子给体于Fe3+发生还原反应:

而电子受体又会与Fe2+发生氧化反应:
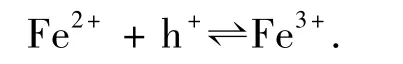
在光强度较大时,光催化反应速率进行较快,甲基橙的降解速率也较快.
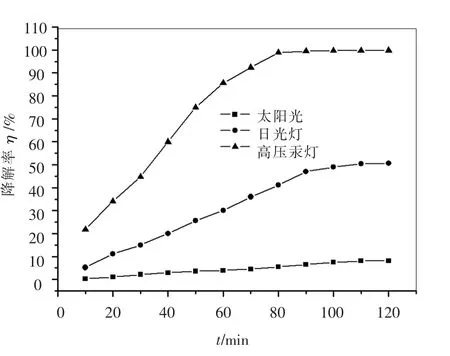
图3 光强度对光催化活性的影响
2.4 pH 的影响
图4 为pH 值对光催化性能的影响,溶液的pH 值在一定范围内对降解率有较大影响.在水中TiO2的等电点约为pH=6,pH 值接近TiO2的等电点时,由于范德华力的作用,颗粒之间容易团聚形成大颗粒.可以看出,当pH 为6 时,TiO2的光催化活性不高,而在较低pH 值下光催化效果较好.在pH 值较低的条件下,OH·易通过H+与被吸附O2
-系列结合,在形成H2O2的基础上进一步反应生成OH·,而羟基自由基在光催化反应中做氧化剂,它的作用与光生空穴的作用是等同的,由于羟基自由基的增多会加速氧化还原反应的进程,所以,光催化反应速率会提高.
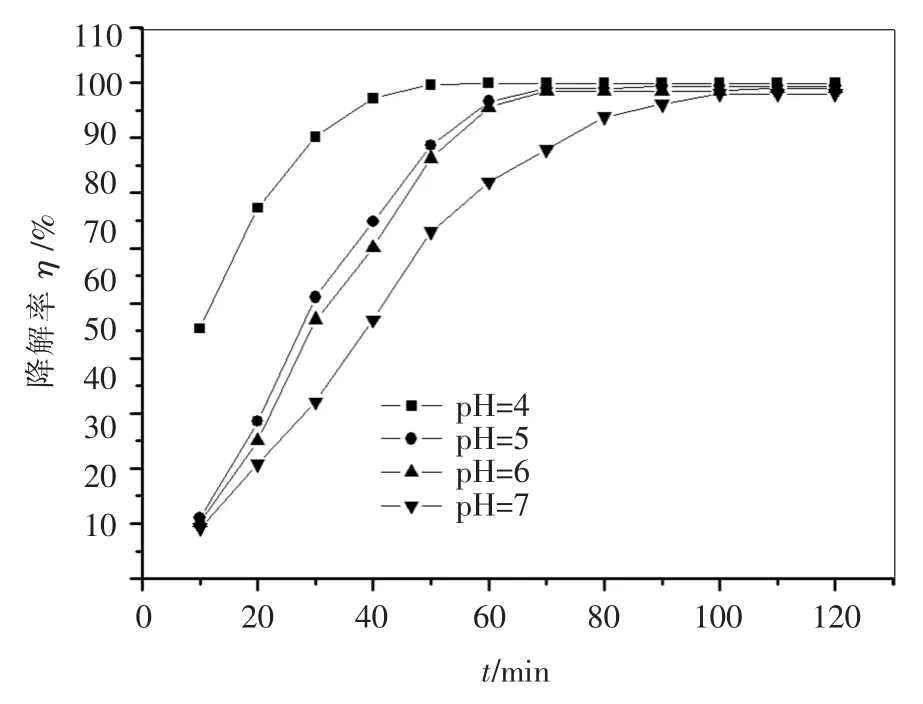
图4 pH 值对光催化性能的影响
图5 为几种不同pH 值条件下降解0.5 h 时甲基橙的降解率变化,可以看出,随着pH 值的降低,甲基橙溶液在460 nm 处的吸光度大大降低,这就表明甲基橙的降解率明显提高了.
2.5 温度的影响
光催化降解受温度的影响并不大,受温度影响的反应步骤主要是吸附、脱附、表面迁移和重拍,这些都不是光催化反应的决定步骤.但是在光催化反应过程中发生的一系列氧化还原反应,一般都伴随着吸热和放热效应,这就使得温度也会影响其速率.本实验在降解甲基橙的反应过程中反应速率在一定范围内随着温度的升高而升高,但升高的变化率不太显著.图6 为几个不同温度段掺杂催化剂对甲基橙降解率的影响,但温度影响程度都不大.
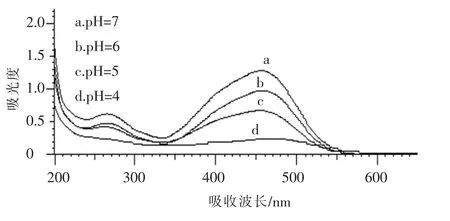
图5 不同pH 值光照0.5 h 时吸光度变化

图6 温度对光催化性能的影响
3 结 论
1)掺杂一定量的Fe3+没有改变TiO2锐钛矿型的结构,能够对TiO2的光催化活性起到改善作用.
2)在光催化降解过程中,外界条件在一定程度上也有很大影响.在降解甲基橙的研究中,降解率的对比表明:在一定范围内,光强度越大,光催化活性越大;pH 值较低时,光催化活性较高;温度越高,光催化活性增大幅度较小.
[1]NAHAR M S,HASEGAWA K,KAGAYA S.Adsorption and aggregation of Fe(III)-hydroxy complexes during the photodegradation of phenol using the iron-added-TiO2combined system[J].Journal of Hazardous Materials,2009,162:351-355.
[2]ARCONADA N,DURAN A,SUAREZ S.Synthesis and photocatalytic properties of dense and porous TiO2-anatase thin films prepared by sol-gel[J].Applied Catalysis B:Environmental,2009,86:1-7.
[3]SAYILKAN F,ASILTURK M,KIRAZ N.Photocatalytic antibacterial performance of Sn4+-doped TiO2thin films on glass substrate[J].Journal of Hazardous Materials,2009,162:1309-1316.
[4]郭中权,周如禄.纳米光触媒在煤矿生活污水处理中的实验研究[J].能源环境保护,2007,21(1):14-17.
[5]GAO B,PENG C,CHEN G Z.Photo-electro-catalysis enhancement on carbon nanotubes/titanium dioxide(CNTs/TiO2)composite prepared by a novel surfactant wrapping sol-gel method[J].Applied Catalysis B:Environmental,2008,85:17-23.
[6]ZHANG Sen,LIU Chunyan,LIU Yun.Room temperature synthesis of nearly monodisperse rodlike rutile TiO2nanocrystals[J].Materials Letters,2009,63:127-129.
[7]SAYILKAN F,ASILTURK M.Photocatalytic antibacterial performance of Sn4+-doped TiO2thin films on glass substrate[J].Journal of Hazardous Materials,2009,162:1309-1316.
[8]LIANG Haichao,LI Xiangzhong.Effects of structure of anodic TiO2nanotube arrays on photocatalytic activity for the degradation of 2,3-dichlorophenol in aqueous solution[J].Journal of Hazardous Materials,2009,162:1415-1422.
[9]MOZIA S,TOYODA M.Application of carbon-coated TiO2for decomposition of methylene blue in a photocatalytic membrane reactor[J].Journal of Hazardous Materials,2007,140:369-375.
[10]TRYBA B.Immobilization of TiO2and Fe—C—TiO2photocatalysts on the material for application in a flow photocatalytic reactor for decomposition of phenol in water[J].Journal of Hazardous Materials,2008,151:623-627.

